医薬品情報
| 総称名 | アコニップ |
|---|---|
| 一般名 | インドメタシン |
| 欧文一般名 | Indometacin |
| 製剤名 | 外皮用インドメタシン貼付剤 |
| 薬効分類名 | 経皮吸収型鎮痛消炎貼付剤 |
| 薬効分類番号 | 2649 |
| ATCコード | M01AB01 M02AA23 |
| KEGG DRUG |
D00141
インドメタシン
|
| KEGG DGROUP |
DG00241
インドメタシン
DG01504
非ステロイド性抗炎症薬 (NSAID)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年10月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アコニップパップ70mg | ACONIP PAP 70mg | テイカ製薬 | 2649719S1215 | 11.8円/枚 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又は他のインドメタシン製剤に対して過敏症の既往歴のある患者
2.2 アスピリン喘息(非ステロイド性消炎鎮痛剤等による喘息発作の誘発)又はその既往歴のある患者[重症喘息発作を誘発するおそれがある。][9.1.1参照]
4. 効能または効果
下記疾患並びに症状の鎮痛・消炎
変形性関節症、肩関節周囲炎、腱・腱鞘炎、腱周囲炎、上腕骨上顆炎(テニス肘等)、筋肉痛、外傷後の腫脹・疼痛
6. 用法及び用量
1日2回患部に貼付する。
8. 重要な基本的注意
8.1 消炎鎮痛剤による治療は原因療法ではなく対症療法であることに留意すること。
8.2 慢性疾患(変形性関節症等)に対して用いる場合には薬物療法以外の療法も考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 気管支喘息のある患者(アスピリン喘息又はその既往歴のある患者は除く)
重症喘息発作を誘発するおそれがある。[2.2参照]
9.1.2 皮膚感染症のある患者
感染を伴う炎症に対して用いる場合には適切な抗菌剤又は抗真菌剤を併用し、観察を十分行い慎重に使用すること。皮膚の感染症を不顕性化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。シクロオキシゲナーゼ阻害剤を妊娠中期以降の妊婦に使用し、胎児動脈管収縮が起きたとの報告がある。また、シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 皮膚 | 発赤、そう痒、発疹、かぶれ | ヒリヒリ感、腫脹 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 損傷皮膚及び粘膜に使用しないこと。
14.1.2 湿疹又は発疹の部位に使用しないこと。
14.1.3 必要に応じ、テープ等で保定することが望ましい。
16. 薬物動態
16.1 血中濃度
16.1.1 単回貼付
健康成人男性6名の背部に薬剤4枚(インドメタシン96mg/枚注))を12時間貼付したところ、インドメタシンの平均血漿中濃度は経時的に増加し、最高値は薬剤剥離時で14.9ng/mLとなった。薬剤剥離後は、生物学的半減期約11時間で減少した1)。
16.1.2 連続貼付
健康成人男性3名の大腿部前面に薬剤2枚(インドメタシン96mg/枚注))を1日2回、28日間連続して貼付したところ、インドメタシンの平均血漿中濃度は、貼付1日目で6.2ng/mLを示し、以後28日目まで7ng/mL前後の濃度で維持した。薬剤剥離後3日目には約1/4まで低下した1)。
16.3 分布
人工膝関節全置換術が予定されている患者6名の膝に薬剤1枚(インドメタシン96mg/枚注))を1日2回、数日間連続貼付したところ、各組織内濃度は次の通りで、貼付した深部へ分布し血清中より高濃度であった2)。
| 組織 | 皮下組織 | 関節包滑膜 | 滑膜 | 血清 |
| インドメタシンng/g(組織)又はng/mL(血清) | 20.7 | 21.6 | 19.0 | 1.33 |
16.5 排泄
16.5.1 単回貼付
健康成人男性6名の背部に薬剤4枚(インドメタシン96mg/枚注))を12時間貼付し、貼付開始後120時間まで遊離体および遊離体を含む抱合体の尿中排泄量を測定したところ、累積排泄量の平均は約400μgで、その90%程度は48時間までに排泄された1)。
16.5.2 連続貼付
健康成人男性3名の大腿部前面に薬剤2枚(インドメタシン96mg/枚注))を1日2回、28日間連続して貼付し、貼付開始後31日目まで遊離体および遊離体を含む抱合体の尿中排泄量を測定したところ、1日目の平均値は67.6μg、7日目には212μgに達し、以後28日目に薬剤剥離まで200〜250μgの排泄量を示した。薬剤剥離後3日目には剥離時の1/5程度に減少した1)。
注)本剤の承認された用法及び用量は、70mg/枚である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 変形性膝関節症を対象とした国内比較臨床試験
変形性膝関節症を有しX線所見上少なくとも骨棘形成が認められ明らかな疼痛・炎症症状を有する患者に対し、基剤を対照として、1回1枚、1日2回4週間患部に貼付した二重盲検試験の結果、最終全般改善度での改善率は72.4%(71/98例)を示し、有用度でも有用率70.4%(81/115例)であり、本剤の有用性が認められた3)。
副作用発現頻度は薬剤投与群で5.6%(7/126例)であった。副作用は発赤(7例)、そう痒(5例)であった。
副作用発現頻度は薬剤投与群で5.6%(7/126例)であった。副作用は発赤(7例)、そう痒(5例)であった。
17.1.2 一般外傷を対象とした国内比較臨床試験
打撲・挫傷、捻挫などの一般外傷を有し明らかな疼痛・炎症症状を有する患者に対し、インドメタシン軟膏との比較臨床試験の結果、最終全般改善度での改善率87.4%(76/87例)を示し、有用度でも有用率81.8%(72/88例)であり、本剤の有用性が認められた4)。
副作用発現頻度は薬剤投与群で7.3%(7/96例)であった。主な副作用は、かぶれ、発赤、そう痒が各(2例)であった。
副作用発現頻度は薬剤投与群で7.3%(7/96例)であった。主な副作用は、かぶれ、発赤、そう痒が各(2例)であった。
18. 薬効薬理
18.1 作用機序
インドメタシンは炎症のケミカルメディエーターであるプロスタグランジン(PG)の生合成を阻害することによって抗炎症作用を現す。PGは細胞膜の構成脂質であるアラキドン酸から生合成され、その律速酵素はシクロオキシゲナーゼ(COX)であるが、非ステロイド性抗炎症薬のPG生合成阻害機序はこのCOXの阻害である。
18.2 抗炎症作用
18.2.1 血管透過性亢進抑制試験(モルモット)、カラゲニン足浮腫抑制試験(ラット)、デキストラン足浮腫抑制試験(ラット)及び紫外線紅斑抑制試験(モルモット)の急性炎症モデルに対して優れた抗炎症作用を示しインドメタシン軟膏とほぼ同等であった5)。
18.2.2 アジュバント関節炎治療試験(ラット)の慢性炎症モデルに対して有意な抑制効果を示し、インドメタシン軟膏とほぼ同等であった5)。
18.3 鎮痛作用
炎症足圧痛抑制試験(ラット)でも著明な鎮痛作用を示し、インドメタシン軟膏とほぼ同等であった5)。
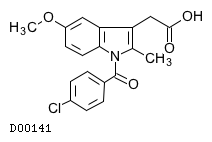
19. 有効成分に関する理化学的知見
19.1. インドメタシン
22. 包装
280枚(7枚入×40袋)、560枚(7枚入×80袋)
23. 主要文献
- 岩倉泰一郎他, 薬理と治療, 14, 1357-1365, (1986)
- 辻本正記他, 薬理と治療, 14, 4221-4224, (1986)
- 青木虎吉他, 基礎と臨床, 22, 743-761, (1988)
- 長屋郁郎他, 基礎と臨床, 22, 725-742, (1988)
- 岩倉泰一郎他, 薬理と治療, 11, 2091-2105, (1983)
24. 文献請求先及び問い合わせ先
文献請求先
テイカ製薬株式会社
学術グループ
〒930-0982
富山市荒川一丁目3番27号
電話:076-431-1717
FAX:076-431-6707
製品情報問い合わせ先
テイカ製薬株式会社
学術グループ
〒930-0982
富山市荒川一丁目3番27号
電話:076-431-1717
FAX:076-431-6707
26. 製造販売業者等
26.1 製造販売元
テイカ製薬株式会社
富山市荒川一丁目3番27号