医薬品情報
| 総称名 | ペンレス |
|---|---|
| 一般名 | リドカイン |
| 欧文一般名 | Lidocaine |
| 製剤名 | リドカインテープ剤 |
| 薬効分類名 | 貼付用局所麻酔剤 |
| 薬効分類番号 | 1214 |
| ATCコード | C01BB01 C05AD01 D04AB01 N01BB02 R02AD02 S01HA07 S02DA01 |
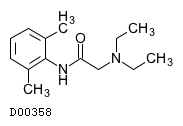
| KEGG DRUG |
D00358
リドカイン
|
| KEGG DGROUP |
DG00196
リドカイン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年4月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ペンレステープ18mg | Penles Tapes | 日東電工 | 1214701S1051 | 33.2円/枚 | 劇薬 |
2. 禁忌
次の患者には投与しないこと
本剤の成分又はアミド型局所麻酔薬に対し過敏症の既往歴のある患者
4. 効能または効果
○静脈留置針穿刺時の疼痛緩和
○伝染性軟属腫摘除時の疼痛緩和
○皮膚レーザー照射療法時の疼痛緩和
6. 用法及び用量
<静脈留置針穿刺時の疼痛緩和>
本剤を1回1枚、静脈留置針穿刺予定部位に約30分間貼付する。
<伝染性軟属腫摘除時の疼痛緩和>
通常、小児には本剤1回2枚までを、伝染性軟属腫摘除予定部位に約1時間貼付する。
<皮膚レーザー照射療法時の疼痛緩和>
通常、成人には本剤1回6枚まで、小児には下記枚数までを、レーザー照射予定部位に約1時間貼付する。
| 年齢 | 1回あたりの最大貼付枚数 |
| 3歳以下 | 2枚 |
| 4歳〜5歳 | 3枚 |
| 6歳〜7歳 | 4枚 |
| 8歳〜9歳 | 5枚 |
| 10歳以上 | 6枚 |
7. 用法及び用量に関連する注意
<効能共通>
7.1 本剤除去後直ちに処置等を行うこと。
<伝染性軟属腫摘除時の疼痛緩和>
7.2 本剤を患部に応じた適切な大きさに切って貼付すること。
<皮膚レーザー照射療法時の疼痛緩和>
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
低出生体重児、新生児及び乳児を対象とした臨床試験は実施していない。[7.3参照]
10. 相互作用
相互作用序文
本剤は、主として肝代謝酵素CYP1A2及びCYP3A4で代謝される。
薬物代謝酵素用語
CYP1A2
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| クラスIII抗不整脈剤 アミオダロン ニフェカラント等 | 心機能抑制作用が増強するおそれがあるので、心電図検査等によるモニタリングを行うこと。 | 作用が増強することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
不快感、口内異常感、喘鳴、眩暈、便意、耳鳴、発汗、全身潮紅、呼吸困難、血管浮腫(顔面浮腫、喉頭浮腫等)、血圧低下、顔面蒼白、脈拍の異常、意識障害等の異常が認められた場合には使用を中止し、適切な処置を行うこと。
なお、本剤除去後にも、同様の症状を起こすことがあるので、注意すること。
なお、本剤除去後にも、同様の症状を起こすことがあるので、注意すること。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発赤、そう痒 | 蕁麻疹 | 接触皮膚炎、刺激感、熱感 |
| 皮膚 | 色素沈着、適用部位疼痛、皮膚剥離注) |
13. 過量投与
局所麻酔剤の血中濃度の上昇に伴い、中毒が発現する。その症状は、主に中枢神経系及び心血管系の徴候、症状としてあらわれる。
13.1 徴候、症状
13.1.1 中枢神経系の症状
初期症状として不安、興奮、多弁、口周囲の知覚麻痺、舌のしびれ、ふらつき、聴覚過敏、耳鳴、視覚障害、振戦等があらわれる。症状が進行すると意識消失、全身痙攣があらわれ、これらの症状に伴い低酸素血症、高炭酸ガス血症が生じるおそれがある。より重篤な場合には呼吸停止を来すこともある。
13.1.2 心血管系の症状
血圧低下、徐脈、心筋収縮力低下、心拍出量低下、刺激伝導系の抑制、心室性頻脈及び心室細動等の心室性不整脈、循環虚脱、心停止等があらわれる。
13.2 処置
以下の治療を行うことが望ましい。
13.2.1 中枢神経系及び心血管系の症状が起きたら直ちに本剤を剥離する。
13.2.2 振戦や痙攣が著明であれば、ジアゼパム又は超短時間作用型バルビツール酸製剤(チオペンタールナトリウム等)を投与する。
14. 適用上の注意
14.1 薬剤使用時の注意
<効能共通>
14.1.1 湿疹又は発疹の部位に使用しないこと。
14.1.2 損傷皮膚及び粘膜に使用しないこと。
14.1.3 本剤を切って使用した場合、残薬は廃棄すること。
14.1.4 使用期限内であっても、開封後はなるべく速やかに使用すること。
<静脈留置針穿刺時の疼痛緩和>
14.1.5 本剤を皮膚からはがした後、穿刺部位を消毒すること。
15. その他の注意
15.1 臨床使用に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
健康成人男子6例の上肢内側に本剤2枚(リドカインとして36mg)を単回貼付(4時間)注)したときの薬物動態パラメータは次のとおりであった。また、貼付開始24時間後の血清中リドカイン濃度は定量限界(2ng/mL)未満であった1)。
| Cmax(ng/mL) | Tmax(hr) | AUC0-28(ng・hr/mL) | T1/2(hr) |
| 13.2±14.0 | 6.0 | 90.5±53.8 | 1.65 |
16.1.2 伝染性軟属腫患者
6〜8歳の小児伝染性軟属腫患者18例の体幹又は四肢に、本剤2枚(リドカインとして36mg)を非分割群12例又は分割群(1枚につき8分割)6例に単回貼付(2時間)注)したときの血清中リドカイン濃度を測定した。各時点における血清中リドカイン濃度は次のとおりであった。なお、被験者毎の測定ポイントは2点であった2)。
| 非分割群 | 分割群 | |||||
| 貼付後時間 | 例数 | 平均±標準偏差 | 最小値−最大値 (中央値) | 例数 | 平均±標準偏差 | 最小値−最大値 (中央値) |
| 1時間 | 6 | 1.86±3.62 | 0.000-9.182 (0.3580) | − | − | − |
| 2時間 (除去直後) | 12 | 30.15±56.74 | 0.000-195.7 (5.075) | 6 | 12.52±7.99 | 0.9547-23.37 (13.00) |
| 4時間 (除去後2時間) | 6 | 13.85±9.73 | 1.457-27.31 (12.98) | 6 | 10.62±4.87 | 3.627-17.97 (11.33) |
16.1.3 皮膚レーザー照射療法患者
成人の太田母斑、扁平母斑患者12例の顔面母斑患部に、本剤1枚(リドカインとして18mg)又は3枚(リドカインとして54mg)を2時間貼付注)したときの薬物動態パラメータ及び血清中リドカイン濃度推移は次のとおりであった3)。
| 投与群 | 例数 | Cmax(ng/mL) | Tmax(hr) | AUC0-24(ng・hr/mL) | T1/2(hr) |
| 1枚貼付群 | 6 | 25.2±22.5 | 2.2±0.4 | 112.7±86.4 | 3.7±0.9 |
| 3枚貼付群 | 6 | 92.4±68.8 | 2.2±0.4 | 395.9±259.0 | 3.7±1.0 |
図 血清中リドカイン濃度の経時的推移
16.5 排泄
健康成人男子6例に、本剤2枚(リドカインとして36mg)を単回貼付(4時間)注)したときの除去後24時間(貼付開始後28時間)までのリドカイン未変化体の累積尿中排泄率は、貼付量の0.04%であった1)。
注)本剤の承認用法・用量と異なる。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<静脈留置針穿刺時の疼痛緩和>
17.1.1 国内臨床試験
<伝染性軟属腫摘除時の疼痛緩和>
17.1.2 国内第III相試験
国内8施設で実施された小児(4〜11歳)を対象としたプラセボ対照二重盲検比較試験8)における、本剤貼付部位の疼痛緩和効果の有効率注1)は83.6%(51/61例)であった。副作用は総症例61例中、2例(3.3%)に認められ、その内訳は適用部位皮膚炎1件(1.6%)、適用部位そう痒感1件(1.6%)であった。
注1)優劣比較判定が評価された例数において疼痛緩和効果が認められた例数の割合
<皮膚レーザー照射療法時の疼痛緩和>
17.1.3 国内第III相比較試験
太田母斑、扁平母斑、異所性蒙古斑、外傷性色素沈着症に対する皮膚レーザー照射療法を受ける患者を対象に、国内15施設で実施されたプラセボ対照二重盲検比較試験4)における、本剤貼付部位のVAS変化率注2)はプラセボに比較して有意に優った。副作用は総症例58例中、4例(6.9%)に認められ、その内訳は適用部位紅斑3件(5.2%)、蕁麻疹1件(1.7%)であった。
なお、本剤の最大使用枚数は、6枚であった。[15.1.2参照]
なお、本剤の最大使用枚数は、6枚であった。[15.1.2参照]
| 例数 | VAS変化率(%) | |
| ペンレステープ18mg | 58 | −26.71±41.69 |
| プラセボ | 30 | −6.74±35.08 |
注2)
VAS(Visual Analogue Scale):100mmのスケールを用い痛みを評価する視覚アナログスケール。数値が大きい方が痛みは強い。
VAS変化率:−(非貼付部位のVAS値−貼付部位のVAS値)/非貼付部位のVAS値×100
17.1.4 国内第III相一般臨床試験
18. 薬効薬理
18.1 作用機序
リドカインは、神経膜のナトリウムチャネルをブロックし、神経における活動電位の伝導を可逆的に抑制し、知覚神経及び運動神経を遮断する。
18.2 局所麻酔作用
本剤は、基剤と比較して、モルモットによる背部皮膚ピンプリック法で局所麻酔作用が認められている9)。
19. 有効成分に関する理化学的知見
19.1. リドカイン
22. 包装
50枚[1枚(袋)×50]、200枚[1枚(袋)×200]
23. 主要文献
- 横田秀雄ら, 基礎と臨床, 26 (12), 4711-4722, (1992)
- 川島 眞ら, 臨床医薬, 28 (6), 481-487, (2012)
- 藤村昭夫ら, 臨床医薬, 29 (6), 561-569, (2013)
- 渡辺晋一ら, 臨床医薬, 29 (6), 571-584, (2013)
- 渡辺晋一ら, 臨床医薬, 29 (6), 585-597, (2013)
- 社内資料:静脈留置針穿刺時の疼痛緩和に関する臨床成績集計
- 社内資料:静脈留置針穿刺時の疼痛緩和に関する副作用集計
- 川島 眞ら, 臨床医薬, 28 (6), 489-504, (2012)
- 社内資料:リドカインテープ剤の薬効
24. 文献請求先及び問い合わせ先
文献請求先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
製品情報問い合わせ先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
26. 製造販売業者等
26.1 製造販売
日東電工株式会社
東京都港区港南1-2-70
26.2 販売
マルホ株式会社
大阪市北区中津1-5-22