医薬品情報
| 総称名 | ディフェリン |
|---|---|
| 一般名 | アダパレン |
| 欧文一般名 | Adapalene |
| 製剤名 | アダパレン ゲル |
| 薬効分類名 | 尋常性ざ瘡治療剤 |
| 薬効分類番号 | 2699 |
| ATCコード | D10AD03 |
| KEGG DRUG |
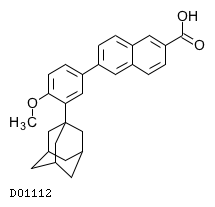
D01112
アダパレン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ディフェリンゲル0.1% | Differin Gel | マルホ | 2699711Q1027 | 50.1円/g | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤は顔面の尋常性ざ瘡にのみ使用すること。
5.2 顔面以外の部位(胸部、背部等)における有効性・安全性は確立していない。
5.3 結節及び嚢腫には、他の適切な処置を行うこと。
6. 用法及び用量
1日1回、洗顔後、患部に適量を塗布する。
7. 用法及び用量に関連する注意
7.1 就寝前に使用すること。
7.2 治療開始3ヵ月以内に症状の改善が認められない場合には使用を中止すること。
8. 重要な基本的注意
8.1 過敏症や重度皮膚刺激感が認められた場合は、本剤の使用を中止すること。
8.2 本剤の使用中に皮膚乾燥、皮膚不快感、皮膚剥脱、紅斑、そう痒症があらわれることがある。これらは治療開始2週間以内に発生することが多く、通常は軽度で一過性のものであることについて患者に説明すること。なお、本剤の継続使用中に消失又は軽減が認められない場合は、必要に応じて休薬等の適切な処置を行うこと。
8.3 症状改善により本剤塗布の必要がなくなった場合は、塗布を中止し、漫然と長期にわたって使用しないこと。
8.4 日光又は日焼けランプ等による過度の紫外線曝露を避けること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には使用しないこと。妊娠した場合、あるいは妊娠が予想される場合には医師に知らせるよう指導すること。動物実験において、経皮投与(ラット、ウサギ)で奇形の発生は認められていないが、過剰肋骨の発生頻度増加が報告されている。経口投与(ラット、ウサギ)で催奇形作用が報告されている。[2.2参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。皮膚外用時のヒト母乳中への移行は不明である。動物実験において、経口又は静脈内投与(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
12歳未満の小児等を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 皮膚及び皮下組織 | 皮膚乾燥(56.1%)、皮膚不快感(47.6%)、皮膚剥脱(33.5%)、紅斑(21.9%)、そう痒症(13.2%) | 湿疹、ざ瘡、接触皮膚炎、皮膚刺激、皮脂欠乏症、眼瞼炎、水疱、皮膚炎、皮脂欠乏性湿疹、皮膚疼痛、発疹、そう痒性皮疹、脂漏性皮膚炎、皮膚浮腫、顔面腫脹、蕁麻疹、乾皮症 | 顔面浮腫、皮膚灼熱感、丘疹、皮膚の炎症、紅斑性皮疹、皮膚反応、アレルギー性皮膚炎、アレルギー性接触皮膚炎、眼瞼刺激、眼瞼紅斑、眼瞼そう痒症、眼瞼腫脹 |
| 感染症及び寄生虫症 | 単純ヘルペス | ||
| 肝臓 | 血中ビリルビン増加、AST増加、ALT増加、γ-GTP増加 | ||
| その他 | 血中コレステロール増加 |
14. 適用上の注意
14.1 薬剤使用時の注意
14.1.1 他の刺激性のある外用剤と併用する場合は、皮膚刺激感が増すおそれがあるため注意すること。
14.1.2 外用としてのみ使用すること。
14.1.3 切り傷、すり傷、湿疹のある皮膚への塗布は避けること。
14.1.4 眼、口唇、鼻翼及び粘膜を避けながら、患部に塗布すること。眼の周囲に使用する場合には眼に入らないように注意すること。万一、眼に入った場合は直ちに水で洗い流すこと。
16. 薬物動態
16.1 血中濃度
16.1.1 国内臨床試験(単回閉鎖貼布:健康成人15例1)、5日間連続顔面塗布:健康成人6例2)、12週間連続顔面塗布:尋常性ざ瘡患者30例3))において、アダパレンの血漿中への移行は認められなかった(検出限界:0.15ng/mL)。
16.1.2 海外臨床試験においては、ざ瘡患者32例に本剤を1日1回、12週間ざ瘡患部(顔面、胸部、背部)に塗布したとき、血漿中に微量(<0.25ng/mL)のアダパレンが検出された4)(外国人データ)。
16.2 吸収
16.3 分布
16.4 代謝
アダパレンは、ラットの皮膚では代謝されなかった8)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相臨床試験
尋常性ざ瘡患者を対象に1日1回就寝前に患部を洗浄後顔面全体に12週間塗布した基剤対照評価者盲検比較試験(本剤群:100例、基剤群:100例)において、総皮疹数の減少率(中央値)は、基剤群(36.9%)に比較して本剤群(63.2%)で有意に優れていた(p<0.0001)14)。
副作用発現頻度は本剤群で56.0%(56/100例)であった。副作用は皮膚乾燥37.0%(37/100例)、皮膚剥脱18.0%(18/100例)、皮膚不快感16.0%(16/100例)、紅斑8.0%(8/100例)、そう痒症5.0%(5/100例)、皮膚刺激4.0%(4/100例)であった15)。
17.1.2 国内第III相臨床試験
尋常性ざ瘡患者444例を対象に本剤を1日1回就寝前洗顔後に適量を顔面全体に最長12ヵ月間塗布した長期安全性試験16)において、皮疹数(総皮疹、非炎症性皮疹及び炎症性皮疹)の減少率(中央値)は、それぞれ77.8%、83.3%及び73.3%であった。
副作用発現頻度は84.0%(373/444例)であった。主な副作用は皮膚乾燥60.4%(268/444例)、皮膚不快感54.7%(243/444例)であった。
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. アダパレン
20. 取扱い上の注意
凍結をさせないこと。
22. 包装
チューブ
15g×10
23. 主要文献
- 社内資料:単回貼布及び光貼布試験(2008年7月16日承認、CTD2.7.6.1)
- 社内資料:薬物動態及び皮膚安全性試験(2008年7月16日承認、CTD2.7.6.3)
- 川島眞ら, 皮膚の科学, 6, 494-503, (2007) »DOI
- 社内資料:トレチノインゲル比較試験(海外)(2008年7月16日承認、CTD2.7.6.12)
- 社内資料:ラット単回塗布による吸収(2008年7月16日承認、CTD2.6.4.3.2.2.1)
- 社内資料:イヌ単回塗布による吸収及び排泄(2008年7月16日承認、CTD2.6.4.3.2.4.1)
- 社内資料:ラット反復塗布による血漿中濃度(2008年7月16日承認、CTD2.6.4.3.2.2.2)
- 社内資料:ラット皮膚への分布及び代謝(2008年7月16日承認、CTD2.6.4.4.1、2.6.4.5.1.2)
- 社内資料:ラット単回及び反復塗布による組織分布(2008年7月16日承認、CTD2.6.4.4.2.1.1)
- 社内資料:マウス単回塗布による排泄(2008年7月16日承認、CTD2.6.4.6.1.1.1)
- 社内資料:ラット単回塗布による排泄(2008年7月16日承認、CTD2.6.4.6.1.2.1)
- 社内資料:ウサギ反復塗布による排泄(2008年7月16日承認、CTD2.6.4.6.1.3.1)
- 社内資料:ラット腸肝循環(2008年7月16日承認、CTD2.6.4.6.1.2.4)
- Kawashima M.,et al., J.Dermatol.Sci., 49, 241-248, (2008) »PubMed
- 社内資料:国内第III相臨床試験(2008年7月16日承認、CTD2.7.6.5)
- 社内資料:国内第III相臨床試験(長期投与試験)(2008年7月16日承認、CTD2.7.6.6)
- 社内資料:細胞核内レチノイン酸受容体結合(2008年7月16日承認、CTD2.6.2.2.1.1)
- 社内資料:RARサブタイプ別遺伝子転写促進化活性(2008年7月16日承認、CTD2.6.2.2.1.2)
- 社内資料:表皮トランスグルタミナーゼ発現(2008年7月16日承認、CTD2.6.2.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
製品情報問い合わせ先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
26. 製造販売業者等
26.1 製造販売(輸入)
マルホ株式会社
大阪市北区中津1-5-22
26.2 提携
GALDERMA