医薬品情報
| 総称名 | メノエイド |
|---|---|
| 一般名 | エストラジオール 酢酸ノルエチステロン |
| 欧文一般名 | Estradiol Norethisterone Acetate |
| 製剤名 | エストラジオール・酢酸ノルエチステロン経皮吸収型製剤 |
| 薬効分類名 | 経皮吸収型 卵胞・黄体ホルモン製剤 |
| 薬効分類番号 | 2482 |
| ATCコード | G03FA01 G03FB05 |
| KEGG DRUG |
D09188
エストラジオール・ノルエチステロン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メノエイドコンビパッチ | MENOAIDCOMBI Patches | 久光製薬 | 2482800S1026 | 226.1円/枚 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 エストロゲン依存性悪性腫瘍(例えば、乳癌、子宮内膜癌)及びその疑いのある患者[腫瘍の悪化あるいは顕性化を促すことがある。][8.2参照]
2.2 未治療の子宮内膜増殖症のある患者[子宮内膜増殖症は細胞異型を伴う場合がある。][8.2参照]
2.3 乳癌の既往歴のある患者[乳癌が再発することがある。][8.2参照]
2.4 血栓性静脈炎や肺塞栓症のある患者又はその既往歴のある患者[エストロゲンは凝固因子を増加させ、血栓形成傾向を促進するとの報告がある。][11.1.2参照]
2.6 本剤の成分に対し過敏症の既往歴のある患者
2.8 重篤な肝障害のある患者[9.3.1参照]
2.9 診断の確定していない異常性器出血のある患者[出血が子宮内膜癌による場合は、癌の悪化あるいは顕性化を促すことがある。][8.2参照]
2.10 ポルフィリン症の患者[症状が増悪することがある。]
4. 効能または効果
更年期障害及び卵巣欠落症状に伴う血管運動神経系症状(Hot flush及び発汗)
5. 効能または効果に関連する注意
本剤は、子宮のない患者には使用しないこと。
6. 用法及び用量
通常、成人に対し、メノエイドコンビパッチ1枚を3〜4日ごとに1回(週2回)下腹部に貼付する。
8. 重要な基本的注意
8.1 外国において、卵胞ホルモン剤と黄体ホルモン剤を長期併用した女性では、乳癌になる危険性が対照群の女性と比較して高くなり、その危険性は併用期間が長期になるに従って高くなるとの報告があるので、本剤の使用にあたっては、患者に対し本剤のリスクとベネフィットについて十分な説明を行うとともに必要最小限の使用にとどめ、漫然と長期使用を行わないこと。[15.1.2参照]
8.2 使用前に病歴、家族素因等の問診、乳房検診並びに婦人科検診(子宮を有する患者においては子宮内膜細胞診及び超音波検査による子宮内膜厚の測定を含む)を行い、使用開始後は定期的に乳房検診並びに婦人科検診を行うこと。[2.1-2.3、2.9、9.1.1-9.1.3参照]
8.3 本剤を使用しても効果が認められない場合には、本剤の使用を中止するなど適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 子宮筋腫を有する患者
子宮筋腫の発育を促進するおそれがある。[8.2参照]
9.1.2 子宮内膜症のある患者
症状が増悪するおそれがある。[8.2参照]
9.1.3 乳癌家族素因が強い患者、乳房結節のある患者、乳腺症の患者又は乳房レントゲン像に異常がみられた患者
症状が増悪するおそれがある。[8.2参照]
9.1.4 高血圧、心疾患のある患者又はその既往歴のある患者
体液貯留をきたし、これらの疾患を悪化させるおそれがある。
9.1.5 糖尿病の患者
十分管理を行いながら使用すること。耐糖能を低下させるおそれがある。
9.1.6 片頭痛、てんかんのある患者
症状が増悪するおそれがある。
9.1.7 術前又は長期臥床状態の患者
血液凝固能が亢進され、心血管系の副作用の危険性が高くなることがある。[11.1.2参照]
9.1.8 全身性エリテマトーデスの患者
症状が増悪するおそれがある。
9.2 腎機能障害患者
9.2.1 腎疾患のある患者又はその既往歴のある患者
体液貯留をきたし、疾患を悪化させるおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
使用しないこと。代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。[2.8参照]
9.3.2 肝障害のある患者(重篤な肝障害のある患者を除く)
症状が増悪するおそれがある。
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には使用しないこと。卵胞ホルモン剤であるジエチルスチルベストロールを妊娠動物(マウス)あるいは妊婦に投与したとき、出生児に生殖器系臓器の異常が報告されている。エストラジオールのヒトにおける催奇形性の報告はないが、妊娠動物(ラット)への投与によって児の生殖器系臓器に異常が起こることが報告されている。ヒトにおいて、妊娠中の女性ホルモン剤(経口避妊薬等)投与によって児の先天性異常(先天性心臓奇形及び四肢欠損症)のリスク増加の報告がある。黄体ホルモン剤を妊娠初期・中期に投与した場合、女子胎児の外性器の男性化又は男子胎児の女性化が起こることがある。黄体ホルモン剤の使用と先天異常児出産との因果関係はいまだ確立されたものではないが、心臓・四肢等の先天異常児を出産した母親では、対照群に比して妊娠初期に黄体又は黄体・卵胞ホルモン剤を使用していた率に有意差があるとする疫学調査の結果が報告されている。[2.7参照]
9.6 授乳婦
使用しないこと。乳汁中に移行する可能性がある。[2.7参照]
9.8 高齢者
患者の状態を観察しながら慎重に使用すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 抗てんかん剤 フェノバルビタール フェニトイン カルバマゼピン メプロバメート フェニルブタゾン リファンピシン HIV逆転写酵素阻害剤 ネビラピン エファビレンツ プロテアーゼ阻害剤 リトナビル ネルフィナビル セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品 | 本剤の代謝が促進されることによって効果が減弱する可能性がある。 | これらの薬剤が肝薬物代謝酵素チトクロームP-450を誘導することによって、本剤の代謝を促進する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
呼吸困難、血圧低下等の異常が認められた場合には使用を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 0.1〜1%未満 | |
| 皮膚(貼付部位) | そう痒(20.8%)、発赤、皮膚炎 | 紅斑 | 色素沈着、水疱、発疹 |
| 生殖器 | 帯下 | 不正出血、腟炎、子宮頸部ポリープ、外陰部そう痒感 | 子宮平滑筋腫 |
| 乳房 | 乳房緊満感、乳房痛 | 乳頭痛 | 乳腺症、乳房腫瘤 |
| 精神神経系 | 頭痛・片頭痛、めまい | 眠気、しびれ | |
| 循環器 | 動悸 | 血圧上昇 | |
| 消化器 | 腹部膨満感、悪心、腹部不快感、腹痛 | 便秘、下痢、胃痛 | |
| 電解質 | 浮腫 | ||
| 過敏症 | 発疹 | 全身のそう痒、蕁麻疹 | |
| 血液 | 貧血(赤血球、ヘモグロビン、ヘマトクリット減少) | 白血球減少 | |
| 肝臓 | 肝機能障害(AST、ALT、ALP上昇等) | ||
| その他 | 下腹部痛 | 腰痛、倦怠感 | 耳鳴、体重増加、背部痛、関節痛、筋骨格硬直、下肢痛、フィブリノーゲン上昇、トリグリセリド上昇、総コレステロール上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 貼付部位
(1)衣服との摩擦ではがれるおそれがあるため、ベルトラインを避け下腹部の滑らかな部分に貼付すること。また、乳房には貼付しないこと。
(2)創傷面又は湿疹・皮膚炎等がみられる部位は避けて貼付すること。
(3)皮膚刺激を避けるため、毎回、貼付部位を変えることが望ましい。[14.1.2(3)参照]
14.1.2 貼付時
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 ホルモン補充療法(HRT)と子宮内膜癌の危険性
卵胞ホルモン剤を長期間(約1年以上)使用した閉経期以降の女性では、子宮内膜癌になる危険性が対照群の女性と比較して高く、この危険性は、使用期間に相関して上昇し(1〜5年間で2.8倍、10年以上で9.5倍)、黄体ホルモン剤の併用により抑えられる(対照群の女性と比較して0.8倍)との疫学調査の結果が報告されている4)。
15.1.2 HRTと乳癌の危険性
HRTと乳癌発生との因果関係については明らかではないが、次のような報告がある。
(1)米国における閉経後女性を対象とした無作為化臨床試験〔Women's Health Initiative(WHI)試験〕の結果、結合型エストロゲン・黄体ホルモン配合剤投与群では、乳癌になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.24)との報告がある5)。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、乳癌になる危険性がプラセボ投与群と比較して有意差はない(ハザード比:0.80)との報告がある6)7)。[8.1参照]
(2)英国における疫学調査〔Million Women Study(MWS)〕の結果、卵胞ホルモン剤と黄体ホルモン剤を併用している女性では、乳癌になる危険性が対照群と比較して有意に高くなり(2.00倍)、この危険性は、併用期間が長期になるに従って高くなる(1年未満:1.45倍、1〜4年:1.74倍、5〜9年:2.17倍、10年以上:2.31倍)との報告がある8)。[8.1参照]
(3)閉経後女性を対象とした大規模な疫学調査のメタアナリシスの結果、閉経期ホルモン補充療法(MHT)として卵胞ホルモン剤を単独投与又は卵胞ホルモン剤と黄体ホルモン剤を併用した女性は、乳癌になる危険性がMHTの期間とともに高くなり(調整リスク比[95%信頼区間]は1〜4年間の卵胞ホルモン剤と黄体ホルモン剤併用:1.60[1.52-1.69]、卵胞ホルモン剤単独:1.17[1.10-1.26]、5〜14年間の卵胞ホルモン剤と黄体ホルモン剤併用:2.08[2.02-2.15]、卵胞ホルモン剤単独:1.33[1.28-1.37])、MHT非使用者に対する調整リスク比はMHT過去使用者よりMHT現使用者の方が高かった。また、MHT過去使用者において、投与中止後も過去の投与期間に依存して乳癌になる危険性が10年以上持続する場合があるとの報告がある9)。[8.1参照]
15.1.3 HRTと冠動脈性心疾患の危険性
15.1.4 HRTと脳卒中の危険性
15.1.5 HRTと認知症の危険性
15.1.6 HRTと卵巣癌の危険性
(2)米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、卵巣癌になる危険性がプラセボ投与群と比較して有意ではないが、高い傾向がみられた(ハザード比:1.58)との報告がある18)。
15.1.7 HRTと胆嚢疾患の危険性
15.1.8 黄体・卵胞ホルモン配合剤の長期服用により肝腫瘍が発生したとの報告がある。また、腫瘍の破裂により腹腔内出血を起こす可能性がある。
15.2 非臨床試験に基づく情報
実験動物にエストロゲンを皮下投与(埋め込み投与を含む)したとき、マウスにおけるリンパ系腫瘍、ラットの下垂体腺腫及びハムスターにおいては腎腫瘍の発生が報告されている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
閉経後又は両側卵巣摘出後の健康成人女性8名に単回投与(96時間貼付)した際の血清中エストラジオール(E2)濃度は、貼付後4〜8時間には上昇し、貼付後23.5時間でCmaxに到達し、貼付後96時間(貼付終了時)までほぼ一定に維持された。除剤後24時間までに速やかに減少し、貼付前値に戻った20)。
血清中ノルエチステロン(NET)濃度は貼付後4〜8時間には上昇し、貼付後58.5時間でCmaxに到達し、貼付後96時間までほぼ一定濃度が維持され、除剤後、徐々に減少した20)。
血清中ノルエチステロン(NET)濃度は貼付後4〜8時間には上昇し、貼付後58.5時間でCmaxに到達し、貼付後96時間までほぼ一定濃度が維持され、除剤後、徐々に減少した20)。
| エストラジオール | ノルエチステロン | |
| Cmax(pg/mL) | 77.5±21.2 | 651.5±254.0 |
| AUC0-132hr(pg・hr/mL) | 4973.8±1970.6 | 52265±23133 |
| Tmax(hr) | 23.5±11.8 | 58.5±26.8 |
16.1.2 反復投与
<閉経後又は両側卵巣摘出後の健康成人女性>
12名に反復投与(14日間貼付)した際の血清中E2濃度は、1回目貼付後4〜8時間で速やかに上昇し、貼付後22.7時間でCmaxに到達した。1回目貼付後24時間以降は最終除剤時まで168時間後を除き、すべての測定時点で貼付直前よりも有意な上昇を示した。なお、最終除剤後24時間までに速やかに低下した21)。
血清中NET濃度は1回目貼付後4時間までに速やかに上昇し、貼付後35.0時間でCmaxに到達した。1回目貼付後48時間以降はすべての測定時点で貼付直前よりも有意な上昇を示し、除剤後の血清中濃度は徐々に低下した21)。
血清中NET濃度は1回目貼付後4時間までに速やかに上昇し、貼付後35.0時間でCmaxに到達した。1回目貼付後48時間以降はすべての測定時点で貼付直前よりも有意な上昇を示し、除剤後の血清中濃度は徐々に低下した21)。
| エストラジオール | ノルエチステロン | ||
| 1回目 | Cmax(pg/mL) | 127.2±133.5 | 805.7±760.7 |
| AUC0-72hr(pg・hr/mL) | 4925.5±3637.5 | 44846.5±44680.6 | |
| Tmax(hr) | 22.7±14.1 | 35.0±17.3 | |
| 4回目 | Cmax(pg/mL) | 94.0±86.1 | 773.1±575.2 |
| AUC240-336hr(pg・hr/mL) | 4547.3±5432.6 | 57424.0±42392.6 | |
| Tmax(hr) | 254.3±6.0 | 276.0±18.4 | |
<更年期障害又は卵巣欠落症状を有する患者>
国内第II相臨床試験(二重盲検比較試験)において、本剤を3〜4日ごとに下腹部に貼付(16週間)した場合、平均血清中E2濃度は、投与前11.55pg/mL、投与8週後71.73pg/mL、投与16週後(又は中止時)41.91pg/mLであった。また、平均血清中NET濃度は、投与8週後463.49pg/mL、投与16週後(又は中止時)400.15pg/mLであった22)。
16.3 分布
16.3.1 組織移行
(1)エストラジオール
卵巣摘出ラットに[14C]E2+酢酸ノルエチステロン(NETA)を単回皮下投与した結果、放射能濃度は、肝臓、小腸、大腸、膵臓、副腎、子宮等で高くなった。投与後96時間では肝臓以外の組織は検出限界未満となった23)(in vivo)。
(2)酢酸ノルエチステロン
卵巣摘出ラットにE2+[14C]NETAを単回皮下投与した結果、放射能濃度は、肝臓、小腸、大腸、副腎、腎臓、白色脂肪等で高くなった。投与後96時間では腎臓及び肝臓以外の組織は検出限界未満となった23)(in vivo)。
16.3.2 蛋白結合率
16.4 代謝
16.4.1 エストラジオール
主に肝臓で17β-hydroxysteroid dehydrogenaseによりエストロン(E1)へ可逆的に変換され、その後E1は16α-ヒドロキシE1を経由し、エストリオール(E3)からE3-16-グルクロン酸抱合体(E3-16-G)となる経路[一部はE3-3-硫酸-16-グルクロン酸抱合体(E3-3-S-16-G)に代謝される]と、2-ヒドロキシE1を介して2-メトキシE1に至る経路及びE1からE1-3-硫酸抱合体(E1-3-S)に至る3経路に主として分かれる。E1への変換を受けなかったE2は腎臓においてE2-17グルクロン酸抱合体(E2-17-G)へと代謝され、一部は尿中へ排泄され、残りは再び血中に戻り、肝臓においてE2-3-硫酸-17グルクロン酸抱合体(E2-3-S-17-G)へ代謝される。E3-3-S-16-G及びE2-3-S-17-Gは胆汁中へ排泄された後、腸管で加水分解、再抱合を受けE1-3-GあるいはE2-3-Gとなり一部は腸肝循環を受けると考えられている24)。
16.4.2 酢酸ノルエチステロン
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相臨床試験
更年期障害又は卵巣欠落症状を有する患者を対象に、国内で実施した第II相臨床試験(プラセボ対照二重盲検比較試験)において、投与16週後(又は中止時)の血管運動神経系症状(Hot flush及び発汗)は、プラセボに比較して有意に改善した。副作用発現頻度は、全身症状が35.7%(30/84例)、投与部位症状が33.3%(28/84例)であった。主な副作用は、適用部位そう痒感23.8%(20/84例)、適用部位紅斑14.3%(12/84例)、下腹部痛8.3%(7/84例)、乳房圧痛7.1%(6/84例)であった22)。
17.1.2 国内第III相臨床試験
更年期障害又は卵巣欠落症状を有する患者を対象に、国内で実施した第III相臨床試験(実薬対照非盲検比較試験)において、投与52週後(又は中止時)の血管運動神経系症状(Hot flush及び発汗)に対し有効性が認められた28)。
| 試験(投与期間) | 投与群 | Hot flushの1日平均回数 | |||
| 例数 | 投与前 | 例数 | 投与後 | ||
| 第II相臨床試験(16週間) | 本剤 | 54 | 3.94±2.75 | 54 | 0.50±1.14 |
| プラセボ | 58 | 4.23±3.37 | 57 | 1.54±2.13 | |
| 第III相臨床試験(52週間) | 本剤 | 344 | 2.93±2.62 | 342 | 0.26±0.70 |
| 試験(投与期間) | 投与群 | Hot flushの程度の改善率※ | 発汗の程度の改善率※ |
| 第II相臨床試験(16週間) | 本剤 | 85.2% (46例/54例) | 81.4% (35例/43例) |
| プラセボ | 52.6% (30例/57例) | 57.7% (30例/52例) | |
| 第III相臨床試験(52週間) | 本剤 | 81.3% (278例/342例) | 76.1% (248例/326例) |
国内で実施した第III相臨床試験(実薬対照非盲検比較試験)において、投与期間(52週間)中の子宮内膜厚の推移は下表のとおりであり、このうち子宮内膜組織診の評価対象331例において、子宮内膜増殖症が発現した症例はみられなかった28)。
| 試験(投与期間) | 投与前 | 投与後 | ||
| 例数 | 内膜厚(mm) | 例数 | 内膜厚(mm) | |
| 第III相臨床試験(52週間) | 364 | 2.53±1.25 | 363 | 3.04±1.54 |
副作用発現頻度は、全身症状が45.1%(164/364例)、投与部位症状が25.5%(93/364例)であった。主な副作用は、適用部位そう痒感17.3%(63/364例)、下腹部痛12.4%(45/364例)、乳房圧痛10.2%(37/364例)、適用部位紅斑9.3%(34/364例)であった28)。
18. 薬効薬理
18.1 作用機序
卵巣機能の急激な低下に伴うエストロゲンの欠乏により、Hot flush、発汗等の血管運動神経系症状が引き起こされる。エストロゲンの補充によりこれらの症状は軽減するが、エストロゲンの子宮内膜に対する増殖刺激を抑制するために、黄体ホルモン剤の併用投与が行われている。
本剤は、エストラジオールと黄体ホルモンである酢酸ノルエチステロンを経皮的に直接全身循環へ供給し、エストラジオール及びノルエチステロンの血中濃度を持続的に維持させることによって、Hot flushや発汗の症状を軽減させるとともに、エストロゲンによる子宮内膜の増殖性変化を抑制させる。
本剤は、エストラジオールと黄体ホルモンである酢酸ノルエチステロンを経皮的に直接全身循環へ供給し、エストラジオール及びノルエチステロンの血中濃度を持続的に維持させることによって、Hot flushや発汗の症状を軽減させるとともに、エストロゲンによる子宮内膜の増殖性変化を抑制させる。
18.2 子宮内膜に対する作用
卵巣摘出サルにエストラジオール50μg/日相当を4週間経皮投与すると、子宮内膜は卵胞期(増殖期)に類似した組織像に変化したが、エストラジオール50μg/日相当及び酢酸ノルエチステロン140μg/日相当を4週間経皮あるいは皮下投与すると、子宮内膜は黄体ホルモン作用に基づく黄体期又は妊娠期に類似した組織像に変化した29)。
19. 有効成分に関する理化学的知見
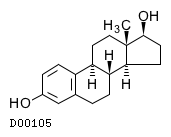
19.1. エストラジオール
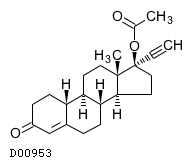
19.2. 酢酸ノルエチステロン
22. 包装
24枚[1枚/1袋×24袋]
48枚[1枚/1袋×48袋]
96枚[1枚/1袋×96袋]
23. 主要文献
- 安田佳子 ほか, 医学のあゆみ, 98 (8), 537-8, (1976)
- 安田佳子 ほか, 医学のあゆみ, 99 (8), 611-2, (1976)
- 守隆夫, 医学のあゆみ, 95 (11), 599-602, (1975)
- Grady D,et al., Obstet Gynecol, 85 (2), 304-13, (1995) »PubMed
- Chlebowski RT,et al., JAMA, 289 (24), 3243-53, (2003) »PubMed
- Anderson GL,et al., JAMA, 291 (14), 1701-12, (2004) »PubMed
- Stefanick ML,et al., JAMA, 295 (14), 1647-57, (2006) »PubMed
- Beral V,et al., Lancet, 362, 419-27, (2003) »PubMed
- Collaborative Group on Hormonal Factors in Breast Cancer, Lancet, 394, 1159-68, (2019)
- Manson JE,et al., N Engl J Med, 349 (6), 523-34, (2003) »PubMed
- Wassertheil-Smoller S,et al., JAMA, 289 (20), 2673-84, (2003) »PubMed
- Hendrix SL,et al., Circulation, 113 (20), 2425-34, (2006) »PubMed
- Shumaker SA,et al., JAMA, 289 (20), 2651-62, (2003) »PubMed
- Shumaker SA,et al., JAMA, 291 (24), 2947-58, (2004) »PubMed
- Rodriguez C,et al., JAMA, 285 (11), 1460-5, (2001) »PubMed
- Lacey JV Jr,et al., JAMA, 288 (3), 334-41, (2002) »PubMed
- Beral V,et al., Lancet, 369 (9574), 1703-10, (2007) »PubMed
- Anderson GL,et al., JAMA, 290 (13), 1739-48, (2003) »PubMed
- Cirillo DJ,et al., JAMA, 293 (3), 330-9, (2005) »PubMed
- 久光製薬社内資料.第I相臨床試験(単回投与試験)(2008年10月16日承認、CTD2.7.2.2)
- 久光製薬社内資料.第I相臨床試験(反復投与試験)(2008年10月16日承認、CTD2.7.2.2)
- 久光製薬社内資料.第II相臨床試験(プラセボ対照二重盲検比較試験)(2008年10月16日承認、CTD2.7.2.1、2.7.4.2)
- 久光製薬社内資料.薬物動態試験(血漿蛋白結合率、組織への移行性、排泄試験)(2008年10月16日承認、CTD2.6.4.4、2.6.4.6、2.7.2.2)
- 本庄英雄, 日本臨床, 37 (6), 1186-92, (1979) »PubMed
- Singh H,et al., Am J Obstet Gynecol, 135 (3), 409-14, (1979) »PubMed
- Stanczyk FZ,et al., Contraception, 42 (1), 67-96, (1990) »PubMed
- Braselton WE,et al., J Steroid Biochem, 8 (1), 9-18, (1977) »PubMed
- 真田光博 ほか, 日本更年期医学会雑誌, 16 (2), 220-31, (2008)
- 久光製薬社内資料.薬効薬理試験(子宮内膜に対する作用)(2008年10月16日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
久光製薬株式会社
お客様相談室 受付時間/9:00-17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
製品情報問い合わせ先
久光製薬株式会社
お客様相談室 受付時間/9:00-17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
26. 製造販売業者等
26.1 製造販売元
久光製薬株式会社
〒841-0017
鳥栖市田代大官町408番地