医薬品情報
| 総称名 | ウェールナラ |
|---|---|
| 一般名 | エストラジオール レボノルゲストレル |
| 欧文一般名 | Estradiol Levonorgestrel |
| 製剤名 | エストラジオール・レボノルゲストレル錠 |
| 薬効分類名 | 経口エストラジオール・プロゲスチン配合閉経後骨粗鬆症治療剤 |
| 薬効分類番号 | 2482 |
| ATCコード | G03FA11 G03FB09 |
| KEGG DRUG |
D09187
エストラジオール・レボノルゲストレル
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ウェールナラ配合錠 | Wellnara combination tablets | バイエル薬品 | 2482010F1026 | 96.4円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
本剤は、子宮のない患者には投与しないこと。
6. 用法及び用量
通常、成人に対し1日1錠を経口投与する。
7. 用法及び用量に関連する注意
7.1 本剤を投与する場合、投与後6ヵ月〜1年後に骨密度を測定し、効果が認められない場合には投与を中止し、他の療法を考慮すること。
7.2 他のホルモン補充療法から本剤に切り替える場合、周期的投与法では治療周期の最終日以降、また逐次的投与法では休薬の後、本剤の投与を開始すること。
8. 重要な基本的注意
8.1 外国において、卵胞ホルモン剤と黄体ホルモン剤を長期併用した女性では、乳癌になる危険性が対照群の女性と比較して高くなり、その危険性は併用期間が長期になるに従って高くなるとの報告があるので、本剤の使用にあたっては、患者に対し本剤のリスクとベネフィットについて十分な説明を行うとともに必要最小限の使用にとどめ、漫然と長期使用を行わないこと。[15.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 子宮内膜症のある患者
症状が増悪するおそれがある。[8.2参照]
9.1.2 子宮筋腫のある患者
子宮筋腫の発育を促進するおそれがある。[8.2参照]
9.1.3 高血圧、心疾患又はその既往歴のある患者
エストロゲンの過量投与では体液貯留を来し、疾患を悪化させるおそれがある。
9.1.4 片頭痛、てんかんのある患者
観察を十分に行うこと。症状を悪化させることがある。
9.1.5 糖尿病患者
十分管理を行いながら使用すること。耐糖能を低下させるおそれがある。
9.1.6 乳癌家族素因が強い患者、乳房結節のある患者、乳腺症の患者又は乳房レントゲン像に異常がみられた患者
症状を悪化させるおそれがある。[8.2参照]
9.1.7 術前又は長期臥床状態の患者
9.1.8 全身性エリテマトーデスの患者
症状を悪化させるおそれがある。
9.1.9 ポルフィリン症の患者
症状を悪化させるおそれがある。
9.1.10 重篤な高トリグリセリド血症の患者
急性膵炎を発症するおそれがある。
9.2 腎機能障害患者
9.2.1 腎疾患又はその既往歴のある患者
エストロゲンの過量投与では体液貯留を来し、疾患を悪化させるおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。[2.7参照]
9.3.2 肝障害のある患者(重篤な肝障害のある患者を除く)
肝障害を悪化させることがある。
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には投与しないこと。[2.10参照]
9.5.2 卵胞ホルモン剤を妊娠動物(マウス)に投与した場合、児の成長後腟上皮及び子宮内膜の癌性変化を示唆する結果が報告されている。また新生児(マウス)に投与した場合、児の成長後腟上皮の癌性変化を認めたとの報告がある。
9.6 授乳婦
授乳中の女性には投与しないこと。ヒトにおいて、母乳中への移行が報告されている。[2.6参照]
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。なお、臨床試験では75歳を超える高齢者は除外されている。
10. 相互作用
相互作用序文
本剤は主に薬物代謝酵素CYP3A4で代謝される。
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| マクロライド系抗生物質 エリスロマイシン等 イミダゾール系抗真菌剤 ケトコナゾール等 トリアゾール系抗真菌剤 イトラコナゾール等 | 本剤の血中濃度が増加し、作用が増強されるおそれがある。 | これらの薬剤等は薬物代謝酵素CYP3A4を阻害することにより、本剤の代謝を阻害すると考えられる。 |
| リファンピシン バルビツール酸系製剤 フェノバルビタール等 カルバマゼピン 非ヌクレオシド系逆転写酵素阻害剤 ネビラピン、エファビレンツ セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | 本剤の血中濃度が減少し、作用が減弱されるおそれがある。 | これらの薬剤等は薬物代謝酵素CYP3A4を誘導することにより、本剤の代謝を促進すると考えられる。 |
| HIVプロテアーゼ阻害剤 リトナビル等 | 本剤の血中濃度が変化するおそれがある。 | これらの薬剤等は薬物代謝酵素CYP3A4を阻害又は誘導する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 生殖器 | 性器分泌物、性器出血 | 外陰腟不快感、子宮頸管ポリープ、月経困難症(性器出血時の腹痛)、女性陰部そう痒症、腟真菌症 | ||
| 乳房 | 乳房不快感(23.6%)、乳房痛、乳頭痛 | 乳房のう胞、乳房障害(乳腺症) | ||
| 消化器 | 腹痛 | 腹部膨満、便秘、悪心、胃炎 | 下痢、腹部不快感 | |
| 精神神経系 | 頭痛、浮動性めまい | 感覚減退(四肢のしびれ感等)、不眠症 | ||
| 循環器 | 血圧上昇 | 動悸 | ||
| 電解質代謝 | 浮腫 | |||
| 内分泌・代謝系 | TSH増加 | 血中トリグリセリド増加 | ||
| 筋・骨格系 | 背部痛 | 筋骨格硬直(肩又は手のこわばり等) | ||
| 皮膚 | 湿疹 | |||
| その他 | 倦怠感 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 ホルモン補充療法(HRT)と子宮内膜癌の危険性
卵胞ホルモン剤を長期間(約1年以上)使用した閉経期以降の女性では、子宮内膜癌になる危険性が対照群の女性と比較して高く、この危険性は、使用期間に相関して上昇し(1〜5年間で2.8倍、10年以上で9.5倍)、黄体ホルモン剤の併用により抑えられる(対照群の女性と比較して0.8倍)との疫学調査の結果が報告されている1)。
15.1.2 HRTと乳癌の危険性
HRTと乳癌発生との因果関係については明らかではないが、次のような報告がある。
(1)米国における閉経後女性を対象とした無作為化臨床試験(Women's Health Initiative(WHI)試験)の結果、結合型エストロゲン・黄体ホルモン配合剤投与群では、乳癌になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.24)との報告がある2)。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、乳癌になる危険性がプラセボ投与群と比較して有意差はない(ハザード比:0.80)との報告がある3)4)。[8.1参照]
(2)英国における疫学調査(Million Women Study(MWS))の結果、卵胞ホルモン剤と黄体ホルモン剤を併用している女性では、乳癌になる危険性が対照群と比較して有意に高くなり(2.00倍)、この危険性は、併用期間が長期になるに従って高くなる(1年未満:1.45倍、1〜4年:1.74倍、5〜9年:2.17倍、10年以上:2.31倍)との報告がある5)。[8.1参照]
(3)閉経後女性を対象とした大規模な疫学調査のメタアナリシスの結果、閉経期ホルモン補充療法(MHT)として卵胞ホルモン剤を単独投与又は卵胞ホルモン剤と黄体ホルモン剤を併用した女性は、乳癌になる危険性がMHTの期間とともに高くなり(調整リスク比[95%信頼区間]は1〜4年間の卵胞ホルモン剤と黄体ホルモン剤併用:1.60[1.52-1.69]、卵胞ホルモン剤単独:1.17[1.10-1.26]、5〜14年間の卵胞ホルモン剤と黄体ホルモン剤併用:2.08[2.02-2.15]、卵胞ホルモン剤単独:1.33[1.28-1.37])、MHT非使用者に対する調整リスク比はMHT過去使用者よりMHT現使用者の方が高かった。また、MHT過去使用者において、投与中止後も過去の投与期間に依存して乳癌になる危険性が10年以上持続する場合があるとの報告がある6)。[8.1参照]
15.1.3 HRTと冠動脈性心疾患の危険性
15.1.4 HRTと脳卒中の危険性
15.1.5 HRTと認知症の危険性
15.1.6 HRTと卵巣癌の危険性
(2)米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、卵巣癌になる危険性がプラセボ投与群と比較して有意ではないが、高い傾向がみられた(ハザード比:1.58)との報告がある15)。
15.1.7 卵胞ホルモン剤の長期投与により、肝腫瘍が発生したとの報告がある。
15.1.8 高用量の卵胞ホルモン剤の投与により、プロラクチン分泌性の下垂体腫瘍(プロラクチノーマ)が増大したとの報告がある。
15.1.9 HRTと胆のう疾患の危険性
米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、胆のう疾患になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.59)との報告がある。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、胆のう疾患になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.67)との報告がある16)。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
閉経後の健康女性10例に、エストラジオール(E2)1.0mg及びレボノルゲストレル(LNG)0.04mgを併用して単回経口投与したとき、E2は経口投与後2時間以内に速やかに吸収され、血漿中E2濃度は投与6〜8時間後に最高血漿中濃度(Cmax)に達した。その後12時間後までその血漿中濃度はほぼ一定であった。血漿中E2濃度は投与48時間後には、ほぼ投与前値まで減少した。また、血漿中エストロン(E1)濃度の経時的変化はE2で認められたものと類似していた。血漿中LNG濃度は投与1時間後にCmaxに達し、その後二相性の消失を示した17)。
| 測定物質 | Cmax(pg/mL) | tmax(h) | AUC(0-48h)(ng・h/mL) | t1/2(h) |
| E2(9例) | 32.4±7.5 | 7.3±2.9 | 0.82±0.22 | 18.0±6.2 |
| E1(9例) | 209.4±56.6 | 7.3±2.5 | 4.49±1.44 | 13.2±5.2 |
| LNG(10例) | 1210±490 | 1.1±0.4 | 7.7±5.6 | 39.1±19.7 |
16.1.2 反復投与
閉経後の健康女性10例にE2 1.0mg及びLNG 0.04mgを併用して1日1回28日間反復経口投与したとき、血漿中E2濃度は投与開始後第5日目までに定常状態に達し、定常状態のE2の血漿中平均トラフ濃度は約20pg/mLであった。28日間反復経口投与した場合のE2の蓄積係数は約2であった。血漿中E1濃度は、血漿中E2の6〜7倍の濃度で、E2と類似した血漿中濃度推移を示した。血漿中LNG濃度は投与開始後第5日目までに定常状態に達し、定常状態下のLNGの血漿中平均トラフ濃度は約330pg/mLであった。28日間反復経口投与した場合のLNGの蓄積係数は約2であった18)。
| 測定物質 | 投与第1日目 <初回投与> | 投与第28日目 <最終投与> | |
| Cmax(pg/mL) | E2(9例) | 23.4±6.8 | 47.8±15.4 |
| E1(9例) | 175.2±49.8 | 315.9±130.2 | |
| LNG(10例) | 720±270 | 1020±390 | |
| tmax(h) | E2(9例) | 4.22±1.86 | 4.44±1.67 |
| E1(9例) | 5.56±1.94 | 3.78±1.20 | |
| LNG(10例) | 2.60±0.97 | 2.20±0.63 | |
| AUC(0-12h)(ng・h/mL) | E2(9例) | 0.216±0.067 | 0.461±0.150 |
| E1(9例) | 1.44±0.45 | 2.73±1.01 | |
| LNG(10例) | 4.19±1.64 | 6.81±2.59 |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内後期第II/III相試験
自然閉経又は両側卵巣摘出に伴う骨粗鬆症患者309例(子宮摘出例を含む)を対象としたプラセボ対照無作為化二重盲検試験(基礎治療薬としてカルシウム500mg、ビタミンD3 200IU/日を全例投与)において、エストラジオール1.0mg含有製剤を投与した患者(下表脚注参照)の腰椎骨密度はプラセボ対照群に比して有意に増加した(下表参照)。骨代謝マーカーは閉経前女性の基準値内に回復し、最小有意変化を超える投与前からの変化率を示した19)。
| 28週 | 52週 | 80週 | 104週 | ||
| 腰椎骨密度 (L2-4、DEXA法) | プラセボ投与 | +0.80 | +0.11 | − | − |
| E2 1.0mg投与 | +6.16 | +7.95 | +9.60 | +10.15 |
副作用(臨床検査値異常を含む)はエストラジオール1.0mg/レボノルゲストレル0.04mg配合剤を投与した患者171例(プラセボ投与群の2年目投与例54例含む)中117例(68.4%)に認められた。主な副作用は、乳房不快感42例(24.6%)、乳房痛24例(14.0%)、性器分泌物21例(12.3%)、性器出血15例(8.8%)、乳頭痛12例(7.0%)等であった。
子宮内膜組織診を1年間投与後に実施した118例、2年間投与後に実施した76例に、子宮内膜増殖症は認められなかった。投与1年後の発現率は0.0%(95%信頼区間:0.0〜3.1)であった。また、投与前に1.87mmであった平均子宮内膜厚は、1年後には2.75mm(N=98)、2年後には3.04mm(N=88)に増加した。
18. 薬効薬理
18.1 作用機序
エストラジオールはエストロゲン受容体に結合し、転写活性を促進する。またレボノルゲストレルはすべてのプロゲスチンと同様に、プロゲステロン受容体に結合し活性化する。
18.2 骨に対する作用
卵巣摘出ラットにエストラジオール2.5mg/kg/日(経口)あるいはエストラジオール2.5mg/kg(経口)にレボノルゲストレル0.25mg/kg(皮下)の併用を12週間投与したとき、卵巣摘出による大腿骨及び第4腰椎海綿骨骨密度の減少を抑制し、レボノルゲストレル併用による影響は認められなかった。また、骨量、形成面及び骨形成速度にはレボノルゲストレル併用による影響は認められなかった20)。
18.3 子宮内膜過形成及び子宮内膜癌に対する予防作用
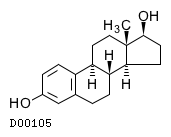
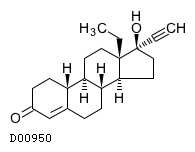
19. 有効成分に関する理化学的知見
19.1. エストラジオール
19.2. レボノルゲストレル
22. 包装
140錠[28錠(PTP)×5]
23. 主要文献
- Grady D,et al., Obstet Gynecol., 85, 304-313, (1995) »PubMed »DOI
- Chlebowski RT,et al., JAMA., 289, 3243-3253, (2003) »PubMed »DOI
- Anderson GL,et al., JAMA., 291, 1701-1712, (2004) »PubMed »DOI
- Stefanick ML,et al., JAMA., 295, 1647-1657, (2006) »PubMed »DOI
- Beral V,et al., Lancet., 362, 419-427, (2003) »PubMed »DOI
- Collaborative Group on Hormonal Factors in Breast Cancer, Lancet., 394, 1159-1168, (2019)
- Manson JE,et al., New Engl J Med., 349, 523-534, (2003) »PubMed
- Wassertheil-Smoller S,et al., JAMA., 289, 2673-2684, (2003) »PubMed
- Hendrix SL,et al., Circulation., 113, 2425-2434, (2006) »PubMed
- Shumaker SA,et al., JAMA., 289, 2651-2662, (2003) »PubMed
- Shumaker SA,et al., JAMA., 291, 2947-2958, (2004) »PubMed
- Rodriguez C,et al., JAMA., 285, 1460-1465, (2001) »PubMed
- Lacey JV Jr,et al., JAMA., 288, 334-341, (2002) »PubMed
- Beral V,et al., Lancet., 369, 1703-1710, (2007) »PubMed
- Anderson GL,et al., JAMA., 290, 1739-1748, (2003) »PubMed
- Cirillo DJ,et al., JAMA., 293, 330-339, (2005) »PubMed
- 社内資料:薬物動態(単回投与)(2008年10月16日承認、CTD2.7.2.2.2.1)
- 社内資料:薬物動態(反復投与)(2008年10月16日承認、CTD2.7.2.2.2.2)
- 社内資料:骨粗鬆症患者を対象とした二重盲検試験(2008年10月16日承認、CTD2.7.6.3.1)
- 社内資料:薬効薬理(2008年10月16日承認、CTD2.6.2.2.6.1)
- 社内資料:薬効薬理(2008年10月16日承認、CTD2.6.2.2.6.3)
- 社内資料:薬効薬理(2008年10月16日承認、CTD2.6.2.2.6.2)
24. 文献請求先及び問い合わせ先
文献請求先
バイエル薬品株式会社
メディカルインフォメーション
〒530-0001
大阪市北区梅田二丁目4番9号
文献請求先
製品情報問い合わせ先
バイエル薬品株式会社
電話:0120-106-398
バイエル医療用医薬品のお問い合わせ先
26. 製造販売業者等
26.1 製造販売元
バイエル薬品株式会社
大阪市北区梅田二丁目4番9号