医薬品情報
| 総称名 | ロコイド |
|---|---|
| 一般名 | ヒドロコルチゾン酪酸エステル |
| 欧文一般名 | Hydrocortisone Butyrate |
| 製剤名 | ヒドロコルチゾン酪酸エステル(Hydrocortisone Butyrate)製剤 |
| 薬効分類名 | 外用副腎皮質ホルモン剤 |
| 薬効分類番号 | 2646 |
| ATCコード | D07AA02 D07AB02 D07XA01 |
| KEGG DRUG |
D01619
ヒドロコルチゾン酪酸エステル
|
| KEGG DGROUP |
DG00012
ヒドロコルチゾン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロコイド軟膏0.1% | LOCOID OINTMENT 0.1% | 鳥居薬品 | 2646717M1096 | 14.9円/g | |
| ロコイドクリーム0.1% | LOCOID CREAM 0.1% | 鳥居薬品 | 2646717N1083 | 14.9円/g |
2. 禁忌
次の患者には投与しないこと
2.1 細菌・真菌・スピロヘータ・ウイルス皮膚感染症、及び動物性皮膚疾患(疥癬、けじらみ等)[感染症及び動物性皮膚疾患症状を悪化させることがある。]
2.2 本剤に対して過敏症の既往歴のある患者
2.3 鼓膜に穿孔のある湿疹性外耳道炎[穿孔部位の治癒が遅れるおそれがある。また、感染のおそれがある。]
2.4 潰瘍(ベーチェット病は除く)、第2度深在性以上の熱傷・凍傷[皮膚の再生が抑制され、治癒が著しく遅れるおそれがある。また、感染のおそれがある。]
4. 効能または効果
5. 効能または効果に関連する注意
皮膚感染を伴う湿疹・皮膚炎には使用しないことを原則とするが、やむを得ず使用する必要がある場合には、あらかじめ適切な抗菌剤(全身適用)、抗真菌剤による治療を行うか、又はこれらとの併用を考慮すること。
6. 用法及び用量
通常1日1〜数回適量を塗布する。
なお、症状により適宜増減する。
なお、症状により適宜増減する。
8. 重要な基本的注意
8.2 本剤の使用により症状の改善がみられない場合又は症状の悪化をみる場合は使用を中止すること。
8.3 症状改善後は、できるだけ速やかに使用を中止すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.7 小児等
長期・大量使用又は密封法(ODT)により発育障害をきたすおそれがある。また、おむつは密封法と同様の作用があるので注意すること。[8.1参照]
9.8 高齢者
大量又は長期にわたる広範囲の密封法(ODT)等の使用に際しては特に注意すること。一般に高齢者では副作用があらわれやすい。[8.1参照]
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 眼圧亢進、緑内障、白内障(いずれも頻度不明)
眼瞼皮膚への使用に際しては、眼圧亢進、緑内障、白内障を起こすおそれがある。大量又は長期にわたる広範囲の使用、密封法(ODT)により、緑内障、後嚢下白内障等の症状があらわれるおそれがある。[8.1参照]
11.2 その他の副作用
| 副作用発現頻度 | 注意・処置 | |||
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | ||
| 皮膚の感染症 | 真菌症(白癬等)、細菌感染症(毛嚢炎・せつ、汗疹等) | 真菌症(カンジダ症)、細菌感染症(伝染性膿痂疹)、ウイルス感染症 | 密封法(ODT)の場合に起こり易い。このような症状があらわれた場合には、適切な抗真菌剤、抗菌剤等を併用し、症状が速やかに改善しない場合には本剤の使用を中止すること。 | |
| その他の皮膚症状 | ざ瘡様疹 | 酒さ様皮膚炎・口囲皮膚炎(ほほ、口囲等に潮紅、膿疱、丘疹、毛細血管拡張)、ステロイド皮膚(皮膚萎縮、毛細血管拡張、紫斑) | 特に長期連用に際しては注意すること。このような症状があらわれた場合には徐々にその使用を差し控え、副腎皮質ステロイドを含有しない薬剤に切り換えること。 | |
| 乾皮症様皮膚 | 接触皮膚炎、魚鱗癬様皮膚変化、多毛、色素脱失 | |||
| 過敏症 | 過敏症(発赤、そう痒感、刺激感、皮膚炎等) | |||
| 下垂体・副腎皮質系機能 | 下垂体・副腎皮質系機能の抑制 | 大量又は長期にわたる広範囲の使用、密封法(ODT)により、きたすことがある。 | ||
14. 適用上の注意
14.1 薬剤交付時の注意
患者に化粧下、ひげそり後などに使用することのないよう注意すること。
14.2 薬剤投与時の注意
眼科用として角膜、結膜には使用しないこと。
16. 薬物動態
16.2 吸収
14C-Hydrocortisone 17-butyrateクリームを正常人及び腋臭症患者の腋窩皮膚に密封塗布し、オートラジオグラフィーにより検索した結果、短時間で角質層に沈着がみられ、時間とともにしだいに増強した。本剤除去後24時間においても皮膚貯留現象を示した。有棘層及び皮膚付属器への沈着は軽度であった2)。
16.3 分布
16.3.1 ラットに14C-Hydrocortisone 17-butyrate(14C-H-17B)を皮下注射したとき、14C-H-17Bの放射能はほぼ全身に分布し、投与30分後では肝臓、次いで腎臓、膵臓、小腸、心臓、肺、顎下腺、大腿筋の順であった。投与1時間後には、小腸、肝臓で高い放射能を示し、心臓、顎下腺を除いて最高値を示した。その後時間経過とともに減少し、特定臓器への蓄積傾向は認められなかった。
16.3.2 ラットに14C-H-17Bクリームを健常皮膚に塗布後、ラジオオートグラムを作成したところ、投与部位以外にはフィルムを感光させるほどの放射能は認められなかった。
16.4 代謝
Hydrocortisone 17-butyrateの分解をBritton緩衝液、牛血清、ラット肝臓ホモジネートを用いて検討した結果、Britton緩衝液、牛血清では、Hydrocortisone 21-butyrateと、Hydrocortisoneを認め、ラット肝臓ホモジネートではHydrocortisoneは認めたが、Hydrocortisone 21-butyrateはほとんど認められなかった(in vitro)。
16.5 排泄
ラットに14C-H-17Bを皮下注射したとき、投与後24時間以内に投与量の約70%に相当する放射能が胆汁から排泄され、投与後24時間以内に投与量の38%が、48時間以内に62%が糞中に排泄された。
また尿中には48時間以内に投与量の9.5%が排泄された。
また尿中には48時間以内に投与量の9.5%が排泄された。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 有効性
| 疾患名 | 有効率(%)(有効以上/評価症例数) | |||
| 軟膏 | クリーム | 計 | ||
| 湿疹・皮膚炎群 | 接触皮膚炎 | 90.8(59/65) | 81.1(30/37) | 87.3(89/102) |
| アトピー性皮膚炎(乳児湿疹を含む) | 87.1(330/379) | 79.2(76/96) | 85.5(406/475) | |
| 神経皮膚炎(ビダール苔癬を含む) | 86.7(13/15) | 90.0(18/20) | 88.6(31/35) | |
| 脂漏性湿疹 | 81.8(27/33) | 87.1(81/93) | 85.7(108/126) | |
| 貨幣状湿疹 | 77.3(17/22) | 100(4/4) | 80.8(21/26) | |
| 急性湿疹 | 84.4(54/64) | 87.7(71/81) | 86.2(125/145) | |
| 慢性湿疹 | 78.9(30/38) | 71.1(32/45) | 74.7(62/83) | |
| 手の皮膚炎 | 41.7(25/60) | 67.9(38/56) | 54.3(63/116) | |
| 痒疹群 | 84.6(11/13) | 83.3(20/24) | 83.8(31/37) | |
| 尋常性乾癬 | 83.6(107/128) | 80.1(133/166) | 81.6(240/294) | |
| 掌蹠膿疱症 | 27.3(3/11) | 69.2(9/13) | 50.0(12/24) | |
18. 薬効薬理
18.1 作用機序
ヒドロコルチゾン酪酸エステルは合成副腎皮質ステロイドであり、グルココルチコイド受容体を刺激することにより抗炎症作用を示す。
18.2 血管収縮作用
健康成人男子20名を対象とし、本剤と市販のベタメタゾン吉草酸エステル、トリアムシノロンアセトニド、フルオシノロンアセトニド、デキサメタゾン、ヒドロコルチゾン酢酸エステルの製剤をクローズドパッチして比較検討した結果、本剤は優れた血管収縮作用を示した3)。
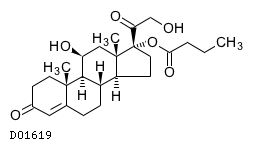
19. 有効成分に関する理化学的知見
19.1. ヒドロコルチゾン酪酸エステル
22. 包装
<ロコイド軟膏0.1%>
アルミチューブ(5g×10、5g×50、10g×10、10g×50)
プラスチック容器(100g、500g)
<ロコイドクリーム0.1%>
アルミチューブ(5g×10、5g×50、10g×10、10g×50)
プラスチック容器(100g、500g)
23. 主要文献
- 青山卓夫ほか, 応用薬理, 8 (7), 1035-1047, (1974)
- 竹田勇士ほか, 西日本皮膚科, 36 (1), 24-30, (1974) »DOI
- 石原 勝, 薬理と治療, 3 (6), 1037-1047, (1975)
24. 文献請求先及び問い合わせ先
文献請求先
鳥居薬品株式会社
お客様相談室
〒103-8439
東京都中央区日本橋本町3-4-1
電話:0120-316-834
FAX:03-3231-6890
製品情報問い合わせ先
鳥居薬品株式会社
お客様相談室
〒103-8439
東京都中央区日本橋本町3-4-1
電話:0120-316-834
FAX:03-3231-6890
26. 製造販売業者等
26.1 製造販売元
鳥居薬品株式会社
東京都中央区日本橋本町3-4-1
26.2 提携先
CHEPLAPHARM Arzneimittel GmbH