医薬品情報
| 総称名 | リカルボン |
|---|---|
| 一般名 | ミノドロン酸水和物 |
| 欧文一般名 | Minodronic Acid Hydrate |
| 製剤名 | ミノドロン酸水和物錠 |
| 薬効分類名 | 骨粗鬆症治療剤 |
| 薬効分類番号 | 3999 |
| KEGG DRUG |
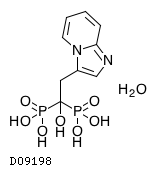
D09198
ミノドロン酸水和物
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年1月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リカルボン錠1mg | RECALBON Tablets | 小野薬品工業 | 3999026F1034 | 58.9円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
本剤の適用にあたっては、日本骨代謝学会の診断基準等を参考に、骨粗鬆症との診断が確定している患者を対象とすること。
6. 用法及び用量
通常、成人にはミノドロン酸水和物として1mgを1日1回、起床時に十分量(約180mL)の水(又はぬるま湯)とともに経口投与する。
なお、服用後少なくとも30分は横にならず、飲食(水を除く)並びに他の薬剤の経口摂取も避けること。
なお、服用後少なくとも30分は横にならず、飲食(水を除く)並びに他の薬剤の経口摂取も避けること。
7. 用法及び用量に関連する注意
投与にあたっては次の点を患者に指導すること。
7.1 本剤は水(又はぬるま湯)で服用すること。水以外の飲料(Ca、Mg等の含量の特に高いミネラルウォーターを含む)、食物及び他の薬剤と一緒に服用すると、吸収を妨げることがあるので、起床後、最初の飲食前に服用し、かつ服用後少なくとも30分は水以外の飲食を避ける。
7.2 食道及び局所への副作用の可能性を低下させるため、速やかに胃内へと到達させることが重要である。服用に際しては、以下の事項に注意すること。
・口腔咽頭刺激の可能性があるので、本剤を噛んだり又は口中で溶かしたりしないこと。
・十分量(約180mL)の水(又はぬるま湯)とともに服用し、服用後30分は横たわらないこと。
・就寝時又は起床前に服用しないこと。
8. 重要な基本的注意
8.1 上部消化管に関する副作用が報告されているので、これらの症状があらわれた場合は、本剤の服用を中止して診察を受けるよう指導すること。[11.1.1参照]
8.2 患者の食事によるカルシウム、ビタミンDの摂取が不十分な場合は、カルシウム又はビタミンDを補給すること。ただし、カルシウム補給剤及びカルシウム、アルミニウム、マグネシウム含有製剤は、本剤の吸収を妨げることがあるので、服用時刻を変えて服用させること。[10.2参照]
8.3 ビスホスホネート系薬剤による治療を受けている患者において、顎骨壊死・顎骨骨髄炎があらわれることがある。報告された症例の多くが抜歯等の顎骨に対する侵襲的な歯科処置や局所感染に関連して発現している。リスク因子としては、悪性腫瘍、化学療法、血管新生阻害薬、コルチコステロイド治療、放射線療法、口腔の不衛生、歯科処置の既往等が知られている。
本剤の投与開始前は口腔内の管理状態を確認し、必要に応じて、患者に対し適切な歯科検査を受け、侵襲的な歯科処置をできる限り済ませておくよう指導すること。本剤投与中に侵襲的な歯科処置が必要になった場合には本剤の休薬等を考慮すること。
また、口腔内を清潔に保つこと、定期的な歯科検査を受けること、歯科受診時に本剤の使用を歯科医師に告知して侵襲的な歯科処置はできる限り避けることなどを患者に十分説明し、異常が認められた場合には、直ちに歯科・口腔外科を受診するように指導すること。[11.1.2参照]
本剤の投与開始前は口腔内の管理状態を確認し、必要に応じて、患者に対し適切な歯科検査を受け、侵襲的な歯科処置をできる限り済ませておくよう指導すること。本剤投与中に侵襲的な歯科処置が必要になった場合には本剤の休薬等を考慮すること。
また、口腔内を清潔に保つこと、定期的な歯科検査を受けること、歯科受診時に本剤の使用を歯科医師に告知して侵襲的な歯科処置はできる限り避けることなどを患者に十分説明し、異常が認められた場合には、直ちに歯科・口腔外科を受診するように指導すること。[11.1.2参照]
8.4 ビスホスホネート系薬剤を使用している患者において、外耳道骨壊死が発現したとの報告がある。これらの報告では、耳の感染や外傷に関連して発現した症例も認められることから、外耳炎、耳漏、耳痛等の症状が続く場合には、耳鼻咽喉科を受診するよう指導すること。[11.1.3参照]
8.5 ビスホスホネート系薬剤を長期使用している患者において、非外傷性又は軽微な外力による大腿骨転子下、近位大腿骨骨幹部、近位尺骨骨幹部等の非定型骨折が発現したとの報告がある。これらの報告では、完全骨折が起こる数週間から数ヵ月前に大腿部、鼠径部、前腕部等において前駆痛が認められている報告もあることから、このような症状が認められた場合には、X線検査等を行い、適切な処置を行うこと。また、両側性の骨折が生じる可能性があることから、片側で非定型骨折が起きた場合には、反対側の部位の症状等を確認し、X線検査を行うなど、慎重に観察すること。X線検査時には骨皮質の肥厚等、特徴的な画像所見がみられており、そのような場合には適切な処置を行うこと。[11.1.4参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 嚥下困難、食道炎、胃炎、十二指腸炎、又は潰瘍等の上部消化管障害がある患者
上部消化管粘膜に対し、刺激作用を示すことがあるので基礎疾患を悪化させるおそれがある。[11.1.1参照]
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
9.4 生殖能を有する者
妊娠する可能性のある女性へは、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ビスホスホネート系薬剤は骨基質に取り込まれた後に全身循環へ徐々に放出される。全身循環への放出量はビスホスホネート系薬剤の投与量・期間に相関する。ビスホスホネート系薬剤の中止から妊娠までの期間と危険性との関連は明らかではない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。他のビスホスホネート系薬剤と同様、生殖試験(ラット)において、低カルシウム血症による分娩障害の結果と考えられる母動物の死亡並びに出生率の低下等がみられている。[2.5参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母動物(ラット)へ投与した場合、乳汁中に移行することが示されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| 水以外の飲料、食物 特に牛乳や乳製品のような高カルシウム含有飲食物 多価陽イオン(カルシウム、鉄、マグネシウム、アルミニウム等)含有製剤 ミネラル入りビタミン剤、制酸剤等 [8.2参照] | 同時に服用すると本剤の吸収に影響を与えるおそれがあるので、本剤の服用後少なくとも30分は左記の飲食物や薬剤を摂取・服用しないよう、患者を指導すること。 | 本剤は多価陽イオンと錯体を形成することがあるので、併用すると本剤の吸収を低下させる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど、適切な処置を行うこと。
11.1.1 上部消化管障害
11.1.2 顎骨壊死・顎骨骨髄炎(頻度不明)[8.3参照]
11.1.3 外耳道骨壊死(頻度不明)[8.4参照]
11.1.4 大腿骨転子下、近位大腿骨骨幹部、近位尺骨骨幹部等の非定型骨折(頻度不明)[8.5参照]
11.1.5 肝機能障害、黄疸
AST、ALT等の上昇を伴う肝機能障害、黄疸(いずれも頻度不明)があらわれることがある。
11.1.6 低カルシウム血症
痙攣、テタニー、しびれ、失見当識、QT延長等を伴う低カルシウム血症(頻度不明)があらわれることがある。[2.4、9.2.1参照]
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒、アレルギー性皮膚炎 | ||
| 消化器 | 胃・腹部不快感、腹痛、胃炎 | 逆流性食道炎、悪心、嘔吐、下痢、便秘、腹部膨満、消化不良、食欲不振、口内炎、口唇炎 | 口渇、歯肉痛、口の錯感覚 |
| 血液 | 白血球減少、赤血球減少、血小板減少、単球増加 | ||
| 肝臓 | AST上昇、ALT上昇、γ-GTP上昇、ビリルビン上昇、アルカリホスファターゼ上昇、LDH上昇 | ||
| 腎臓 | BUN上昇、尿酸上昇、クレアチニン上昇 | ||
| 筋・骨格系 | 血中カルシウム減少 | アルカリホスファターゼ減少、CK上昇 | 筋・骨格痛(関節痛、背部痛、筋肉痛、四肢痛、疼痛、骨痛等) |
| 精神神経系 | しびれ、坐骨神経痛、めまい | 頭痛 | |
| その他 | 胸痛、コレステロール増加、脱毛、膀胱炎、副鼻腔炎、倦怠感、血圧上昇、血中リン上昇、血中リン減少 | 顔面浮腫、発熱 |
13. 過量投与
13.1 症状
低カルシウム血症、上部消化管障害(胃不調、胸やけ、食道炎、胃炎、又は胃潰瘍等)が発現する可能性がある。
13.2 処置
吸収を抑えるために、多価陽イオンを含有する制酸剤あるいは牛乳を投与する。また、未吸収薬剤を除去するために胃洗浄を考慮する。なお、低カルシウム血症には必要に応じて、カルシウムの静脈内投与等の処置を行う。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康高齢男女各10例(65〜79歳)及び非高齢男女各10例(20〜31歳)にミノドロン酸水和物1mgを空腹時に単回経口投与したとき、高齢・非高齢者とも性差は認められなかった。また、高齢者のCmax、AUC及び投与後24時間までの尿中未変化体排泄率は非高齢者に比べて2.1倍、2.4倍及び2.0倍高く、加齢により本剤の吸収率は上昇することが示唆された。2)
| 対象 | Tmax(hr) | Cmax(ng/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) | 尿中排泄率(%) |
| 非高齢男性 | 1.4±0.6 | 0.3134±0.2176 | 1.325±0.845 | 8.2±3.4 | 0.40±0.18 |
| 非高齢女性 | 1.2±0.6 | 0.2564±0.1186 | 1.074±0.379 | 11.5±2.8 | 0.28±0.09 |
| 高齢男性 | 1.3±0.5 | 0.5555±0.2516 | 2.814±1.196 | 9.7±1.3 | 0.74±0.37 |
| 高齢女性 | 1.2±0.7 | 0.6512±0.4425 | 3.051±2.285 | 9.9±1.9 | 0.75±0.56 |
16.1.2 反復投与
健康成人男性6例にミノドロン酸水和物2mgを1日1回7日間反復投与したときの血漿中未変化体濃度は遅くとも投与7日目に定常状態に到達していると推察された。反復投与7日目のCmax及びAUCは投与初日と比較してそれぞれ1.1倍及び1.3倍であった。3)
(注)本剤の承認された用量は「1mgを1日1回、経口投与する。」である。
16.2 吸収
健康成人男性29例にミノドロン酸水和物1mgを空腹時に単回経口投与したとき、血漿中濃度は投与後1.2時間で最高に達し、その濃度は0.39ng/mLで、消失半減期は9.7時間であった。また、食前30分投与では空腹時投与に比しCmaxは約0.5倍、AUCは約0.3倍に低下した。4)
| 投与条件 | Tmax(hr) | Cmax(ng/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) |
| 空腹時 | 1.2±0.7 | 0.3895±0.1767 | 1.549±0.682 | 9.7±3.5 |
| 食前30分 | 0.8±0.3 | 0.1913±0.1092 | 0.504±0.310 | 6.6±5.1 |
また、健康成人男性12例にミノドロン酸水和物4mgを空腹時、食前1時間又は食後3時間に単回経口投与したとき、AUCは空腹時投与に比べ、食前1時間投与で約0.3倍、食後3時間投与で約0.1倍に低下した。5)
(注)本剤の承認された用量は「1mgを1日1回、経口投与する。」である。
16.3 分布
ヒト血漿蛋白結合率は、14C-ミノドロン酸水和物添加濃度5〜500ng/mLにおいて61.2〜61.9%であり、この濃度範囲においてほぼ一定であった(in vitro、超遠心法)。6)
16.4 代謝
16.5 排泄
健康高齢・非高齢男女各10例にミノドロン酸水和物1mgを空腹時に単回経口投与したとき、投与後24時間までの尿中未変化体排泄率は非高齢男性で0.40%、非高齢女性で0.28%、高齢男性で0.74%、高齢女性で0.75%であった。2)
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 骨密度試験
退行期骨粗鬆症患者を対象とした48週間の第III相二重盲検試験※1)(骨密度試験)において、本剤群(122例)の腰椎平均骨密度の変化率±標準偏差は5.964±3.5875%(最終評価時※2))であり、本剤の骨密度増加効果が確認された。大腿骨近位部total骨密度の変化率±標準偏差は3.575±3.4755%(最終評価時※2))であり、本剤の骨密度増加効果が確認された。また、本剤は骨吸収マーカー(尿中I型コラーゲン架橋N-テロペプチド:尿中NTX)を低下させ、骨吸収抑制作用を示すことが確認された。8)
| 投与期間 | 腰椎平均骨密度[変化率]±標準偏差 |
| 投与12週後 | 3.266±3.3945%(121例) |
| 投与24週後 | 4.585±3.5962%(121例) |
| 投与36週後 | 5.483±3.1280%(120例) |
| 投与48週後 | 6.028±3.6031%(119例) |
| 最終評価時※2) | 5.964±3.5875%(122例) |
※1)基礎治療薬として1日1回夕食後にカルシウムとして208mgを経口投与
※2)投与48週後又は投与中止時の時点
安全性評価対象となった134例中28例(20.9%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、胃不快感7例(5.2%)、上腹部痛5例(3.7%)、血中クレアチニンホスホキナーゼ増加4例(3.0%)であった。
17.1.2 骨折試験
退行期骨粗鬆症患者を対象とした2年間の第III相二重盲検試験※3)(骨折試験)において、本剤群及びプラセボ群の椎体骨折発生率(累積)はそれぞれ10.4%、24.0%であり(相対リスク減少率59%)、プラセボに対して有意な骨折防止効果が確認された(Log-rank検定:p<0.0001)。9)
| 本剤群(n=339) | プラセボ群(n=328) | |
| 椎体骨折発生率(累積)※4) | 10.4% | 24.0% |
| 新規椎体骨折発生率(累積)※5) | 7.8% | 18.5% |
| 投与24週後以降の椎体骨折発生率(累積)※4) | 4.7% | 16.6% |
※3)基礎治療薬として1日1回夕食後にカルシウムとして600mg及びビタミンD3として200IUを経口投与
※4)新規骨折+既存椎体骨折の増悪
※5)新規骨折のみ
また、2年間投与による本剤群(83例)の腰椎平均骨密度の変化率±標準偏差は8.267±5.3360%(最終評価時※6))で、プラセボに対して有意に大きかった(t検定:p<0.0001)。9)
安全性評価対象となった354例中57例(16.1%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、胃不快感14例(4.0%)、上腹部痛8例(2.3%)、胃炎7例(2.0%)であった。
更に1年間延長して実施された継続試験において、3年間投与による本剤群(194例)の椎体骨折発生率(累積)は、12.4%であった。3年間投与時の1年毎の椎体骨折発生率(累積)は1年目6.7%、2年目3.6%、3年目3.2%であった。3年間投与による本剤群(56例)の腰椎平均骨密度の変化率±標準偏差は10.271±5.9692%(最終評価時※7))であった。10)
骨折試験開始から継続試験終了までの3年間において安全性評価対象となった219例中26例(11.9%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、胃炎6例(2.7%)、胃不快感5例(2.3%)、上腹部痛4例(1.8%)であった。
※6)投与104週後又は投与中止時の時点
※7)投与156週後又は投与中止時の時点
臨床試験において本剤を投与された男性患者は、前期第II相試験の1例(1.5mg投与群)であった。
(注)本剤の承認された用量は「1mgを1日1回、経口投与する。」である。
18. 薬効薬理
18.1 作用機序
18.2 薬理作用
18.2.1 骨吸収抑制作用
ウサギ破骨細胞培養系において、骨からのI型コラーゲン架橋C-テロペプチド遊離を抑制する(in vitro)。13)
18.2.2 骨粗鬆症モデル動物における作用
(1)ラット卵巣摘出モデルにおいて、尿中デオキシピリジノリン濃度の上昇を抑制し、骨密度及び骨強度の低下を抑制する。14)
(2)カニクイザル卵巣摘出モデルにおいて、尿中I型コラーゲン架橋N-テロペプチド及びデオキシピリジノリン濃度の上昇を抑制する。また、骨密度及び骨強度の低下を抑制し、骨密度と骨強度には正の相関関係が認められる。15)
(3)ラットステロイド誘発モデルにおいて、尿中デオキシピリジノリン濃度の上昇を抑制し、骨密度及び骨強度の低下を抑制する。16)
(4)ラット不動化モデルにおいて、骨密度の低下を抑制する。16)
18.2.3 骨石灰化に及ぼす影響
18.2.4 骨折治癒に及ぼす影響
ラット腓骨骨折モデルにおいて、臨床用量の約1.5倍以上の用量で仮骨の吸収を遅延させたが、臨床用量の約15倍の用量まで骨強度の低下は認められていない。17)
19. 有効成分に関する理化学的知見
19.1. ミノドロン酸水和物
22. 包装
100錠[10錠(PTP)×10]
140錠[14錠(PTP)×10]
23. 主要文献
- MID-NETを用いた調査結果の概要(MID-NETを用いたビスホスホネート製剤の腎機能障害患者における低カルシウム血症のリスク評価に関するデータベース調査), (https://www.pmda.go.jp/files/000249186.pdf)
- 上里一雄ほか, 薬理と臨床, 18 (Suppl.1), S285-295, (2008)
- 前田 彰ほか, 薬理と臨床, 18 (Suppl.1), S239-252, (2008)
- 上里一雄ほか, 薬理と臨床, 18 (Suppl.1), S275-283, (2008)
- 前田 彰ほか, 薬理と臨床, 18 (Suppl.1), S253-261, (2008)
- 碓井孝志ほか, 薬理と臨床, 18 (Suppl.1), S215-225, (2008)
- 碓井孝志ほか, 薬理と臨床, 18 (Suppl.1), S151-161, (2008)
- 小野薬品工業:第III相二重盲検骨密度試験(2009年1月21日承認、CTD 2.7.6.13)
- 小野薬品工業:第III相二重盲検骨折試験(2009年1月21日承認、CTD 2.7.6.14)
- 小野薬品工業:第III相骨折継続投与試験(2009年1月21日承認、CTD 2.7.6.15)
- 野崎一敏ほか, 薬理と臨床, 18 (Suppl.1), S7-18, (2008)
- 森 裕史ほか, 破骨細胞数減少作用(2009年1月21日承認、CTD 2.6.2.2.2.3)
- 森 裕史ほか, 薬理と臨床, 18 (Suppl.1), S19-32, (2008)
- Tanaka M.et al., Bone, 43, 894-900, (2008)
- Mori H.et al., Bone, 43, 840-848, (2008)
- 森 裕史ほか, 薬理と臨床, 18 (Suppl.1), S75-85, (2008)
- 野崎一敏ほか, 薬理と臨床, 18 (Suppl.1), S65-74, (2008)
24. 文献請求先及び問い合わせ先
文献請求先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
製品情報問い合わせ先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
26. 製造販売業者等
26.1 製造販売
小野薬品工業株式会社
大阪市中央区久太郎町1丁目8番2号