医薬品情報
| 総称名 | ガスモチン |
|---|---|
| 一般名 | モサプリドクエン酸塩水和物 |
| 欧文一般名 | Mosapride Citrate Hydrate |
| 薬効分類名 | 消化管運動機能改善剤 |
| 薬効分類番号 | 2399 |
| ATCコード | A03FA09 |
| KEGG DRUG |
D01994
モサプリドクエン酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ガスモチン錠5mg | GASMOTIN Tablets | 住友ファーマ | 2399010F2024 | 10.4円/錠 | |
| ガスモチン錠2.5mg | GASMOTIN Tablets | 住友ファーマ | 2399010F1028 | 10.4円/錠 | |
| ガスモチン散1% | GASMOTIN Powders | 住友ファーマ | 2399010B1034 | 19.8円/g |
4. 効能または効果
○慢性胃炎に伴う消化器症状(胸やけ、悪心・嘔吐)
○経口腸管洗浄剤によるバリウム注腸X線造影検査前処置の補助
5. 効能または効果に関連する注意
<経口腸管洗浄剤によるバリウム注腸X線造影検査前処置の補助>
塩化ナトリウム、塩化カリウム、炭酸水素ナトリウム及び無水硫酸ナトリウム含有経口腸管洗浄剤(ニフレック配合内用剤)以外の経口腸管洗浄剤との併用による臨床試験は実施されていない。[17.1.2参照]
6. 用法及び用量
<慢性胃炎に伴う消化器症状(胸やけ、悪心・嘔吐)>
通常、成人には、モサプリドクエン酸塩として1日15mgを3回に分けて食前または食後に経口投与する。
<経口腸管洗浄剤によるバリウム注腸X線造影検査前処置の補助>
通常、成人には、経口腸管洗浄剤の投与開始時にモサプリドクエン酸塩として20mgを経口腸管洗浄剤(約180mL)で経口投与する。また、経口腸管洗浄剤投与終了後、モサプリドクエン酸塩として20mgを少量の水で経口投与する。
7. 用法及び用量に関連する注意
<慢性胃炎に伴う消化器症状(胸やけ、悪心・嘔吐)>
一定期間(通常2週間)投与後、消化器症状の改善について評価し、投与継続の必要性について検討すること。
8. 重要な基本的注意
8.1 劇症肝炎や重篤な肝機能障害、黄疸があらわれることがあるので、長期にわたって漫然と投与しないこと。また、患者に対し、本剤投与後に倦怠感、食欲不振、尿濃染、眼球結膜黄染等の症状があらわれた場合は、本剤を中止し、医師等に連絡するよう指導すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に腎機能、肝機能等の生理機能が低下している。なお、慢性胃炎に伴う消化器症状に用いる際に、副作用が発現した場合には、減量(例えば1日7.5mg)するなど適切な処置を行うこと。
10. 相互作用
10.2 併用注意
| 抗コリン作用を有する薬剤 アトロピン ブチルスコポラミン 等 | 本剤の作用が減弱する可能性があるので、抗コリン剤を服用する場合は、服用間隔をあけるなど注意すること。 | 本剤の消化管運動の促進作用は、コリン作動性神経の賦活により発現するため、抗コリン剤の併用により本剤の作用が抑制される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 劇症肝炎、肝機能障害、黄疸(いずれも頻度不明)
劇症肝炎、著しいAST、ALT、γ-GTPの上昇等を伴う重篤な肝機能障害、黄疸があらわれることがあり、死亡に至った例もある。[8.1参照]
11.2 その他の副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
| 1〜2%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 浮腫 | 発疹、じん麻疹 | |
| 血液 | 好酸球増多 | 白血球減少 | |
| 消化器 | 下痢・軟便 | 口渇、味覚異常、腹痛、嘔吐 | 嘔気、腹部膨満感、口内しびれ感(舌、口唇等を含む) |
| 肝臓 | AST、ALT、ALP、γ-GTP、ビリルビンの上昇 | ||
| 循環器 | 心悸亢進 | ||
| 精神神経系 | めまい・ふらつき、頭痛 | ||
| その他 | 中性脂肪の上昇 | 倦怠感 | 振戦 |
| 1〜5%未満 | 1%未満 | |
| 消化器 | 腹部膨満感、嘔気、腹痛 | 胃部不快感、おくび |
| 肝臓 | ビリルビンの上昇 | |
| 精神神経系 | 頭痛 | 眠気 |
| その他 | 尿潜血、尿蛋白 | 胸部不快感、寒気、倦怠感、顔面腫脹、LDHの上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
げっ歯類に臨床通常用量の100〜330倍(30〜100mg/kg/日)を長期間経口投与した試験(ラット104週間、マウス92週間)において、腫瘍(肝細胞腺腫及び甲状腺濾胞性腫瘍)の発生率の上昇が認められた。
16. 薬物動態
16.1 血中濃度
16.1.1 単独投与時
| Tmax(h) | Cmax(ng/mL) | T1/2(h) | AUC0〜∞(ng・h/mL) |
| 0.8±0.1 | 30.7±2.7 | 2.0±0.2 | 67±8 |
16.1.2 経口腸管洗浄剤併用時
| 投与時期 | Tmax(h) | Cmax(ng/mL) | AUC(ng・h/mL) |
| 1回目(24例) | 1.0±0.5 | 116.1±35.1 | 150.3±45.2(0〜2) |
| 2回目(23例) | 2.5±0.2 | 272.6±80.9 | 848.8±301.4(0〜24) |
16.3 分布
16.3.1 血清蛋白結合率
99.0%(in vitro、ヒト血清、1μg/mL、限外ろ過法又は平衡透析法)3)
16.4 代謝
16.5 排泄
16.5.1 排泄経路
尿中、糞便中
16.5.2 排泄率
投与後48時間までの尿中排泄率は、未変化体として0.1%、主代謝物(4-フルオロベンジル基脱離体)として7.0%であった1)(健康成人、空腹時本剤5mg1回投与)。
16.7 薬物相互作用
16.7.1 エリスロマイシン
本剤15mg/日にエリスロマイシン1,200mg/日を併用したところ、単独投与時に比べて、モサプリドの最高血漿中濃度は42.1ng/mLから65.7ng/mLに上昇し、半減期は1.6時間から2.4時間に延長し、AUC0〜4は62ng・h/mLから114ng・h/mLに増加した6)(健康成人)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<慢性胃炎に伴う消化器症状(胸やけ、悪心・嘔吐)>
17.1.1 国内臨床試験
二重盲検比較試験を含む総計435例についての臨床成績は次のとおりである7)。
| 対象疾患/症状 | 改善率 | |
| 慢性胃炎 | 胸やけ | 74%(130/176) |
| 悪心・嘔吐 | 77%(150/196) | |
<経口腸管洗浄剤によるバリウム注腸X線造影検査前処置の補助>
17.1.2 国内第III相試験
バリウム注腸X線造影検査の前処置におけるブラウン変法との比較試験は、計99例を対象として実施された。その結果、本剤と経口腸管洗浄剤(ニフレック配合内用剤)併用群の「右大腸バリウムの付着性スコア」及び「右大腸便残渣の量スコア」について、ブラウン変法群に劣らないことが確認された。[5.参照]
| 群 | ブラウン変法群 | 本剤とニフレック配合内用剤との併用群 |
| 右大腸バリウムの付着性スコア | 9.4±1.0 | 9.3±1.5 |
| 右大腸便残渣の量スコア | 9.2±1.5 | 10.8±1.6 |
安全性評価対象48例(本剤とニフレック配合内用剤との併用群)中8例(16.7%)に副作用がみられた。発現頻度が5%以上であった副作用は、腹部膨満3例(6.3%)であった8)。
18. 薬効薬理
18.1 作用機序
18.2 上部消化管運動促進作用
18.3 下部消化管運動促進作用
19. 有効成分に関する理化学的知見
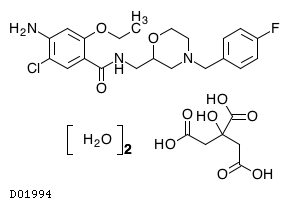
19.1. モサプリドクエン酸塩水和物
22. 包装
<ガスモチン錠5mg>
100錠[10錠(PTP)×10]
1,000錠[10錠(PTP)×100]
1,050錠[21錠(PTP)×50]
1,000錠[瓶、バラ]
<ガスモチン錠2.5mg>
100錠[10錠(PTP)×10]
<ガスモチン散1%>
100g[瓶、バラ]
500g[瓶、バラ]
23. 主要文献
- Sakashita M.,et al., Arzneim.-Forsch./Drug Res., 43, 867-872, (1993) »PubMed
- 降旗謙一ほか, 診療と新薬, 46, 262-271, (2009)
- Matsumoto S.,et al., Arzneim.-Forsch./Drug Res., 43, 1084-1094, (1993) »PubMed
- Matsumoto S.,et al., Arzneim.-Forsch./Drug Res., 43, 1095-1102, (1993) »PubMed
- 社内資料:代謝酵素(2009年4月22日承認、CTD2.6.4)
- 加藤貴雄ほか, 臨床医薬, 15, 753-763, (1999)
- 三好秋馬ほか, 臨床医薬, 14, 1037-1053, (1998)
- 杉野吉則ほか, 日本大腸検査学会雑誌, 25, 99-114, (2008)
- Yoshida N.,et al., J.Pharmacol.Exp.Ther., 257, 781-787, (1991) »PubMed
- 社内資料:薬効薬理(2009年4月22日承認、CTD2.6.2)
- Inui A.,et al., Jpn.J.Pharmacol., 90, 313-320, (2002) »PubMed »DOI
- 金泉年郁ほか, 日本平滑筋学会雑誌, 26, 161-174, (1990) »DOI
- 須山哲次ほか, 内科宝函, 40, 175-183, (1993)
- Mine Y.,et al., J.Pharmacol.Sci., 110, 415-423, (2009) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
製品情報問い合わせ先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
26. 製造販売業者等
26.1 製造販売元
住友ファーマ株式会社
大阪市中央区道修町2-6-8