医薬品情報
| 総称名 | ルミガン |
|---|---|
| 一般名 | ビマトプロスト |
| 欧文一般名 | Bimatoprost |
| 製剤名 | ビマトプロスト点眼液 |
| 薬効分類名 | プロスタマイド誘導体 緑内障・高眼圧症治療剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01EE03 |
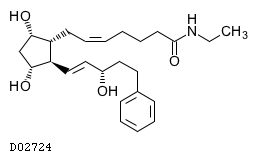
| KEGG DRUG |
D02724
ビマトプロスト
|
| KEGG DGROUP |
DG03201
眼圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年2月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ルミガン点眼液0.03% | LUMIGAN OPHTHALMIC SOLUTION 0.03% | 千寿製薬 | 1319757Q1027 | 485円/mL | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
緑内障、高眼圧症
6. 用法及び用量
1回1滴、1日1回点眼する。
7. 用法及び用量に関連する注意
頻回投与により眼圧下降作用が減弱する可能性があるので、1日1回を超えて投与しないこと。
8. 重要な基本的注意
8.1 本剤の投与により、虹彩や眼瞼への色素沈着(メラニンの増加)による色調変化、あるいは眼周囲の多毛化があらわれることがある。これらは投与の継続により徐々に進行し、投与中止により停止する。眼瞼色調変化及び眼周囲の多毛化については、投与中止後徐々に消失、あるいは軽減する可能性があるが、虹彩色調変化については投与中止後も消失しないことが報告されている。混合色虹彩の患者では虹彩の色調変化は明確に認められるが、暗褐色の単色虹彩の患者(日本人に多い)においても変化が認められている。特に片眼投与の場合、左右眼で虹彩の色調に差が生じる可能性がある。これらの症状については、長期的な情報が十分に得られていないので、患者を定期的に診察し、十分観察すること。投与に際しては、これらの症状について患者に十分説明し、また、眼瞼色調変化、眼周囲の多毛化の予防あるいは軽減のため、投与の際に液が眼瞼皮膚等についた場合には、よくふき取るか、洗顔するよう患者を指導すること。[11.1.1、14.1参照]
8.2 本剤投与中に角膜上皮障害(点状表層角膜炎、糸状角膜炎、角膜びらん)があらわれることがあるので、しみる、そう痒感、眼痛等の自覚症状が持続する場合には、直ちに受診するよう患者に十分に指導すること。
8.3 本剤の点眼後、一時的に霧視があらわれることがあるため、症状が回復するまで機械類の操作や自動車等の運転には従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 無水晶体眼又は眼内レンズ挿入眼の患者
嚢胞様黄斑浮腫を含む黄斑浮腫、及びそれに伴う視力低下を起こすとの報告がある。
9.1.2 眼内炎(虹彩炎、ぶどう膜炎)のある患者
類薬で眼圧上昇がみられたとの報告がある。
9.1.3 ヘルペスウイルスが潜在している可能性のある患者
角膜ヘルペスが再発したとの報告がある。
9.1.4 閉塞隅角緑内障の患者
使用経験がない。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット:静脈内投与)で乳汁中に移行することが報告されている3)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| プロスタグランジン系点眼剤 ラタノプロスト含有点眼剤 | 眼圧上昇がみられたとの報告がある4)。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 虹彩色素沈着(13.2%)[8.1参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 0.1〜1%未満 | 頻度不明 | |
| 眼 | 睫毛の異常(睫毛が長く、太く、濃くなる等)(52.8%)、結膜充血(44.9%)、眼瞼色素沈着(20.5%)、眼そう痒症(9.6%)、眼瞼の多毛症 | 結膜炎、結膜浮腫、結膜出血、眼瞼浮腫、眼瞼紅斑、眼瞼そう痒症、眼瞼障害、眼脂、点状角膜炎、角膜びらん、眼刺激、霧視、眼の異常感(違和感、べとつき感等)、くぼんだ眼注) | 結膜色素沈着、眼瞼炎、眼瞼下垂、霰粒腫、マイボーム腺梗塞、糸状角膜炎、角膜血管新生、虹彩炎、眼乾燥、眼の灼熱感、眼痛、羞明、白内障、眼精疲労、視力低下、視覚障害、眼球運動失調、眼圧上昇 | ぶどう膜炎、黄斑浮腫、乾性角結膜炎、流涙、涙液分泌低下 |
| 循環器 | 狭心症発作、高血圧 | |||
| 消化器 | 胃不快感 | |||
| 呼吸器 | 咳嗽 | |||
| その他 | 尿潜血、CK増加 | 口唇疱疹、浮動性めまい、頭痛、胸痛、耳鳴、白血球数増加、ALT(GPT)増加、γ−GTP増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・点眼のとき、液が眼瞼皮膚等についた場合には、すぐにふき取るか、洗顔すること。[8.1参照]
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・本剤に含まれているベンザルコニウム塩化物は、ソフトコンタクトレンズに吸着することがあるので、コンタクトレンズを装用している場合は点眼前にレンズを外し、点眼15分以上経過後に再装用すること。
15. その他の注意
16. 薬物動態
16.1 血中濃度
健康成人(6例)の両眼に本剤を1回1滴、1日1回14日間反復点眼したとき、14日目の血液中ビマトプロスト濃度は、点眼後平均約8分で最高濃度(平均値±標準偏差)0.061±0.025ng/mLに達し、点眼後1時間以降は定量下限値(0.025ng/mL)未満であった。また、活性代謝物である17-フェニルトリノルプロスタグランジンF2αはいずれの測定時点でも定量下限値(0.050ng/mL)未満であった6)。
16.3 分布
サルに0.1%3H-ビマトプロスト点眼液35μLを両眼に単回点眼したとき、組織中放射能の最高濃度は、結膜、眼瞼、強膜、角膜、虹彩、毛様体、網脈絡膜、視神経、房水、水晶体、硝子体の順に高かった。また、サルの両眼に0.1%3H-ビマトプロスト点眼液を1日2回9日間反復点眼したとき、組織中放射能濃度は眼瞼、結膜、角膜、強膜、毛様体、水晶体、硝子体、網脈絡膜及び視神経で単回投与と比べて高くなる傾向が認められた7)。
16.5 排泄
健康成人(6例)に3H-ビマトプロストを単回静脈内投与したとき、放射能の67.0%が投与後168時間までに尿中に、24.9%が投与後192時間までに糞中に排泄された8)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相比較試験(0.5%チモロール点眼液対照試験)
原発開放隅角緑内障又は高眼圧症患者を対象に、本剤を両眼に1回1滴、1日1回注)又は0.5%チモロール点眼液を両眼に1回1滴、1日2回、12週間点眼した無作為化二重遮蔽並行群間比較試験を実施した。その結果、主要評価項目である治療期終了時(投与12週後)の眼圧変化値は表1のとおりであり、本剤群の0.5%チモロール点眼液群に対する優越性が示された9)。
| 薬剤(例数) | 眼圧変化値(mmHg) | 差の平均値(mmHg)[95%両側信頼区間] | 検定結果 |
| 本剤群(87) | −8.2±3.5 | −3.4[−4.2〜−2.5] | P<0.001 |
| 0.5%チモロール点眼液群(86) | −4.9±2.2 |
本剤群の副作用は90例中70例(77.8%)に認められ、主な副作用は結膜充血44例(48.9%)、睫毛の異常(睫毛が長く、太く、濃くなる等)31例(34.4%)、眼そう痒症13例(14.4%)、眼瞼色素沈着12例(13.3%)、虹彩色素沈着11例(12.2%)、結膜浮腫10例(11.1%)、角膜びらん7例(7.8%)、眼の異常感7例(7.8%)、眼瞼浮腫5例(5.6%)、眼瞼の多毛症5例(5.6%)であった。
注)遮蔽性を確保するため、本剤群と0.5%チモロール点眼液群の点眼回数を合わせる目的で、本剤群にはプラセボを1日1回追加点眼した。
17.1.2 国内第III相比較試験(0.005%ラタノプロスト点眼液対照試験)
原発開放隅角緑内障又は高眼圧症患者を対象に、本剤又は0.005%ラタノプロスト点眼液を片眼又は両眼に1回1滴、1日1回、12週間点眼した無作為化単遮蔽(評価者遮蔽)並行群間比較試験を実施した。その結果、主要評価項目である治療期終了時(投与12週後)の眼圧変化値は表2のとおりであり、群間差の95%信頼区間の上限が非劣性限界値(Δ=1.5)を超えなかったことから、本剤群の0.005%ラタノプロスト点眼液群に対する非劣性が示された10)。
| 薬剤(例数) | 眼圧変化値(mmHg) | 差の平均値(mmHg)[95%両側信頼区間] |
| 本剤群(71) | −8.0±2.7 | −0.6[−1.5〜0.3] |
| 0.005%ラタノプロスト点眼液群(63) | −7.4±2.8 |
本剤群の副作用は77例中51例(66.2%)に認められ、主な副作用は結膜充血31例(40.3%)、睫毛の異常(睫毛が長く、太く、濃くなる等)27例(35.1%)、眼瞼色素沈着8例(10.4%)、眼そう痒症6例(7.8%)、眼の異常感4例(5.2%)、結膜浮腫4例(5.2%)であった。
17.1.3 国内第III相長期投与試験
原発開放隅角緑内障(広義)又は高眼圧症患者を対象に、本剤を両眼に1回1滴、1日1回最長52週間点眼した長期投与試験を実施した。その結果、眼圧変化値の推移は図のとおりであり、52週間を通して−7.2〜−6.3mmHgの範囲で推移し、本剤の安定した眼圧下降効果が示された11)。
図 眼圧変化値の推移
副作用は136例中125例(91.9%)に認められ、主な副作用は睫毛の異常(睫毛が長く、太く、濃くなる等)102例(75.0%)、結膜充血61例(44.9%)、眼瞼色素沈着42例(30.9%)、虹彩色素沈着29例(21.3%)、結膜炎(アレルギー性結膜炎含む)10例(7.4%)、眼そう痒症10例(7.4%)、眼瞼の多毛症9例(6.6%)、くぼんだ眼7例(5.1%)であった。
18. 薬効薬理
18.1 作用機序
ビマトプロストはプロスタマイド受容体に作用し、ぶどう膜強膜流出路を介した房水流出を促進することより眼圧を下降させると考えられている12)。
18.1.1 プロスタマイド受容体への作用
イヌに0.03%ビマトプロスト点眼液を1日1回5日間反復点眼したときの眼圧下降作用は、プロスタマイド受容体拮抗薬の前処置により阻害された13)。
18.1.2 房水流出促進作用
サルに0.01%ビマトプロスト点眼液を1日2回5日間反復点眼したとき、ぶどう膜強膜流出路からの房水流出量を基剤点眼群と比較して有意に増加させた(フルオレセイントレーサ法)14)。
18.2 眼圧下降作用
隅角レーザー照射により高眼圧を誘発したサルに0.001%〜0.1%ビマトプロスト点眼液を単回点眼したとき、すべての用量で眼圧下降作用が認められた15)。
19. 有効成分に関する理化学的知見
19.1. ビマトプロスト
22. 包装
プラスチック点眼容器
2.5mL×5、2.5mL×10
23. 主要文献
- 社内資料:マウス胚・胎児発生への影響に関する試験(承認年月日:2009年7月7日、CTD2.6.6.6)
- 社内資料:ラット出生前、出生後の発生並びに母体機能に関する試験(承認年月日:2009年7月7日、CTD2.6.6.6)
- 社内資料:ラットにおける乳汁排泄(承認年月日:2009年7月7日、CTD2.6.4.6)
- Herndon LW,et al., Arch Ophthalmol, 120, 847-849, (2002) »PubMed
- Aihara M,et al., Jpn J Ophthalmol, 55, 600-604, (2011) »PubMed
- 社内資料:ビマトプロスト点眼液の14日間反復点眼試験(承認年月日:2009年7月7日、CTD2.7.6.2)
- 社内資料:ビマトプロスト点眼液をサルに点眼後の眼組織中濃度(承認年月日:2009年7月7日、CTD2.6.4.1)
- 社内資料:健康成人における3H-ビマトプロストのマスバランス試験(承認年月日:2009年7月7日、CTD2.7.6.7)
- 社内資料:国内第III相比較試験(0.5%チモロール点眼液対照試験)(承認年月日:2009年7月7日、CTD2.7.6.4)
- 北澤克明 他, あたらしい眼科, 27, 401-410, (2010)
- 新家 眞 他, あたらしい眼科, 28, 1209-1215, (2011)
- 社内資料:作用機序(承認年月日:2009年7月7日、CTD2.4.2.1)
- 社内資料:ビマトプロスト点眼液の眼圧下降作用に対するプロスタマイド拮抗剤の阻害作用(承認年月日:2009年7月7日、CTD2.6.2.2)
- Woodward DF,et al., J Ophthalmol, 2010, 926192, (2010) »PubMed
- Woodward DF,et al., J Pharmacol Exp Ther, 305, 772-785, (2003) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
製品情報問い合わせ先
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
26. 製造販売業者等
26.1 製造販売元
千寿製薬株式会社
大阪市中央区瓦町三丁目1番9号
26.2 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号