医薬品情報
| 総称名 | ユナシン |
|---|---|
| 一般名 | スルタミシリントシル酸塩水和物 |
| 欧文一般名 | Sultamicillin Tosilate Hydrate |
| 製剤名 | スルタミシリントシル酸塩水和物散 |
| 薬効分類名 | 合成ペニシリン製剤 |
| 薬効分類番号 | 6131 |
| ATCコード | J01CR04 |
| KEGG DRUG |
D01668
スルタミシリントシル酸水和物
|
| KEGG DGROUP |
DG01480
ペニシリン系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ユナシン細粒小児用10% | Unasyn Fine Granules for Pediatric Use 10% | ファイザー | 6131008C1033 | 75.3円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 伝染性単核症の患者[アンピシリンの投与により発疹が高頻度に発現したとの報告がある。]
4. 効能または効果
<適応菌種>
<適応症>
表在性皮膚感染症、深在性皮膚感染症、リンパ管・リンパ節炎、慢性膿皮症、咽頭・喉頭炎、扁桃炎、急性気管支炎、肺炎、肺膿瘍、慢性呼吸器病変の二次感染、膀胱炎、腎盂腎炎、中耳炎、副鼻腔炎
5. 効能または効果に関連する注意
<咽頭・喉頭炎、扁桃炎、急性気管支炎、中耳炎、副鼻腔炎>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常小児に対しスルタミシリンとして、1日量15〜30mg(力価)/kgとし、これを3回に分割して経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、β-ラクタマーゼ産生菌、かつアンピシリン耐性菌を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 ショックがあらわれるおそれがあるので、十分な問診を行うこと。[11.1.1参照]
8.3 1日30mg/kgを超える投与により、下痢・軟便が増加することがあるので注意すること。[11.1.5参照]
8.4 急性腎障害、間質性腎炎等の重篤な腎障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。投与が長期にわたる場合には、定期的に検査を行うことが望ましい。[11.1.3参照]
8.5 無顆粒球症、溶血性貧血、血小板減少等の重篤な血液障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。投与が長期にわたる場合には、定期的に検査を行うことが望ましい。[11.1.4参照]
8.6 肝機能障害、黄疸があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。投与が長期にわたる場合には、定期的に検査を行うことが望ましい。[11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 ペニシリン系抗生物質に対し過敏症の既往歴のある患者(ただし、本剤に対し過敏症の既往歴のある患者には投与しないこと)
治療上やむを得ないと判断される場合を除き、投与しない。
9.1.2 セフェム系抗生物質に対し過敏症の既往歴のある患者
9.1.3 本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー反応を起こしやすい体質を有する患者
9.1.4 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏症による出血傾向があらわれることがある。
9.2 腎機能障害患者
9.2.1 高度の腎機能障害のある患者
血中濃度半減期が延長するので、投与量・投与間隔に注意すること。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。アンピシリンの大量(3,000mg/kg/日)投与でラットに催奇形性が報告されている。アンピシリン及びスルバクタムは胎盤を通過することが報告されている。
9.6 授乳婦
9.7 小児等
低出生体重児及び新生児を対象とした臨床試験は実施していない。
9.8 高齢者
次の点に注意し、用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
9.8.1 一般的に生理機能が低下していることが多く副作用が発現しやすい。
9.8.2 ビタミンK欠乏による出血傾向があらわれることがある。
10. 相互作用
10.2 併用注意
| アロプリノール | アンピシリンとの併用により、発疹の発現が増加するとの報告がある4)。 | 機序不明だが薬剤性の発疹がアロプリノールとアンピシリンを併用していた67例の入院患者のうち22.4%に認められ、アンピシリン単独服用例の1,257例では7.5%に認められた。またアンピシリンを併用しないアロプリノール服用患者283例のうち2.1%が薬剤性発疹を経験したという報告がある。 |
| 抗凝血剤 | ペニシリンが血小板の凝集・凝固に影響を与え、出血傾向を増強するおそれがある。 | 抗凝血作用とペニシリンの血小板凝集抑制作用により相加的に出血傾向が増強される可能性がある。 |
| 経口避妊薬 | アンピシリンとの併用により避妊効果が減弱したとの報告がある。 | 本剤は腸内細菌叢を変化させる可能性があり、それにより経口避妊薬の腸肝循環による再吸収を抑制すると考えられている。 |
| メトトレキサート | ペニシリンとの併用により、メトトレキサートのクリアランスが減少するおそれがある。 | メトトレキサートの尿細管分泌が阻害され、体内からの消失が遅延し、メトトレキサートの毒性が増強する可能性がある。 |
| プロベネシド | 併用により、本剤の血中濃度上昇、血中濃度半減期の延長、本剤の持つ毒性リスクの上昇のおそれがある。 | プロベネシドの尿細管分泌抑制作用により本剤の排泄が遅延するおそれがある。 |
11. 副作用
11.1 重大な副作用
11.1.1 ショック(0.01%注))、アナフィラキシー(頻度不明)[8.2参照]
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発疹性膿疱症、剥脱性皮膚炎(いずれも頻度不明)
11.1.3 急性腎障害、間質性腎炎(いずれも頻度不明)
急性腎障害、間質性腎炎等の重篤な腎障害があらわれることがある。[8.4参照]
11.1.4 血液障害(頻度不明)
無顆粒球症、溶血性貧血、血小板減少等の重篤な血液障害があらわれることがある。[8.5参照]
11.1.5 出血性大腸炎(0.04%注))、偽膜性大腸炎(頻度不明)
出血性大腸炎、偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがあるので、腹痛、下痢があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。[8.3参照]
11.1.6 肝機能障害、黄疸(いずれも頻度不明)[8.6参照]
注:錠剤と細粒を合わせた発現頻度
11.2 その他の副作用
| 1%以上a) | 0.1〜1%未満a) | 0.1%未満a) | 頻度不明 | |
| 過敏症 | 発疹 | 蕁麻疹、そう痒 | 多形紅斑、血管浮腫、皮膚炎 | |
| 血液 | 好酸球増多 | 顆粒球減少、血小板減少、白血球減少、好中球減少 | 貧血 | |
| 代謝及び栄養障害 | 低カリウム血症 | |||
| 肝臓 | AST、ALT、Al-Pの上昇 | |||
| 消化器 | 下痢・軟便 | 悪心・嘔吐、胃部不快感、胃・腹部痛 | 食欲不振、舌炎 | 黒毛舌、消化不良、胸やけ |
| 菌交代 | 口内炎 | |||
| 中枢神経 | めまい | 痙攣 | ||
| その他 | 発熱、頭痛、倦怠感、傾眠 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等)、呼吸困難、疲労 |
12. 臨床検査結果に及ぼす影響
12.1 本剤の投与により、ベネディクト試薬、あるいはフェーリング試薬による尿糖検査では偽陽性を呈することがあるので注意すること。
12.2 妊婦へのアンピシリン投与により、総結合型エストリオール、エストリオール-グルクロニド、結合型エストロン、エストラジオールの一時的な血清中濃度の減少を呈することがあるので注意すること。
13. 過量投与
13.1 症状
β-ラクタム系抗生物質製剤の脳脊髄液中濃度が高くなると、痙攣等を含む神経系の副作用を引き起こすことが考えられる。
13.2 処置
腎機能障害患者に過量投与された場合は血液透析を用いて体内から除去すること。
14. 適用上の注意
14.1 薬剤交付時の注意
本剤は主薬の苦味を防ぐためコーティングをほどこしてあるので、細粒をつぶしたり溶かしたりすることなく、酸性飲料を避け、水又は牛乳で速やかに服用するように指導すること。
16. 薬物動態
16.1 血中濃度
小児患者11例に、本剤10mg(力価)/kgを空腹時又は食後にクロスオーバー法により経口投与したときの血清中濃度のピークはいずれの投与においてもアンピシリン(ABPC)及びスルバクタム(SBT)とも投与1時間後にみられた。ピーク時の血清中濃度は空腹時投与でABPC4.75μg/mL、SBT3.95μg/mLであったが、食後投与ではABPC2.95μg/mL、SBT2.55μg/mLであり、空腹時投与の場合の方が食後投与にくらべてABPC、SBT濃度とも高かった。血清中濃度半減期(T1/2)は空腹時投与でABPC0.81時間、SBT0.83時間、食後投与ではABPC1.35時間、SBT1.43時間であった7)。
なお、健常成人にユナシン錠375mg(力価)を1日2回15日間連続経口投与したときABPCとSBTの平均血中濃度推移は15日間にわたりほぼ同様であり、蓄積性は認められなかった8)。
なお、健常成人にユナシン錠375mg(力価)を1日2回15日間連続経口投与したときABPCとSBTの平均血中濃度推移は15日間にわたりほぼ同様であり、蓄積性は認められなかった8)。
16.3 分布
16.3.1 組織内移行
16.4 代謝
健常成人にユナシン錠を投与した場合の尿中の代謝物は、大部分がABPC、SBTであり、他に抗菌活性を有する代謝物は検出されなかった14)。
16.5 排泄
16.5.1 尿中排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者(成人)にユナシン錠750mg(力価)を単回経口投与注)した時のSBTとABPCのT1/2は腎機能低下の程度に比例して表に示したように遷延がみられた。腎機能低下が及ぼす影響はSBT、ABPCともに同様であった15)。[9.2.1参照]
| Ccr(mL/min) | T1/2(hr)a) | 尿中回収率(%) 24時間までa) |
| 80-144 | 1.3/0.9 | 66/55 |
| 25-69 | 2.6/2.3 | 40/30 |
| 6-12 | 8.5/8.1 | 25/19 |
| <5 | 3.3/2.4b) | 未検討 |
なお、血液透析中の患者においては、ABPC、SBT共に透析膜透過性を有するので、体内での蓄積は少なく、特に投与量の変更は必要ないと考えられる<参考>。
注:ユナシン錠の承認された用法及び用量は通常成人1回375mg(力価)を1日2〜3回経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
小児を対象とした一般臨床試験で、効果判定の行われた415例中有効以上394例、有効率94.9%と優れた臨床効果が示された。本剤の投与量は1日26〜30mg/kgが最も多く、投与回数は1日3回投与がほとんどであった16)。
投与期間は4〜7日間が最も多く、ついで8〜14日間であった。
主な疾患に対する本剤の臨床効果は次のとおりであった。
投与期間は4〜7日間が最も多く、ついで8〜14日間であった。
主な疾患に対する本剤の臨床効果は次のとおりであった。
| 疾患群 | 有効例a)/症例 | 有効率(%) |
| 呼吸器感染症(扁桃炎、肺炎など) | 261/271 | 96.3 |
| 尿路感染症(腎盂腎炎、膀胱炎など) | 38/42 | 90.5 |
| 浅在性化膿性疾患(伝染性膿痂疹など) | 70/76 | 92.1 |
| 耳鼻科感染症(中耳炎など) | 12/12 | 100.0 |
小児を対象とした一般臨床試験で細菌学的検討が行われた274株の菌消失率は82.8%(227/274株)であった。β-ラクタマーゼ高度産生株に対する菌消失率は88.4%(61/69株)、低・非産生株に対する菌消失率は80.9%(76/94株)であった16)。
また、菌の薬剤感受性を測定した64株中、β-ラクタマーゼ高度産生株で、アンピシリン耐性株注)は接種菌量106CFU/mL及び108CFU/mLでそれぞれ19株及び49株で、そのうち本剤による菌消失率は89.5%(17/19株)及び85.7%(42/49株)であった。
また、菌の薬剤感受性を測定した64株中、β-ラクタマーゼ高度産生株で、アンピシリン耐性株注)は接種菌量106CFU/mL及び108CFU/mLでそれぞれ19株及び49株で、そのうち本剤による菌消失率は89.5%(17/19株)及び85.7%(42/49株)であった。
注:耐性菌はアンピシリンのMIC≧25μg/mL(アンピシリンディスク感受性−、+に相当)とした。ただし、インフルエンザ菌についてはMIC≧3.13μg/mLとした。
18. 薬効薬理
18.1 作用機序
生体内で遊離したスルバクタムは、β-ラクタマーゼのIc、II、III及びIV型を強く、Ia及びV型を軽度に不可逆的に不活化する。したがって、スルタミシリンではβ-ラクタマーゼによるアンピシリンの加水分解が阻害され、アンピシリン本来の広く、強い抗菌力が発揮される17)。
18.2 抗菌作用
19. 有効成分に関する理化学的知見
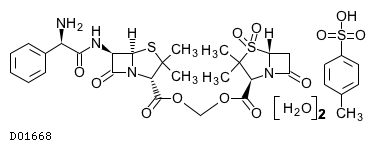
19.1. スルタミシリントシル酸塩水和物
22. 包装
100g[瓶、乾燥剤入り]
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- Matsuda S., Biol Res Pregnancy Perinatol., 5 (2), 57-60, (1984) »PubMed
- Foulds G.et al., Clin Pharmacol Ther., 38 (6), 692-696, (1985)
- N Engl J Med., 286 (10), 505-507, (1972) »PubMed
- 厚生省薬務局, 医薬品研究, 25 (5), 394-403, (1994)
- 社内資料:トシル酸スルタミシリン(ユナシン細粒小児用)の副作用発現状況
- 中村 はるひほか, Jpn J Antibiot., 41 (12), 1874-1894, (1988) »PubMed
- 岡田 敬司ほか, 感染症学雑誌, 59 (7), 749-765, (1985) »DOI
- 酒井 克治ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 446-456, (1985)
- 沢田 康夫ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 395-409, (1985)
- 森 慶人ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 793-797, (1985)
- 富田 弘志ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 369-387, (1985)
- 由良 二郎ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 435-445, (1985)
- 社内資料:Sultamicillin投与時のヒト尿中代謝物の測定
- Boelaert J.et al., Program and abstracts-Interscience Conference on Antimicrobial Agents and Chemotherapy., 239, (1983)
- Jpn J Antibiot., 41 (12), (1988), (SULTAMICILLIN特集号を中心に集計)
- 横田 健ほか, Chemotherapy(Tokyo)., 32 (Suppl. 4), 11-19, (1984)
- 横田 健ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 10-22, (1985)
- 五島 瑳智子ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 37-53, (1985)
- 川崎 賢二ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 82-101, (1985)
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7