医薬品情報
| 総称名 | ビリスコピン |
|---|---|
| 一般名 | イオトロクス酸 |
| 欧文一般名 | Iotroxic Acid |
| 製剤名 | イオトロクス酸メグルミン注射液 |
| 薬効分類名 | 点滴静注胆のう・胆管造影剤 |
| 薬効分類番号 | 7219 |
| ATCコード | V08AC02 |
| KEGG DRUG |
D03902
イオトロクス酸メグルミン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第2版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビリスコピン点滴静注50 | Biliscopin DIC 50 | バイエル薬品 | 7219403A1038 | 8854円/瓶 | 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
胆のう・胆管撮影
6. 用法及び用量
通常、成人では本剤100mLを30〜60分にわたり点滴静注する。
なお、年齢、体重、症状により適宜増減する。
なお、年齢、体重、症状により適宜増減する。
8. 重要な基本的注意
8.2 投与量と投与方法の如何にかかわらず過敏反応を示すことがある。本剤によるショック等の重篤な副作用は、ヨード過敏反応によるものとは限らず、それを確実に予知できる方法はないので、投与に際しては必ず救急処置の準備を行うこと。[1.1、11.1.1、11.1.2参照]
8.3 ショック等の重篤な副作用があらわれることがあるので、投与にあたっては、開始時より患者の状態を観察しながら、慎重に投与すること。過敏反応の発現等異常が認められた場合には、直ちに投与を中止し、適切な処置を行うこと。また、投与後も患者の状態を十分に観察すること。[1.1、11.1.1、11.1.2参照]
8.4 遅発性副作用に備えて、検査終了数時間後にも副作用発現の可能性があることを患者に説明した上で、悪心、嘔吐、発疹、呼吸困難、発熱等が発現した場合には速やかに主治医に連絡するよう注意を与えること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 一般状態の極度に悪い患者
診断上やむを得ないと判断される場合を除き、投与しないこと。
9.1.2 気管支喘息の患者
診断上やむを得ないと判断される場合を除き、投与しないこと。類薬で副作用の発生頻度が高いとの報告がある。
9.1.3 重篤な心障害のある患者
診断上やむを得ないと判断される場合を除き、投与しないこと。血圧低下、頻脈、心悸亢進等の報告があり、重篤な心障害患者においては症状が悪化するおそれがある。
9.1.4 マクログロブリン血症の患者
診断上やむを得ないと判断される場合を除き、投与しないこと。類薬で血液のゼラチン様変化をきたし死亡した報告がある。
9.1.5 テタニーのある患者
診断上やむを得ないと判断される場合を除き、投与しないこと。血中カルシウム低下により、症状が悪化するおそれがある。
9.1.6 褐色細胞腫又はパラガングリオーマの患者及びその疑いのある患者
診断上やむを得ないと判断される場合を除き、投与しないこと。やむを得ず造影検査を実施する場合には静脈確保の上、フェントラミンメシル酸塩等のα遮断薬及びプロプラノロール塩酸塩等のβ遮断薬の十分な量を用意するなど、これらの発作に対処できるよう十分な準備を行い、慎重に投与すること。血圧上昇、頻脈、不整脈等の発作が起こるおそれがある。
9.1.9 脱水症状のある患者
急性腎障害を起こすおそれがある。[11.1.3参照]
9.1.10 高血圧症の患者
血圧上昇等、症状が悪化するおそれがある。
9.1.11 動脈硬化のある患者
心・循環器系に影響を及ぼすことがある。
9.1.12 糖尿病の患者
急性腎障害を起こすおそれがある。[11.1.3参照]
9.1.13 甲状腺疾患のある患者(重篤な甲状腺疾患のある患者を除く)
ヨード過剰に対する自己調節メカニズムが機能できず、症状が悪化するおそれがある。[2.2参照]
9.1.14 多発性骨髄腫の患者
特に脱水症状のある場合、腎不全(無尿等)を起こすおそれがある。[11.1.3参照]
9.2 腎機能障害患者
9.2.1 重篤な腎障害(無尿等)のある患者
診断上やむを得ないと判断される場合を除き、投与しないこと。腎機能低下患者では急性腎障害等、症状が悪化するおそれがある。[11.1.3参照]
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
診断上やむを得ないと判断される場合を除き、投与しないこと。症状が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、診断上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤投与の際にはX線照射を伴う。
9.6 授乳婦
診断上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
患者の状態を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| ビグアナイド系糖尿病用剤 メトホルミン塩酸塩、ブホルミン塩酸塩等 | 類薬で乳酸アシドーシスを起こしたとの報告があるので、異常が認められた場合には、ビグアナイド系糖尿病用剤の減量若しくは投与を中止するなど適切な処置を行うこと。 | ビグアナイド系糖尿病用剤の腎排泄が減少し、血中濃度が上昇するためと考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)
11.1.2 アナフィラキシー(頻度不明)
11.1.3 腎不全(頻度不明)
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 過敏症 | そう痒、発疹 | 紅斑、発赤、じん麻疹 | |
| 循環器 | 動悸 | 血管痛、頻脈 | チアノーゼ、不整脈、虚脱、潮紅、顔面潮紅、血圧低下、蒼白 |
| 呼吸器 | 咳 | 喘息発作、呼吸停止、頻呼吸、鼻炎、咽頭炎 | |
| 消化器 | 悪心、口内乾燥 | 嘔吐、下痢 | 口内異常感、便意、腹痛 |
| 精神神経系 | めまい、頭痛 | 不安感、あくび | |
| 内分泌系 | 甲状腺機能低下症 | ||
| その他 | 熱感 | 倦怠感、悪寒 | 胸内苦悶感、季肋部痛、しびれ感、冷汗 |
12. 臨床検査結果に及ぼす影響
本剤投与により、甲状腺機能検査等の放射性ヨードによる検査に影響を及ぼすことがある。したがって、これらの検査は本剤の投与前に実施すること。本剤投与後2ヵ月間はこれらの検査に影響を及ぼすとの報告がある。
14. 適用上の注意
14.1 薬剤投与前の注意
14.1.1 投与前に体温まで温めること。
14.1.2 投与前には極端な水分制限をしないこと。
14.1.3 撮影前日は軽食(非脂肪食)とし、消化しにくい食物やガスを発生させるような食物は避け、撮影時は空腹であることが望ましい。
14.2 薬剤投与時の注意
14.2.1 脳槽・脊髄造影には使用しないこと。[1.2参照]
14.2.2 注入はできる限りゆっくり行うこと。
14.2.3 他の薬剤(抗ヒスタミン剤、副腎皮質ホルモン剤等)を併用する場合は別々に投与すること。
14.2.4 誤って血管外に造影剤を漏出させた場合には発赤、腫脹、水疱、血管痛等があらわれることがあるので、注入時に十分注意すること。
14.2.5 点滴時間と点滴速度及び撮影時間(本剤100mL)
| 点滴時間 | 点滴速度 | 点滴終了後撮影至適時間 |
| 30分 | 1滴/1秒 | 15〜90分 |
| 45分 | 1滴/1.5秒 | 15〜75分 |
| 60分 | 1滴/2秒 | 15〜60分 |
14.3 薬剤投与後の注意
14.3.1 投与後は水分補給を行い、造影剤の速やかな排泄を促すこと。
14.3.2 1回の検査にのみ使用し、余剰の溶液は廃棄すること。
16. 薬物動態
16.1 血中濃度
肝機能及び腎機能が正常な患者に、イオトロクス酸メグルミン70mgI/kg及び112mgI/kgを静注注)したとき、静注後30分から6時間までの血中半減期は、それぞれ1.4±0.2時間、1.8±0.3時間であった1)(外国人データ)。
16.5 排泄
180mgI/mLのイオトロクス酸メグルミン液を30mL(約70mgI/kg)静注注)すると、糞便中に78±11%(48時間以内)、尿中に10.6±2.3%(24時間以内)が排泄された。静注後7日目までに、ほぼ100%が糞便及び尿中に排泄された2)(外国人データ)。
注)本剤の承認された用法及び用量は、「通常、成人では本剤100mLを30〜60分にわたり点滴静注する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
比較臨床試験3)及び一般臨床試験における289例の造影効果の有効率は次のとおりであった。
| 造影部位 | 造影効果の有効率(検査回数) |
| 胆のう | 89.1%(245/275) |
| 総胆管 | 95.1%(274/288) |
| 総肝管 | 93.4%(269/288) |
| 肝内胆管 | 85.1%(245/288) |
18. 薬効薬理
18.1 測定法
本剤の主成分(イオトロクス酸)の構成元素であるヨウ素は高いX線吸収能をもつ。これに基づき、本剤の存在部位と他の生体組織との間にX線画像上のコントラストが生じる。
19. 有効成分に関する理化学的知見
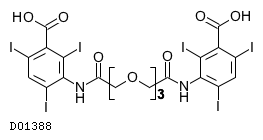
19.1. イオトロクス酸
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
100mL[1瓶]
23. 主要文献
- Taenzer V,et al., RoFo., 126, 262-267, (1977) »PubMed
- 社内資料:131I-meglumine iotroxateのヒトへの1回静注後の薬物動態的検討
- 斎藤達雄他, 胆と膵, 2, 889-906, (1981)
24. 文献請求先及び問い合わせ先
文献請求先
バイエル薬品株式会社
メディカルインフォメーション
〒530-0001
大阪市北区梅田二丁目4番9号
文献請求先
製品情報問い合わせ先
バイエル薬品株式会社
電話:0120-106-398
バイエル医療用医薬品のお問い合わせ先
26. 製造販売業者等
26.1 製造販売元
バイエル薬品株式会社
大阪市北区梅田二丁目4番9号