医薬品情報
| 総称名 | マーズレン |
|---|---|
| 一般名 | アズレンスルホン酸ナトリウム水和物(水溶性アズレン) L-グルタミン |
| 欧文一般名 | L-Glutamine |
| 製剤名 | アズレンスルホン酸ナトリウム/L-グルタミン配合顆粒 |
| 薬効分類名 | 胃炎・消化性潰瘍治療剤 |
| 薬効分類番号 | 2329 |
| KEGG DRUG |
D04363
アズレンスルホン酸ナトリウム・L-グルタミン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年4月 改訂(第2版)

|
4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| マーズレンS配合顆粒 | MARZULENE S Combination Granules | 寿製薬 | 2329122D1414 | 9.6円/g |
4. 効能または効果
6. 用法及び用量
通常成人1日1.5〜2.0gを3〜4回に分割経口投与する。なお、年齢、症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、蕁麻疹、そう痒感 | ||
| 肝臓 | AST、ALT、LDH、Al-P、γ-GTP上昇等の肝機能障害 | ||
| 消化器 | 悪心、嘔吐、便秘、下痢、腹痛、膨満感 | 嘔気、胃部不快感 | |
| その他 | 顔面紅潮 |
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人(生物学的同等性試験)
健康成人男子10名に本剤2g(アズレンスルホン酸ナトリウム水和物として6mg、及びL-グルタミンとして1,980mg)経口投与した。アズレンスルホン酸ナトリウム水和物は投与約5時間後に最高血漿中濃度に達し、その生物学的半減期は約13時間であった。また、L-グルタミンは投与約0.5時間後に最高血漿中濃度に達した1)。
16.1.2 生物学的同等性試験
本剤(2g)とマーズレン配合錠1.0ES(3錠)(いずれもアズレンスルホン酸ナトリウム水和物として6mg)を2剤2期のクロスオーバー法により健康成人男子に絶食時単回経口投与してHPLC法にて血漿中アズレンスルホン酸ナトリウム濃度を測定し、得られた薬物動態パラメータ(AUCt、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された1)。
マーズレン配合錠1.0ES(3錠)又はマーズレンS配合顆粒(2g)経口投与後の血漿中アズレンスルホン酸ナトリウム濃度推移
| 判定パラメータ | 参考パラメータ | |||
| AUC0-48(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| マーズレン配合錠1.0ES(3錠) | 13085±3276 | 757±211 | 4.9±1.9 | 12.8±2.7 |
| マーズレンS配合顆粒(2g) | 13462±2703 | 776±121 | 4.5±1.5 | 13.3±2.8 |
血漿中濃度並びにAUCt、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
注)本剤の承認されている用法及び用量は「通常成人1日1.5〜2.0gを3〜4回に分割経口投与する。」であり、マーズレン配合錠1.0ESの承認されている用法及び用量は「通常成人1日3錠を3回に分割経口投与する。」である。
16.4 代謝
本剤はプロプラノロール、イミプラミン、ジアゼパム、ワルファリンを基質としてチトクロームP450への影響を調べた結果、チトクロームP450へ影響を及ぼさなかった2)(in vitro)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(二重盲検比較試験)
本剤は、アズレンスルホン酸ナトリウム水和物、L-グルタミンの単独投与群に比べ、胃炎、胃潰瘍、十二指腸潰瘍の患者を対象とした二重盲検比較試験においてその有用性が認められている。
試験に用いた薬剤は以下の3剤である。
試験に用いた薬剤は以下の3剤である。
・本剤M:1g中、アズレンスルホン酸ナトリウム水和物3mg及びL-グルタミン990mg含有
・対照薬A:1g中、アズレンスルホン酸ナトリウム水和物3mg含有
・対照薬G:1g中、L-グルタミン990mg含有
(1)胃炎に対する効果
慢性胃炎に対する本剤M群の自他覚症状の総合改善率(有効以上)は、7日目で84.3%(140/166例)、また、自他覚症状の総合改善率と安全性を総合的に判断した有用性(有用以上)は、84.9%(141/166例)と、他の2群に比べ有意に優れた効果を示した3)。
(2)胃潰瘍に対する効果
本剤M群の内視鏡判定(著明改善以上)は61.5%(8/13例)と、他の2群に比べ有意に優れた効果を示した。また、自覚症状の改善率(有効以上)は84.6%(11/13例)と、対照薬G群に比べ有意に優れた効果を示した4)。
(3)十二指腸潰瘍に対する効果
本剤M群の外来患者における自覚症状の項目別改善度(消失率)は8週目で85.3%(58/68例)、また、内視鏡判定(略治以上)は50.0%(9/18例)と、対照薬G群に比べ有意に優れた効果を示した5)。
18. 薬効薬理
18.1 作用機序
18.1.1 抗炎症効果
本剤の配合成分であるアズレンスルホン酸ナトリウム水和物は、炎症性粘膜に直接的に作用し、各種胃炎に効果を発揮するばかりでなく、胃炎・潰瘍の合併症に効果を発揮する6)。
18.1.2 組織修復促進作用
(1)ラットにおいて、NSAIDsによる胃粘膜内のへキソサミン含量の減少を抑制する7)。
18.1.3 血管新生促進作用
ラット酢酸潰瘍モデルにおいて、潰瘍底の血管新生を促進する10)。
18.1.4 ペプシノゲン量減少作用
ラットにおいて、本剤投与により胃粘膜内ペプシノゲン量を対照に比してpH2.0で約75%、pH3.5で約78%に減少させた11)。
18.2 実験病態モデル
19. 有効成分に関する理化学的知見
19.1. アズレンスルホン酸ナトリウム水和物(水溶性アズレン)
| 一般的名称 | アズレンスルホン酸ナトリウム水和物(水溶性アズレン) |
|---|---|
| 化学名 | Sodium 1,4-dimethyl-7-isopropylazulene-3-sulfonate hemihydrate or hydrate |
| 分子式 | C15H17NaO3S・1/2H2O又はH2O |
| 分子量 | 309.36又は318.36 |
| 物理化学的性状 | 暗青色の結晶又は結晶性の粉末で、におい及び味はない。メタノールにやや溶けやすく、水又は酢酸(100)にやや溶けにくく、エタノール(95)に溶けにくく、無水酢酸、ジエチルエーテル又はヘキサンにほとんど溶けない。光により変化し、水溶液(1→200)のpHは6.0〜9.0である。 |
| 理化学知見その他 | 19.1 アズレンスルホン酸ナトリウム水和物 |
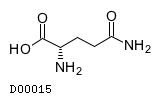
19.2. L-グルタミン
20. 取扱い上の注意
20.1 開封後は光を遮り、直射日光や高温を避けて保存すること。
20.2 多少の色調幅があるが、成分等に影響はない。
22. 包装
400g[0.67g(分包)×3×20×10枚]
480g[1.0g(分包)×3×20×8枚]
525g[0.5g(分包)×3×7×50枚]
500g[500g(アルミニウム袋、バラ)×1袋]
1kg[500g(アルミニウム袋、バラ)×2袋]
23. 主要文献
- 社内資料:マーズレン配合錠1.0ESとマーズレンS配合顆粒の製剤間のヒト生物学的同等性の検証
- 佐藤正雄ほか, 薬理と治療, 26 (4), 481-484, (1998)
- 三好秋馬ほか, 内科宝函, 29 (5), 297-332, (1982)
- 関口利和ほか, 基礎と臨床, 11 (2), 679-686, (1977)
- 小林節雄ほか, 新薬と臨牀, 30 (11), 1855-1873, (1981)
- 中沢三郎ほか, 診療と新薬, 11 (9), 1839-1849, (1974)
- 内藤俊一ほか, 薬理と治療, 12 (1), 183-186, (1984)
- Martinson EE,et al., Biokhimiia., 27 (3), 437-441, (1962)
- Leloir LF,et al., Biochim.Biophys.Acta., 12, 15-22, (1953) »PubMed
- 林啓一郎ほか, 薬理と治療, 26 (4), 465-472, (1998)
- 川村武ほか, 基礎と臨床, 19 (13), 6443-6446, (1985)
- 川村武ほか, 基礎と臨床, 19 (10), 5195-5199, (1985)
- 堀裕子ほか, 薬理と治療, 22 (9), 3777-3783, (1994)
- 堀裕子ほか, 薬理と治療, 22 (10), 4305-4313, (1994)
- 岡部進ほか, 応用薬理, 9 (1), 31-37, (1975)
24. 文献請求先及び問い合わせ先
文献請求先
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:0120-917-719
製品情報問い合わせ先
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:0120-917-719
26. 製造販売業者等
26.1 製造販売元
寿製薬株式会社
長野県埴科郡坂城町大字上五明字東川原198
26.2 販売元
EAファーマ株式会社
東京都中央区入船二丁目1番1号