医薬品情報
| 総称名 | アドシルカ |
|---|---|
| 一般名 | タダラフィル |
| 欧文一般名 | Tadalafil |
| 製剤名 | タダラフィル錠 |
| 薬効分類名 | ホスホジエステラーゼ5阻害剤 |
| 薬効分類番号 | 2190 |
| KEGG DRUG |
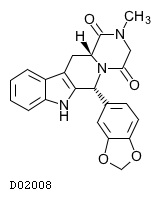
D02008
タダラフィル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年11月 改訂(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アドシルカ錠20mg | Adcirca Tablets | 日本新薬 | 2190030F1029 | 810.9円/錠 | 処方箋医薬品注) |
1. 警告
本剤と硝酸剤又は一酸化窒素(NO)供与剤(ニトログリセリン、亜硝酸アミル、硝酸イソソルビド、ニコランジル等)との併用により降圧作用が増強し、過度に血圧を下降させることがあるので、本剤投与の前に、硝酸剤又は一酸化窒素(NO)供与剤が投与されていないことを十分確認し、本剤投与中及び投与後においても硝酸剤又は一酸化窒素(NO)供与剤が投与されないよう十分注意すること。[2.2、10.1参照]
ただし、肺動脈性肺高血圧症の治療において一酸化窒素吸入療法と本剤の併用が治療上必要と判断される場合は、緊急時に十分対応できる医療施設において、肺動脈性肺高血圧症の治療に十分な知識と経験を持つ医師のもとで、慎重に投与すること。
ただし、肺動脈性肺高血圧症の治療において一酸化窒素吸入療法と本剤の併用が治療上必要と判断される場合は、緊急時に十分対応できる医療施設において、肺動脈性肺高血圧症の治療に十分な知識と経験を持つ医師のもとで、慎重に投与すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 硝酸剤又は一酸化窒素(NO)供与剤(ニトログリセリン、亜硝酸アミル、硝酸イソソルビド、ニコランジル等)を投与中の患者[1.、10.1参照]
2.3 可溶性グアニル酸シクラーゼ(sGC)刺激剤(リオシグアト)を投与中の患者[10.1参照]
2.4 重度の腎障害のある患者[9.2.1参照]
2.5 重度の肝障害のある患者[9.3.1参照]
2.6 チトクロームP450 3A4(CYP3A4)を強く阻害する薬剤(イトラコナゾール、リトナビル含有製剤、アタザナビル、インジナビル、ネルフィナビル、サキナビル、ダルナビル含有製剤、クラリスロマイシン、テラプレビル、コビシスタット含有製剤、エンシトレルビル)を投与中の患者[10.1参照]
2.7 CYP3A4を強く誘導する薬剤(リファンピシン、フェニトイン、カルバマゼピン、フェノバルビタール)を長期的に投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
肺高血圧症に関するWHO機能分類クラスIにおける有効性・安全性は確立されていない。
6. 用法及び用量
通常、成人には1日1回タダラフィルとして40mgを経口投与する。
7. 用法及び用量に関連する注意
7.2 軽度又は中等度の肝障害のある患者では、本剤の投与経験は限られていることから、リスク・ベネフィットを考慮し、本剤を投与する際には1日1回20mgを投与する。
8. 重要な基本的注意
8.1 4時間以上の勃起の延長又は持続勃起(6時間以上持続する痛みを伴う勃起)が外国にてごくまれに報告されている。持続勃起に対する処置を速やかに行わないと陰茎組織の損傷又は勃起機能を永続的に損なうことがあるので、勃起が4時間以上持続する症状がみられた場合、直ちに医師の診断を受けるよう指導すること。
8.2 臨床試験において、めまいや視覚障害が認められているので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.3 本剤投与後に急激な視力低下又は急激な視力喪失があらわれた場合には、速やかに眼科専門医の診察を受けるよう、患者に指導すること。[15.1.2参照]
8.4 本剤投与後に急激な聴力低下又は突発性難聴(耳鳴り、めまいを伴うことがある)があらわれた場合には、速やかに耳鼻科専門医の診察を受けるよう、患者に指導すること。[15.1.4参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 脳梗塞・脳出血の既往歴が最近6ヵ月以内にある患者
これらの患者における安全性及び有効性は確立していない。
9.1.2 コントロール不良の不整脈、低血圧(血圧<90/50mmHg)又はコントロール不良の高血圧(安静時血圧>170/100mmHg)のある患者
これらの患者における安全性及び有効性は確立していない。
9.1.3 網膜色素変性症患者
ホスホジエステラーゼ(PDE)の遺伝的障害を持つ症例が少数認められる。
9.1.4 陰茎の構造上欠陥(屈曲、陰茎の線維化、Peyronie病等)のある患者
本剤の薬理作用により勃起が起こり、その結果陰茎に痛みを引き起こす可能性がある。
9.1.5 持続勃起症の素因となり得る疾患(鎌状赤血球性貧血、多発性骨髄腫、白血病等)のある患者
9.1.6 出血性疾患又は消化性潰瘍のある患者
in vitro試験でニトロプルシドナトリウム(NO供与剤)の血小板凝集抑制作用を増強することが認められている。出血性疾患又は消化性潰瘍のある患者に対する安全性は確立していない。
9.1.7 肺静脈閉塞性疾患を有する患者
本剤を投与しないことが望ましい。肺血管拡張剤は、肺静脈閉塞性疾患を有する患者の心血管系の状態を著しく悪化させるおそれがある。肺静脈閉塞性疾患を有する患者における有効性及び安全性は確立していない。
9.1.8 重症の左室流出路閉塞、体液減少、自律神経障害に伴う低血圧や安静時低血圧等を有する患者
他のPDE5阻害剤と同様に、本剤は血管拡張作用を有するため一過性の軽度の血圧低下があらわれる場合がある。
9.1.9 出血の危険因子(ビタミンK拮抗薬等の抗凝固療法、抗血小板療法、結合組織疾患に伴う血小板機能異常、経鼻酸素療法)を有する患者
出血の危険性が高まるおそれがある。[10.2参照]
9.2 腎機能障害患者
9.2.1 重度の腎障害患者
9.2.2 軽度又は中等度の腎障害患者
9.3 肝機能障害患者
9.3.1 重度の肝障害患者
投与しないこと。これらの患者は臨床試験では除外されている。[2.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。[16.6.3参照]
10. 相互作用
相互作用序文
本剤は主にCYP3A4により代謝される。
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| 硝酸剤及びNO供与剤 ニトログリセリン 亜硝酸アミル 硝酸イソソルビド ニコランジル等 [1.、2.2参照] | 併用により、降圧作用を増強するとの報告がある1)2)3)。 | NOはcGMPの産生を刺激し、一方、本剤はcGMPの分解を抑制することから、両剤の併用によりcGMPの増大を介するNOの降圧作用が増強する。 |
| sGC刺激剤 リオシグアト(アデムパス) [2.3参照] | 併用により、血圧低下を起こすおそれがある。 | 併用により、細胞内cGMP濃度が増加し、全身血圧に相加的な影響を及ぼすおそれがある。 |
| CYP3A4を強く阻害する薬剤 イトラコナゾール(イトリゾール) リトナビル含有製剤(ノービア、カレトラ、パキロビッド) アタザナビル(レイアタッツ) インジナビル(クリキシバン) ネルフィナビル(ビラセプト) サキナビル(インビラーゼ) ダルナビル含有製剤(プリジスタ、プレジコビックス) クラリスロマイシン(クラリス、クラリシッド) テラプレビル(テラビック) コビシスタット含有製剤(スタリビルド、ゲンボイヤ、プレジコビックス) エンシトレルビル(ゾコーバ) [2.6、16.7.1、16.7.2参照] | 強いCYP3A4阻害作用を有するケトコナゾール(400mg/日:経口剤、国内未発売)との併用により、本剤(20mg)のAUC及びCmaxが312%及び22%増加するとの報告がある4)。また、リトナビル(200mg/1日2回投与)との併用により、本剤(20mg)のAUCが124%増加するとの報告がある4)。 | CYP3A4を強く阻害することによりクリアランスが高度に減少し、本剤の血漿中濃度が上昇するおそれがある。また、臨床試験では除外されている。 |
| CYP3A4を強く誘導する薬剤 リファンピシン(リファジン) フェニトイン(アレビアチン、ヒダントール) カルバマゼピン(テグレトール) フェノバルビタール(フェノバール) [2.7参照] | リファンピシン(600mg/日)との併用により、本剤(10mg)のAUC及びCmaxがそれぞれ88%及び46%低下するとの報告がある5)。 | CYP3A4誘導によるクリアランスの増加により本剤の血漿中濃度が低下し、本剤の効果が減弱するおそれがある。 |
10.2 併用注意
| CYP3A4を阻害する薬剤 ホスアンプレナビル ジルチアゼム エリスロマイシン フルコナゾール ベラパミル グレープフルーツジュース等 | 本剤のAUC及びCmaxが増加するおそれがある。 | CYP3A4阻害によるクリアランスの減少。 |
| CYP3A4を誘導する薬剤 | 本剤のAUC及びCmaxが低下するおそれがある。 | CYP3A4誘導によるクリアランスの増加。 |
| ボセンタン [16.7.3参照] | ボセンタン(125mg/1日2回投与)との10日間併用により、本剤(40mg)の10日目におけるAUC及びCmaxが初日と比べてそれぞれ41.5%及び26.6%低下するとの報告がある6)。本剤によるボセンタンのAUC及びCmaxに対する影響はみられなかった。 | CYP3A4誘導によるクリアランスの増加により本剤の血漿中濃度が低下する。 |
| α遮断剤 ドキサゾシン テラゾシン等 [16.7.5(1)参照] | ドキサゾシン(8mg)と本剤(20mg)の併用により、立位収縮期血圧及び拡張期血圧は最大それぞれ9.81mmHg及び5.33mmHg下降するとの報告がある7)。また、α遮断剤との併用で失神等の症状を伴う血圧低下を来したとの報告がある。 | 本剤は血管拡張作用による降圧作用を有するため、併用により降圧作用を増強するおそれがある。 |
| 降圧剤 アムロジピン メトプロロール エナラプリル カンデサルタン等 | アンジオテンシンII受容体拮抗剤(単剤又は多剤)と本剤(20mg)の併用により、自由行動下収縮期血圧及び拡張期血圧は最大それぞれ8mmHg及び4mmHg下降するとの報告がある8)。 | 本剤は血管拡張作用による降圧作用を有するため、併用により降圧作用を増強するおそれがある。 |
| カルペリチド | 併用により降圧作用が増強するおそれがある。 | 本剤は血管拡張作用による降圧作用を有するため、併用により降圧作用を増強するおそれがある。 |
| ビタミンK拮抗薬 ワルファリン [9.1.9参照] | 本剤(10及び20mg/日)との併用において、ワルファリン(25mg)の薬物動態及び抗凝固作用に対する影響は認められなかった9)10)が、併用により出血の危険性が高まるおそれがある。 | ビタミンK拮抗薬等の抗凝固療法を施行している患者では出血の危険性が高まるおそれがある。 |
| ベルイシグアト | 症候性低血圧を起こすおそれがある。治療上の有益性と危険性を十分に考慮し、治療上やむを得ないと判断された場合にのみ併用すること。 | 細胞内cGMP濃度が増加し、降圧作用を増強するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 過敏症(頻度不明)
発疹、蕁麻疹、顔面浮腫、剥脱性皮膚炎、Stevens-Johnson症候群等があらわれることがある。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 循環器 | 潮紅 | ほてり、低血圧 | 失神 | 動悸、胸痛、心不全、心筋梗塞注1)心突然死注1)、頻脈、高血圧、レイノー現象、血腫 |
| 感覚器 | 霧視 | 眼充血、眼痛、結膜出血、視力低下、眼の異常感 | 回転性めまい、眼乾燥、非動脈炎性前部虚血性視神経症注2)、網膜静脈閉塞、視野欠損、視覚障害、中心性漿液性脈絡網膜症 | |
| 消化器 | 悪心、消化不良 | 下痢、胃食道逆流性疾患、嘔吐、上腹部痛、腹部不快感、胃炎 | 鼓腸 | 腹部膨満、腹痛、胃不快感、口内乾燥 |
| 肝臓 | AST増加 | |||
| 筋骨格 | 筋痛、背部痛 | 四肢痛、筋痙縮、関節痛、筋骨格硬直 | 関節炎、四肢不快感 | |
| 精神・神経系 | 頭痛 | 浮動性めまい、睡眠障害 | うつ病、下肢静止不能症候群、感覚鈍麻、錯感覚、片頭痛 | 脳卒中注1) |
| 泌尿・生殖器 | 月経過多 | 持続勃起症、勃起延長 | ||
| 呼吸器 | 鼻閉、鼻出血、呼吸困難 | 副鼻腔うっ血 | ||
| 皮膚 | 発疹 | そう痒症 | 多汗症 | |
| 血液 | 貧血、INR増加 | |||
| その他 | 末梢性浮腫、疲労、挫傷、疼痛 | 顔面浮腫、貪食細胞性組織球症 | 体重増加、食欲不振、腫脹、浮腫 |
13. 過量投与
13.1 処置
特異的な解毒薬はない。なお、腎透析によるクリアランスの促進は期待できない。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 勃起不全治療剤として使用されたタダラフィルの市販後の自発報告において、心筋梗塞、心突然死、心室性不整脈、脳出血、一過性脳虚血発作等の重篤な心血管系障害がタダラフィル投与後に発現している。これらの多くが心血管系のリスクファクターを有している患者であった。多くの事象が、性行為中又は性行為後に認められ、少数例ではあるが、性行為なしにタダラフィル投与後に認められたものもあった。その他は、タダラフィルを投与し性行為後の数時間から数日後に報告されている。これらの症例について、タダラフィル、性行為、本来患者が有していた心血管系障害、これらの要因の組合せ又は他の要因に直接関連するかどうかを確定することはできない。
15.1.2 薬剤との因果関係は明らかではないが、外国において男性勃起不全治療剤として使用されたタダラフィルを含むPDE5阻害剤投与後に、まれに視力低下や視力喪失の原因となりうる非動脈炎性前部虚血性視神経症(NAION)の発現が報告されている11)。これらの患者の多くは、NAIONの危険因子[年齢(50歳以上)、糖尿病、高血圧、冠動脈障害、高脂血症、喫煙等]を有していた12)。
外国において、NAIONを発現した45歳以上の男性(肺動脈性肺高血圧症に使用された症例は除く)を対象として実施された自己対照研究では、PDE5阻害剤の投与から消失半減期(T1/2)の5倍の期間内(タダラフィルの場合約4日以内に相当)は、NAION発現リスクが約2倍になることが報告されている13)。[8.3、11.2参照]
外国において、NAIONを発現した45歳以上の男性(肺動脈性肺高血圧症に使用された症例は除く)を対象として実施された自己対照研究では、PDE5阻害剤の投与から消失半減期(T1/2)の5倍の期間内(タダラフィルの場合約4日以内に相当)は、NAION発現リスクが約2倍になることが報告されている13)。[8.3、11.2参照]
15.1.4 薬剤との因果関係は明らかではないが、外国において本剤を含むPDE5阻害剤投与後に、まれに、急激な聴力低下又は突発性難聴が報告されている。これらの患者では、耳鳴りやめまいを伴うことがある。[8.4参照]
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
日本人健康成人にタダラフィル20mg注1)(18例)又は40mg(18例)を1日1回10日間反復経口投与したときのタダラフィルの血漿中濃度は、投与日に関係なく投与後1〜4時間(Tmaxの中央値=3時間)にピークに達した。また、タダラフィルの血漿中濃度は、反復投与5日目までに定常状態に達した20)21)。血漿中濃度の消失半減期は約14〜15時間であった。タダラフィル20mg注1)又は40mgを投与したときのAUC及びCmaxの増加は、投与量に比例した増加割合より低かった。定常状態でのタダラフィルのAUC及びCmaxは、初回投与時と比べて20mg注1)及び40mgでそれぞれ約40%及び約30%増加した。[16.1.2参照]
注1)承認用量は40mgである。
| 投与量(mg) | 日数 | n | AUC(μg・h/L)注2) | Cmax(μg/L) | Tmax(h)注3) | T1/2(h) |
| 20 | 1日目 | 18 | 4478(14.9) | 339(16.3) | 3.00(1.00〜4.00) | − |
| 10日目 | 17 | 6430(18.7) | 461(18.4) | 3.00(2.00〜4.00) | 14.5(17.9) | |
| 40 | 1日目 | 18 | 7570(24.5) | 557(19.0) | 3.00(2.00〜4.00) | − |
| 5日目 | 15 | 10300(23.8) | 732(19.3) | 3.00(2.00〜4.00) | − | |
| 10日目 | 15 | 9630(20.5) | 688(16.1) | 3.00(2.00〜4.00) | 14.3(12.1) |
図1)健康成人にタダラフィル20mg注1)又は40mgを1日1回10日間反復投与したときの血漿中タダラフィル濃度推移(平均値±標準誤差)
16.1.2 母集団薬物動態解析
プラセボ対照二重盲検比較試験における母集団薬物動態解析の結果、肺動脈性肺高血圧症患者注4)に40mgを1日1回反復経口投与(ボセンタン非併用時)したときのAUCssの推定値は、外国人健康成人の値と比べて約26%高値であったが、Cmaxに顕著な差はなかった22)。健康成人と同様に患者でもタダラフィル20mg注1)又は40mgを投与したときのAUC及びCmaxの増加は、投与量に比例した増加割合より低かった。[16.1.1参照]また、タダラフィルとボセンタンを併用投与すると、タダラフィルの曝露量が低下した。[16.7.3参照]
注4)肺動脈性肺高血圧症患者389例、日本人患者22例を含む。
| 投与量(mg) | タダラフィルの曝露量[AUCss(μg・h/L)注5)] | |
| タダラフィル単独投与 | タダラフィル+ボセンタン併用投与 | |
| 20 | 11524.5(6179.6-15449.0) | 6874.60(4390.0-10595.0) |
| 40 | 14825.5(10017.0-26792.0) | 9600.0(5906.3-17306.0) |
16.2 吸収
16.2.1 食事の影響
健康成人15例にタダラフィル40mgを食後(高脂肪食)又は空腹時に単回経口投与したとき、AUC0-∞及びCmax共に食事摂取による影響は認められなかった。また、Tmaxは食後投与と空腹時投与で同程度であった23)(外国人データ)。
16.3 分布
16.4 代謝
健康成人6例に14C-タダラフィル100mg注1)を単回経口投与したとき、血漿中には主にタダラフィル未変化体及びメチルカテコールグルクロン酸抱合体が認められた。血漿中のメチルカテコール体はメチルカテコールグルクロン酸抱合体の10%未満であった26)(外国人データ)。
16.5 排泄
健康成人6例に14C-タダラフィル100mg注1)を単回経口投与したときの、投与後312時間までの放射能回収率は糞便中60.5%、尿中36.1%であった。糞便中には主にメチルカテコール体、カテコール体、尿中には主にメチルカテコールグルクロン酸抱合体及びカテコールグルクロン酸抱合体が認められた27)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎障害患者
(1)軽度及び中等度腎障害患者
(2)血液透析を受けている末期腎不全患者
16.6.2 肝障害患者
健康成人8例及び肝障害患者25例注6)にタダラフィル10mg注1)を単回経口投与したとき、軽度肝障害患者(Child-Pugh class A)と中等度肝障害患者(Child-Pugh class B)のAUC0-∞は健康成人とほぼ同様であった28)(外国人データ)。
注6)軽微肝障害(脂肪肝が認められた患者)、n=8:軽度肝障害(Child-Pugh class A)、n=8:中等度肝障害(Child-Pugh class B)、n=8:重度肝障害(Child-Pugh class C)、n=1。
16.6.3 高齢者
健康高齢者12例(65〜78歳)及び健康若年者12例(19〜45歳)にタダラフィル10mg注1)を単回経口投与したとき、Cmaxは高齢者と若年者とでほぼ同様であったが、高齢者のAUC0-∞は若年者に比べ約25%高値であった28)(外国人データ)。[9.8参照]
| n | AUC0-∞(μg・h/L) | Cmax(μg/L) | Tmax(h)注7) | T1/2(h) | |
| 高齢者 | 12 | 4881(31.7) | 196(26.9) | 2.00(1.00〜4.00) | 21.6(39.0) |
| 若年者 | 12 | 3896(42.6) | 183(25.5) | 2.50(1.00〜6.00) | 16.9(29.1) |
16.7 薬物相互作用
16.7.1 経口ケトコナゾール
健康成人12例にケトコナゾール400mg(1日1回経口投与、国内未発売)とタダラフィル20mg注1)を併用投与したとき、タダラフィルのAUC0-∞及びCmaxは、それぞれ312%及び22%増加した4)(外国人データ)。
16.7.2 リトナビル
健康成人16例にリトナビル500mg又は600mg(1日2回)とタダラフィル20mg注1)を併用投与したとき、タダラフィルのCmaxは30%低下したが、AUC0-∞は32%増加した29)(外国人データ)。
16.7.3 ボセンタン
16.7.4 ジゴキシン
健康成人20例にジゴキシン0.25mgを1日1回反復経口投与時の定常状態で、タダラフィル40mgを1日1回10日間反復経口投与した結果、本剤によるジゴキシンのAUC、Cmax及びCminに対する明らかな影響は認められなかった30)(外国人データ)。
16.7.5 α遮断剤
(1)ドキサゾシン
健康成人18例にドキサゾシン8mgを反復経口投与時の定常状態で、タダラフィル20mg注1)を単回経口投与したとき、立位の収縮期及び拡張期血圧の最大下降量はそれぞれ9.81mmHg及び5.33mmHg、臥位の収縮期及び拡張期血圧の最大下降量はそれぞれ3.64mmHg及び2.78mmHgであった7)(外国人データ)。
健康成人45例にドキサゾシン(4mgまで漸増)とタダラフィル5mg注1)を1日1回反復経口投与したとき、ドキサゾシンの血圧降下作用に増強がみられた。この試験において、失神等の症状を伴う血圧変化に関する有害事象がみられた(外国人データ)。[10.2参照]
(2)タムスロシン
16.7.6 経口避妊薬
健康成人26例に経口避妊薬(エチニルエストラジオール0.03mg及びレボノルゲストレル0.15mg含有製剤)とタダラフィル40mgを21日間併用投与した結果、エチニルエストラジオールのAUC及びCmaxは、経口避妊薬とプラセボを併用投与したときの値と比べてそれぞれ26%及び70%増加した。タダラフィル併用投与時とプラセボ併用投与時でレボノルゲストレルの血漿中濃度に統計学的に有意な差は認められなかった32)(外国人データ)。
16.7.7 その他の薬剤
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第III相試験
肺動脈性肺高血圧症患者(405例、日本人患者26例を含む)を対象に本剤2.5mg、10mg、20mg注1)、40mg又はプラセボのいずれかを1日1回投与する18週間(16週間の投与期間)の多施設共同無作為化プラセボ対照二重盲検比較試験を実施した。その結果、運動耐容能を評価する6分間歩行距離の投与開始前から16週後の変化量において、本剤40mg群はプラセボ群に比べて統計学的に有意に改善した(p=0.0004)。臨床症状の悪化(死亡、肺移植、心房中隔裂開術、肺動脈性肺高血圧症悪化による入院、肺動脈性肺高血圧症に対する新たな治療の開始又はWHO機能分類の悪化を臨床症状の悪化と定義した)が認められた被験者数はプラセボ群で13例(15.9%)に対し、本剤40mg群で4例(5.1%)であった。また、本剤40mg群は、一部の被験者で測定された肺血行動態パラメータの平均肺動脈圧、肺血管抵抗係数、心係数及び心拍出量において、投与開始前と比べ改善が認められた。
なお、本試験ではQOLを評価するため、8項目の健康概念[身体機能、日常役割機能(身体)、身体の痛み、全体的健康感、活力、社会生活機能、日常役割機能(精神)、心の健康]からなるSF-36v2健康調査票、及び5つの質問(移動の程度、身の回りの管理、ふだんの活動、痛み/不快感、不安/ふさぎ込み)と健康状態のQOLを判定するためのビジュアルアナログスケール(VAS)からなるEuroQol質問票を使用した。本剤40mg群は、SF-36v2健康調査票の6項目[身体機能、日常役割機能(身体)、身体の痛み、全体的健康感、活力、社会生活機能]において、またEuroQol質問票の効用値[Index Score(US)及びIndex Score(UK)]及びVASにおいて、プラセボ群に比べ統計学的に有意な改善が認められた(p<0.05)37)。
なお、本試験ではQOLを評価するため、8項目の健康概念[身体機能、日常役割機能(身体)、身体の痛み、全体的健康感、活力、社会生活機能、日常役割機能(精神)、心の健康]からなるSF-36v2健康調査票、及び5つの質問(移動の程度、身の回りの管理、ふだんの活動、痛み/不快感、不安/ふさぎ込み)と健康状態のQOLを判定するためのビジュアルアナログスケール(VAS)からなるEuroQol質問票を使用した。本剤40mg群は、SF-36v2健康調査票の6項目[身体機能、日常役割機能(身体)、身体の痛み、全体的健康感、活力、社会生活機能]において、またEuroQol質問票の効用値[Index Score(US)及びIndex Score(UK)]及びVASにおいて、プラセボ群に比べ統計学的に有意な改善が認められた(p<0.05)37)。
注1)承認用量は40mgである。
| 評価項目 | 統計量 | プラセボ群 | タダラフィル40mg群 |
| 6分間歩行距離(m) | 平均値 (95%信頼区間) [症例数] | 9.21 (−4.22〜22.65) [79] | 41.14 (29.85〜52.42) [76] |
| 平均肺動脈圧(mmHg) | 平均値 (95%信頼区間) [症例数] | −2.21 (−7.24〜2.82) [14] | −4.27 (−7.53〜−1.01) [15] |
| 肺血管抵抗係数(dyne・sec/cm5/m2) | 平均値 (95%信頼区間) [症例数] | 4.13 (−101.22〜109.48) [12] | −117.05 (−244.79〜10.68) [14] |
| 心係数(L/min/m2) | 平均値 (95%信頼区間) [症例数] | −0.01 (−0.44〜0.41) [12] | 0.36 (0.09〜0.63) [14] |
| 平均動脈圧(mmHg) | 平均値 (95%信頼区間) [症例数] | −5.00 (−13.74〜3.74) [14] | −2.00 (−9.64〜5.64) [15] |
本試験では、エンドセリン受容体拮抗剤であるボセンタンとの併用による影響を評価するため、ボセンタン治療の有無別に6分間歩行距離の変化量の部分集団解析を実施した(ボセンタン併用被験者:53.3%)。その結果、本剤40mg群ではボセンタン非併用被験者のみプラセボ群に比べ統計学的に有意な改善が認められた。
| 評価項目 | 統計量 | プラセボ群 | タダラフィル40mg群 |
| 6分間歩行距離(m) [ボセンタン非併用] | 平均値 (95%信頼区間) [症例数] | −2.89 (−22.84〜17.06) [35] | 42.18 (26.67〜57.69) [37] |
| 6分間歩行距離(m) [ボセンタン併用] | 平均値 (95%信頼区間) [症例数] | 18.84 (0.50〜37.19) [44] | 40.15 (23.11〜57.19) [39] |
本剤20mg注1)群又は40mg群に割り付けられた総症例161例中98例(60.9%)に副作用が認められた。主な副作用は頭痛(33.5%)、潮紅(8.7%)、筋肉痛(7.5%)、背部痛(6.8%)等であった。
17.1.2 国際共同第III相試験(長期継続試験)
先行するプラセボ対照二重盲検比較試験に参加した肺動脈性肺高血圧症患者(357例、日本人患者22例を含む)を対象に本剤20mg注1)又は40mgを1日1回投与する52週間の長期継続試験を実施した。その結果、プラセボ対照二重盲検比較試験で認められた本剤40mg投与による6分間歩行距離の改善は、52週後においても維持されていることが示された。
| 統計量 | タダラフィル40mg群 | ||||
| 投与前 | 16週後 | 28週後 | 40週後 | 52週後 | |
| 平均値 (95%信頼区間) [症例数] | 403.31 (383.08〜423.54) [69]注2) | 404.24 (382.95〜425.52) [66] | 404.32 (381.93〜426.71) [61] | 404.90 (382.85〜426.95) [60] | 410.01 (389.74〜430.28) [59] |
本剤群に割り付けられた総症例357例(日本人患者22例を含む)中176例(49.3%)に副作用が認められた。主な副作用は頭痛(15.1%)、潮紅(5.6%)、浮動性めまい(5.0%)等であった。
18. 薬効薬理
18.1 作用機序
肺血管平滑筋における主要なcGMP分解酵素であるPDE5を選択的に阻害することにより、肺組織中のcGMPを有意に増加させ血管弛緩反応を発現する38)(ex vivo)。
18.2 PDE5阻害作用
タダラフィルは選択的PDE5阻害剤である。ヒト遺伝子組み換えPDE5を約1nMのIC50値で阻害し、PDE6及びPDE11と比較するとそれぞれ700及び14倍、その他のPDEサブタイプと比較すると9000倍以上の選択性を示した39)(in vitro)。
18.3 肺高血圧症モデルに対する作用
19. 有効成分に関する理化学的知見
19.1. タダラフィル
22. 包装
60錠[10錠(PTP)×6]
23. 主要文献
- Kloner RA,et al., Am J Cardiol., 92 (Suppl), 37M-46M, (2003)
- Patterson D,et al., Br J Clin Pharmacol., 60 (5), 459-468, (2005) »PubMed »DOI
- Kloner RA,et al., J Am Coll Cardiol., 42 (10), 1855-1860, (2003) »PubMed »DOI
- 社内資料:リトナビル及びケトコナゾールとの薬物相互作用(2007年7月31日承認、CTD2.7.2.2.2.3.2)
- 社内資料:リファンピシン及びケトコナゾールとの薬物相互作用(2007年7月31日承認、CTD2.7.2.2.2.3.1)
- 社内資料:ボセンタンとの薬物相互作用(2009年10月16日承認、CTD2.7.2.2.2.3)
- Kloner RA,et al., J Urol., 172 (5 Pt 1), 1935-1940, (2004) »PubMed »DOI
- Kloner RA,et al., Am J Cardiol., 92 (suppl), 47M-57M, (2003)
- 社内資料:ワルファリンとの薬物相互作用(タダラフィル10mg)(2007年7月31日承認、CTD2.7.2.2.2.3.6)
- 社内資料:ワルファリンとの薬物相互作用(タダラフィル20mg)(2007年7月31日承認、CTD2.7.2.2.2.3.6)
- Pomeranz HD,et al., J Neuroophthalmol., 25 (1), 9-13, (2005) »PubMed »DOI
- Lee AG,et al., Am J Ophthalmol., 140 (4), 707-708, (2005) »PubMed
- Campbell UB,et al., J Sex Med., 12 (1), 139-151, (2015) »PubMed
- Gilad R,et al., BMJ., 325 (7369), 869, (2002) »PubMed
- Striano P,et al., BMJ., 333 (7572), 785, (2006) »PubMed
- 社内資料:アルコールとの薬物相互作用(タダラフィル10mg)(2007年7月31日承認、CTD2.7.2.2.2.3.9、CTD2.7.2.2.2.4.7)
- 社内資料:アルコールとの薬物相互作用(タダラフィル20mg)(2007年7月31日承認、CTD2.7.2.2.2.3.9、CTD2.7.2.2.2.4.7)
- Hellstrom WJG,et al., J Urol., 170 (3), 887-891, (2003) »PubMed
- 社内資料:精液特性に及ぼす影響(2007年7月31日承認、CTD2.7.4.4.3)
- 社内資料:健康成人における反復投与時薬物動態(タダラフィル20mg)(2007年7月31日承認、CTD2.7.2.2.2.1.2)
- 社内資料:健康成人における反復投与時薬物動態(タダラフィル40mg)(2009年10月16日承認、CTD2.7.2.2.2.1)
- 社内資料:肺動脈性肺高血圧症患者における母集団薬物動態解析(2009年10月16日承認、CTD2.7.2.2.2.5)
- 社内資料:食事の影響(2009年10月16日承認、CTD2.7.6.2.1)
- 社内資料:蛋白結合(in vitro;ラット、イヌ及びヒト血漿)(2007年7月31日承認、CTD2.6.4.4.3)
- 社内資料:蛋白結合(in vitro;ヒト血漿蛋白)(2007年7月31日承認、CTD2.7.2.2.1.1)
- 社内資料:放射性標識体投与時の薬物動態(代謝)(2007年7月31日承認、CTD2.7.2.3.1.3)
- 社内資料:放射性標識体投与時の薬物動態(排泄)(2007年7月31日承認、CTD2.7.2.3.1.4)
- Forgue ST,et al., Br J Clin Pharmacol., 63 (1), 24-35, (2007) »PubMed
- 社内資料:リトナビルとの薬物相互作用(2007年7月31日承認、CTD2.7.2.2.2.3.3)
- 社内資料:ジゴキシンとの薬物相互作用(2009年10月16日承認、CTD2.7.2.2.2.4)
- 社内資料:タムスロシンとの薬物相互作用(2009年10月16日承認、CTD2.7.2.1.1.2.5.3)
- 社内資料:経口避妊薬との薬物相互作用(2009年10月16日承認、CTD2.7.2.2.2.2、CTD2.7.2.2.2.4)
- 社内資料:制酸剤及びH2受容体拮抗剤との薬物相互作用(2007年7月31日承認、CTD2.7.2.2.2.3.8)
- 社内資料:ミダゾラムとの薬物相互作用(2007年7月31日承認、CTD2.7.2.2.2.3.5)
- 社内資料:テオフィリンとの薬物相互作用(2007年7月31日承認、CTD2.7.2.2.2.3.7)
- 社内資料:アムロジピンとの薬物相互作用(2007年7月31日承認、CTD2.7.2.2.2.3.10)
- 社内資料:肺動脈性肺高血圧症患者における第III相試験(2009年10月16日承認、CTD2.7.3.2)
- Sawamura F,et al., Eur.Heart J., 29 (Suppl 1), 561, (2008)
- Saenz de Tejada I,et al., Int J Impot Res., 14 (Suppl 4), S20, (2002)
24. 文献請求先及び問い合わせ先
文献請求先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
製品情報問い合わせ先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
25. 保険給付上の注意
25.1 本製剤の効能又は効果は、「肺動脈性肺高血圧症」であること。
25.2 本製剤が「勃起不全」の治療目的で処方された場合には、保険給付の対象としないこととする。
26. 製造販売業者等
26.1 製造販売元
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14