医薬品情報
| 総称名 | ラタノプロスト |
|---|---|
| 一般名 | ラタノプロスト |
| 欧文一般名 | Latanoprost |
| 製剤名 | ラタノプロスト点眼液 |
| 薬効分類名 | プロスタグランジンF2α誘導体 緑内障・高眼圧症治療剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01EE01 |
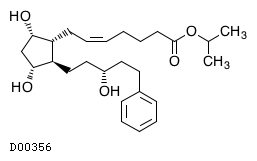
| KEGG DRUG |
D00356
ラタノプロスト
|
| KEGG DGROUP |
DG03201
眼圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年3月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ラタノプロスト点眼液0.005%「TS」 (後発品) | LATANOPROST Ophthalmic Solution 0.005%「TS」 | テイカ製薬 | 1319739Q1088 | 151円/mL | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
緑内障、高眼圧症
6. 用法及び用量
1回1滴、1日1回点眼する。
7. 用法及び用量に関連する注意
頻回投与により眼圧下降作用が減弱する可能性があるので、1日1回を超えて投与しないこと。
8. 重要な基本的注意
8.1 本剤の投与により、虹彩色素沈着(メラニンの増加)があらわれることがある。投与に際しては虹彩色素沈着及び色調変化について患者に十分説明しておくこと。この色素沈着は投与により徐々に増加し、投与中止により停止するが、投与中止後消失しないことが報告されている。また、虹彩色素沈着による色調変化があらわれる可能性があり、特に片眼治療の場合、左右眼で虹彩の色調に差が生じる可能性がある。褐色を基調とする虹彩の患者において、虹彩色素沈着が多く報告されているが、虹彩の変色が軽度であり、臨床所見によって発見されないことが多い。[11.1.1参照]
8.2 本剤投与中に角膜上皮障害(点状表層角膜炎、糸状角膜炎、角膜びらん)があらわれることがあるので、しみる、そう痒感、眼痛等の自覚症状が持続する場合には、直ちに受診するよう患者に十分指導すること。
8.3 本剤の点眼後、一時的に霧視があらわれることがあるため、症状が回復するまで機械類の操作や自動車等の運転には従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 無水晶体眼又は眼内レンズ挿入眼の患者
嚢胞様黄斑浮腫を含む黄斑浮腫、及びそれに伴う視力低下を起こすとの報告がある。
9.1.2 気管支喘息又はその既往歴のある患者
喘息発作を悪化又は誘発するおそれがある。[15.2参照]
9.1.3 眼内炎(虹彩炎、ぶどう膜炎)のある患者
眼圧上昇がみられたことがある。
9.1.4 ヘルペスウイルスが潜在している可能性のある患者
角膜ヘルペスがみられたことがある。
9.1.5 閉塞隅角緑内障患者
使用経験が少ない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(妊娠ウサギ)における器官形成期投与試験において、臨床用量の約80倍量(5.0μg/kg/日)を静脈内投与したことにより、流産及び後期吸収胚の発現率増加、胎児体重の減少が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット:静脈内投与)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした国内臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 虹彩色素沈着(2.37%注))
患者を定期的に診察し、虹彩色素沈着があらわれた場合には臨床状態に応じて投与を中止すること。[8.1参照]
注)使用成績調査を含む
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 眼 結膜 | 結膜充血 | 結膜炎、眼脂、結膜濾胞 | 偽眼類天疱瘡 |
| 眼 ぶどう膜 | ぶどう膜炎、虹彩炎 | 虹彩嚢腫 | |
| 眼 角膜 | 角膜上皮障害、点状表層角膜炎、糸状角膜炎、角膜びらん、角膜浮腫 | ヘルペス性角膜炎、角膜沈着物、角膜混濁、潰瘍性角膜炎 | |
| 眼 眼瞼 | 眼瞼色素沈着、眼瞼炎、眼瞼部多毛、眼瞼浮腫、眼瞼発赤 | 眼瞼溝深化 | |
| 眼 その他 | しみる等の眼刺激症状、そう痒感、眼痛、霧視、前房細胞析出、流涙、睫毛の異常(睫毛が濃く、太く、長くなる)、異物感等の眼の異常感 | 嚢胞様黄斑浮腫を含む黄斑浮腫、及びそれに伴う視力低下、接触性皮膚炎、羞明 | |
| 循環器 | 動悸、狭心症 | ||
| その他 | 頭痛、そう痒感、咽頭違和感、嘔気、めまい、胸痛 | 喘息、筋肉痛、関節痛、発疹 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜のう内に点眼し、1〜5分間閉瞼して涙のう部を圧迫させた後、開瞼すること。
・点眼のとき、液が眼瞼皮膚等についた場合には、すぐにふき取ること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・ベンザルコニウム塩化物によりコンタクトレンズを変色させることがあるので、コンタクトレンズを装用している場合は、点眼前にレンズを外し、15分以上経過後に再装用すること。
15. その他の注意
15.1 臨床使用に基づく情報
外国において、眼局所有害事象として、網膜動脈閉塞、網膜剥離、糖尿病性網膜症に伴う硝子体出血、全身有害事象として、上気道感染症、感冒、インフルエンザ、筋肉痛、関節痛、腰痛、胸痛、狭心症、皮疹、アレルギー性皮膚反応があらわれたとの報告がある。
15.2 非臨床試験に基づく情報
ラタノプロストをサルに静脈内投与(2μg/kg)すると一過性の気道抵抗の増加が起こった。しかし、臨床用量(1.5μg/眼)の7倍量のラタノプロストを中等度の気管支喘息患者11例に点眼した場合、肺機能に影響はなかったとの報告がある。[9.1.2参照]
16. 薬物動態
16.1 血中濃度
健康成人(外国人)に0.005%3H-ラタノプロスト点眼液30μLを両眼に点眼したとき、活性代謝物であるラタノプロスト遊離酸の血漿中濃度は、投与後5分に最高濃度53pg/mLに達し、その後消失半減期17分で消失した3)。
16.3 分布
16.3.1 房水中濃度
白内障手術を受ける患者(外国人)に0.005%ラタノプロスト点眼液30μLを片眼に点眼したとき、ラタノプロスト遊離酸の房水中濃度は、投与後約2.5時間に最高濃度32.6ng/mLに達し、投与後24時間後には0.2ng/mL以下に低下した3)。
16.3.2 眼組織移行
雌雄カニクイザルに0.0183%3H-ラタノプロスト点眼液26μLを単回点眼投与したとき、眼組織内放射能濃度は常に角膜で最も高く、次いで、虹彩、前房及び毛様体の順に高かった。結膜及び前部強膜においても高濃度の放射能が検出された。角膜では、実質層よりも上皮組織で高濃度の放射能が認められた。網膜では放射能は検出されなかった。角膜における放射能は最初の測定時点である0.5時間に最高濃度を示し、消失半減期4時間で消失した4)。
16.5 排泄
健康成人(外国人)に0.005%3H-ラタノプロスト点眼液30μLを両眼に点眼したとき、放射能の大部分が尿中に排泄され(88%)、残りは糞中に排泄された。尿中には投与後24時間以内に、糞中には投与後2日から3日に主に排泄された3)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
全国35施設で実施された二重遮蔽試験において、原発開放隅角緑内障及び高眼圧症に対する改善率は、87.5%(70/80)であった5)。
18. 薬効薬理
18.1 作用機序
18.2 ぶどう膜強膜流出促進作用
18.2.1 サルのラタノプロスト点眼後の房水動態をconstant pressure infusion法及び125I、131I標識アルブミン灌流法により検討したところ、ぶどう膜強膜流出量は有意に増大した6)。
18.2.2 健康成人にラタノプロスト点眼液を投与後、フルオロフォトメトリーにより房水動態を検討したところ、ぶどう膜強膜流出量の増加が認められた7)。
18.3 眼圧下降作用
18.3.1 サルに対するラタノプロストの単回点眼では、点眼後4〜6時間に用量依存性の眼圧低下が認められた。同じくサルに対する5ないし6日間の反復点眼では、点眼期間中安定した眼圧下降が持続し、作用の減弱は認められなかった8)。
18.4 生物学的同等性試験
本剤とキサラタン点眼液0.005%を健康成人男子にそれぞれ1滴両眼の結膜嚢内に点眼し、無投与群を含む3群(クロスオーバー法)の眼圧値を測定した。本剤及びキサラタン点眼液0.005%において各測定時点の眼圧値及び得られたパラメータ(眼圧下降−時間曲線下面積、最大眼圧差)を用いて統計解析を行った結果、両剤の生物学的同等性が確認された。なお、各パラメータは同測定時点における無投与群の測定値との差を用いて算出した14)15)。
| 眼圧下降−時間曲線下面積(mmHg・hr) | 最大眼圧差(mmHg) | |
| 本剤 | 39.3±26.8 | 3.4±1.0 |
| キサラタン点眼液0.005% | 37.3±28.5 | 3.5±1.2 |
眼圧値ならびに眼圧下降−時間曲線下面積、最大眼圧差のパラメータは、被験者の選択、眼圧の測定回数・時間等の試験条件によって異なる可能性がある。
19. 有効成分に関する理化学的知見
19.1. ラタノプロスト
20. 取扱い上の注意
20.1 外箱開封後は遮光して保存すること。
20.2 開栓後4週間経過した場合は、残液を使用しないこと。
22. 包装
プラスチック点眼容器
2.5mL×5本、2.5mL×10本
23. 主要文献
- Stewart,WC.et al., Am J Ophthalmol., 131, 339-344, (2001) »PubMed
- Herndon,LW.et al., Arch Ophthalmol., 120, 847-849, (2002) »PubMed
- Sjoquist,B.et al., Surv Ophthalmol., 47, S6-S12, (2002)
- Sjoquist,B.et al., Arzneimittelforschung., 49, 240-249, (1999) »PubMed
- 三嶋弘他, 眼科臨床医報, 90, 607-615, (1996)
- Stjernschantz,J.et al., Adv Prostaglandin Thromboxane Leukot Res., 23, 513-518, (1995) »PubMed
- 高松倫也他, 新薬と臨床, 45 (1), 76-82, (1996)
- 眼圧下降作用(ザラカム配合点眼液:2010年1月20日承認、申請資料概要2.6.2.2)
- 三嶋弘他, 基礎と臨床, 29 (16), 4271-4285, (1995)
- 三嶋弘他, 眼科臨床医報, 90 (4), 465-469, (1996)
- 三嶋弘他, 基礎と臨床, 29 (16), 4071-4084, (1995)
- 三嶋弘他, 基礎と臨床, 29 (16), 4085-4099, (1995)
- 三嶋弘他, 眼科臨床医報, 90 (3), 312-316, (1996)
- 竹内譲他, 新薬と臨牀, 59 (4), 686-695, (2010)
- 社内資料:生物学的同等性に関する資料
24. 文献請求先及び問い合わせ先
文献請求先
テイカ製薬株式会社
学術グループ
〒930-0982
富山市荒川一丁目3番27号
電話:076-431-1717
FAX:076-431-6707
製品情報問い合わせ先
テイカ製薬株式会社
学術グループ
〒930-0982
富山市荒川一丁目3番27号
電話:076-431-1717
FAX:076-431-6707
26. 製造販売業者等
26.1 製造販売元
テイカ製薬株式会社
富山市荒川一丁目3番27号