医薬品情報
| 総称名 | クリンダマイシンリン酸エステル |
|---|---|
| 一般名 | クリンダマイシンリン酸エステル |
| 欧文一般名 | Clindamycin Phosphate |
| 製剤名 | クリンダマイシンリン酸エステル製剤 |
| 薬効分類名 | 外用抗生物質製剤 |
| 薬効分類番号 | 2634 |
| ATCコード | D10AF01 |
| KEGG DRUG |
D01073
クリンダマイシンリン酸エステル
|
| KEGG DGROUP |
DG00435
クリンダマイシン
DG01578
リンコサミド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| クリンダマイシンリン酸エステルゲル1%「イワキ」 (後発品) | Clindamycin Phosphate Gel 1%"IWAKI" | 岩城製薬 | 2634713M1054 | 11.7円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分又はリンコマイシン系抗生物質に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
本品の適量を1日2回、洗顔後、患部に塗布する。
7. 用法及び用量に関連する注意
7.1 本剤を塗布する面積は治療上必要最小限にとどめること。
7.2 本剤の使用にあたっては、4週間で効果が認められない場合には使用を中止すること。また、炎症性皮疹が消失した場合には継続使用しないこと。
8. 重要な基本的注意
本剤の使用にあたっては、耐性菌の発現等を防ぐため、疾病の治療上必要な最小限の期間の使用にとどめること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 抗生物質に関連した下痢又は大腸炎の既往歴のある患者
偽膜性大腸炎等の重篤な大腸炎があらわれるおそれがある。[11.1.1参照]
9.1.2 アトピー性体質の患者
重症の即時型アレルギー反応があらわれるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には使用しないことが望ましい。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。皮膚外用に用いたときの母乳中への移行は不明である。
9.7 小児等
低出生体重児、新生児、乳児、幼児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| エリスロマイシン | 併用しても本剤の効果があらわれないと考えられる。 | 細菌のリボソーム50S Subunitへの親和性が本剤より高い。 |
| 末梢性筋弛緩剤 スキサメトニウム塩化物水和物 ツボクラリン塩化物塩酸塩水和物等 | 筋弛緩作用が増強される。 | 本剤は神経筋遮断作用を有する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
腹痛、頻回の下痢があらわれた場合には直ちに使用を中止し、輸液、バンコマイシンの経口投与等の適切な処置を行うこと。[9.1.1参照]
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 皮膚 | つっぱり感、パリパリ感 | グラム陰性菌毛嚢炎、脂性肌 | |
| 過敏症 | そう痒 | 発赤注)、蕁麻疹、刺激感、ヒリヒリ感 | 接触皮膚炎 |
| 肝臓 | AST、ALT、Al-P、総ビリルビンの上昇、ウロビリノーゲン陽性 | ||
| その他 | 白血球増加、血小板増加、総コレステロール低下、尿蛋白、尿糖 | 消化器障害 |
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子(6名)の背部皮膚にクリンダマイシンリン酸エステルゲル1%2gを単回塗布した時の血漿中クリンダマイシン濃度は、多くの被験者のほとんどの測定時点で定量限界値(13.2pg/mL)以下であった1)。
16.1.2 反復投与
健康成人男子(6名)の背部皮膚にクリンダマイシンリン酸エステルゲル1%2gを12時間毎に9回反復塗布した時の塗布後12時間の血漿中クリンダマイシン濃度は、3回塗布でほぼ一定となり、最終塗布後の最高血漿中濃度は平均161.3pg/mLであった1)。
16.5 排泄
健康成人男子の背部皮膚にクリンダマイシンリン酸エステルゲル1%2gを単回(6名)又は反復(6名)塗布した時の尿中クリンダマイシン排泄率は単回及び反復塗布のいずれにおいても塗布量の0.01%以下であった1)。
16.8 その他
16.8.1 生物学的同等性試験
クリンダマイシンリン酸エステルゲル1%「イワキ」とダラシンTゲル1%を、それぞれ健康成人男子20名に単回経皮投与して角層中未変化体量を測定した。生物学的同等性判定のパラメータである定常状態(投与後4時間)及び投与後12時間における薬物回収量の対数変換値について統計解析した結果、両剤の生物学的同等性が確認された2)。
| 製剤\投与後時間(hr) | 4 | 12 |
| クリンダマイシンリン酸エステルゲル1%「イワキ」 | 3604.52±1125.21 | 4041.20±913.27 |
| ダラシンTゲル1% | 2937.14±925.26 | 3497.96±1121.16 |
薬物回収量は、被験者の選択、角層の剥離回数・適用時間等の試験条件によって異なる可能性がある。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
多発性炎症性皮疹を有する尋常性ざ瘡(ざ瘡(化膿性炎症を伴うもの))患者を対象として、1日2回、朝・夕洗顔後、患部にクリンダマイシンリン酸エステルゲル2%注1)、1%又は基剤を4週間塗布した至適濃度設定試験(二重盲検試験)において、有効率注2)は2%群80.9%(38/47例)、1%群81.8%(36/44例)、基剤群54.0%(27/50例)であった。クリンダマイシンリン酸エステルゲル2%群及び1%群の副作用発現頻度注3)は、12.7%(8/63例)及び2.9%(2/68例)であった。その内訳は、クリンダマイシンリン酸エステルゲル2%群でそう痒7.9%(5/63例)、つっぱり感1.6%(1/63例)、発赤の悪化1.6%(1/63例)、発赤1.6%(1/63例)、ヒリヒリ感1.6%(1/63例)、パリパリ感1.6%(1/63例)、1%群でそう痒1.5%(1/68例)、刺激感1.5%(1/68例)であった。また、臨床検査値の異常変動注4)は、2%群で総コレステロール低下2.1%(1/48例)、GPT上昇2.0%(1/50例)、1%群で白血球増加2.0%(1/51例)、血小板増加2.0%(1/49例)、GOT上昇2.0%(1/51例)、総ビリルビン上昇2.0%(1/51例)、尿蛋白2.0%(1/50例)が認められた3)。
17.1.2 国内第III相試験
多発性炎症性皮疹を有する尋常性ざ瘡(ざ瘡(化膿性炎症を伴うもの))患者を対象に1日2回、朝・夕洗顔後、患部にクリンダマイシンリン酸エステルゲル又はナジフロキサシンクリームを4週間塗布した無作為化割付群間比較試験において、有効率注2)はクリンダマイシンリン酸エステルゲル群72.5%(74/102例)、ナジフロキサシン群49.0%(47/96例)であった。クリンダマイシンリン酸エステルゲルの有効性はナジフロキサシンと比較して非劣性であることが示された。クリンダマイシンリン酸エステルゲル群の副作用発現頻度注3)は、5.8%(7/120例)であった。その内訳は、そう痒5.0%(6/120例)、刺激感0.8%(1/120例)、発赤の悪化0.8%(1/120例)であった。また、臨床検査値の異常変動注4)は、クリンダマイシンリン酸エステルゲル群で、尿蛋白1.0%(1/103例)、ウロビリノーゲン陽性1.0%(1/103例)などが認められた4)。
17.1.3 国内第III相試験
多発性炎症性皮疹を有する尋常性ざ瘡(ざ瘡(化膿性炎症を伴うもの))患者を対象に1日2回、朝・夕洗顔後、患部にクリンダマイシンリン酸エステルゲルを12週間塗布した一般臨床試験において、クリンダマイシンリン酸エステルゲルの有効率注2)は78.1%(25/32例)であった。クリンダマイシンリン酸エステルゲル群の副作用発現頻度注3)は、12.5%(4/32例)であった。その内訳は、そう痒12.5%(4/32例)であった。また、臨床検査値の異常変動注4)は、尿蛋白3.4%(1/29例)が認められた5)。
17.1.4 国内第III相試験
多発性炎症性皮疹を有する尋常性ざ瘡(ざ瘡(化膿性炎症を伴うもの))患者を対象に1日2回、朝・夕洗顔後、患部にクリンダマイシンリン酸エステルゲルを12週間塗布した一般臨床試験において、クリンダマイシンリン酸エステルゲルの有効率注2)は48.0%(12/25例)であった。クリンダマイシンリン酸エステルゲル群の副作用発現頻度注3)は、16.0%(4/25例)であった。その内訳は、そう痒8.0%(2/25例)、発赤の悪化4.0%(1/25例)、蕁麻疹4.0%(1/25例)、発赤4.0%(1/25例)であった。また、臨床検査値の異常変動注4)は、総ビリルビン上昇9.1%(2/22例)などが認められた6)。
17.2 製造販売後調査等
17.2.1 特定使用成績調査(小児)
有効性解析対象症例165例において、全般改善度の評価による有効率注5)は75.8%(125/165例)であった。
安全性解析対象症例168例における副作用発現頻度は、1.8%(3/168例)であった。その内訳は、接触皮膚炎0.6%(1/168例)、湿疹0.6%(1/168例)、皮膚刺激0.6%(1/168例)であった7)。
安全性解析対象症例168例における副作用発現頻度は、1.8%(3/168例)であった。その内訳は、接触皮膚炎0.6%(1/168例)、湿疹0.6%(1/168例)、皮膚刺激0.6%(1/168例)であった7)。
17.3 その他
17.3.1 皮膚刺激性
本邦パッチテスト研究班の基準に基づき、健康成人男子で傍脊椎側の無傷皮膚表面にクリンダマイシンリン酸エステルゲル1%に対し基剤を用いた単純パッチテスト並びに光パッチテストを実施した結果、クリンダマイシンリン酸エステルゲルの皮膚刺激性が弱いこと、また、光過敏反応を示さないことが確認された8)。
注1)本剤の承認された濃度は1%である。
注2)著効、有効、やや有効、無効、悪化の5段階にて評価し、著効及び有効を有効率として算出した。
注3)発現件数/対象症例数
注4)発現件数/実施症例数
注5)治癒、著しく軽快、かなり軽快、やや軽快、不変、悪化の6段階にて評価し、治癒、著しく軽快、かなり軽快を有効率として算出した。
18. 薬効薬理
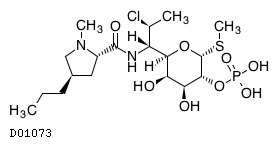
19. 有効成分に関する理化学的知見
19.1. クリンダマイシンリン酸エステル
22. 包装
10本[10g(チューブ)×10]
23. 主要文献
- 原田昭太郎, 臨床医薬, 15, 567-582, (1999)
- 岩城製薬株式会社 社内資料(生物学的同等性試験)
- 第II相試験(ダラシンTゲル1%:2002年7月5日承認、申請資料概要ト.1.(2))
- 第III相試験(ダラシンTゲル1%:2002年7月5日承認、申請資料概要ト.1.(3))
- 一般臨床試験(1)(ダラシンTゲル1%:2002年7月5日承認、申請資料概要ト.1.(4))
- 一般臨床試験(2)(ダラシンTゲル1%:2002年7月5日承認、申請資料概要ト.1.(5))
- 特定使用成績調査の概要(ダラシンTゲル1%:2011年3月25日承認、再審査報告書)
- 原田昭太郎, 臨床医薬, 15, 559-565, (1999)
- JL LeFrock,et al, Clindamycin.Medical Clinics of North America., 66, 103-120, (1982)
- 小野尚子ほか, Jpn J Antibiot., 30, 1-6, (1977)
- 二宮敬宇ほか, Jpn J Antibiot., 26, 157-162, (1973) »PubMed
- 薬理作用(ダラシンTゲル1%:2002年7月5日承認、申請資料概要ホ)
- 出口浩一, Jpn J Antibiot., 34, 419-424, (1981) »PubMed
- 駒形安子ほか, Jpn J Antibiot., 51, 130-136, (1998) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
岩城製薬株式会社
マーケティング部 学術グループ
〒103-8434
東京都中央区日本橋本町4-8-2
電話:03-6626-6251
FAX:03-6626-6261
製品情報問い合わせ先
岩城製薬株式会社
マーケティング部 学術グループ
〒103-8434
東京都中央区日本橋本町4-8-2
電話:03-6626-6251
FAX:03-6626-6261
26. 製造販売業者等
26.1 製造販売元
岩城製薬株式会社
東京都中央区日本橋本町4-8-2