医薬品情報
| 総称名 | ジルチアゼム塩酸塩 |
|---|---|
| 一般名 | ジルチアゼム塩酸塩 |
| 欧文一般名 | Diltiazem Hydrochloride |
| 製剤名 | ジルチアゼム塩酸塩注射剤 |
| 薬効分類名 | 注射用Ca拮抗剤 |
| 薬効分類番号 | 2171 |
| ATCコード | C08DB01 |
| KEGG DRUG |
D00616
ジルチアゼム塩酸塩
|
| KEGG DGROUP |
DG03231
血圧降下薬
DG01653
抗不整脈薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジルチアゼム塩酸塩注射用10mg「サワイ」 (後発品) | DILTIAZEM HYDROCHLORIDE for Injection[SAWAI] | 沢井製薬 | 2171405D4069 | 104円/瓶 | 劇薬, 処方箋医薬品注) |
| ジルチアゼム塩酸塩注射用50mg「サワイ」 (後発品) | DILTIAZEM HYDROCHLORIDE for Injection[SAWAI] | 沢井製薬 | 2171405D5065 | 282円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重篤な低血圧あるいは心原性ショックのある患者[症状を悪化させるおそれがある。]
2.2 2度以上の房室ブロック、洞不全症候群(持続性の洞性徐脈(50拍/分未満)、洞停止、洞房ブロック等)のある患者[本剤の心刺激生成抑制作用、心伝導抑制作用が過度にあらわれるおそれがある。]
2.3 重篤なうっ血性心不全の患者[心不全症状を悪化させるおそれがある。]
2.4 重篤な心筋症のある患者[心不全症状を悪化させるおそれがある。]
2.5 本剤の成分に対し過敏症の既往歴のある患者
2.6 妊婦又は妊娠している可能性のある女性[9.5参照]
2.7 アスナプレビルを含有する製剤、イバブラジン塩酸塩、ロミタピドメシル酸塩を投与中の患者[10.1参照]
4. 効能または効果
6. 用法及び用量
本剤(ジルチアゼム塩酸塩として10mg又は50mg)は、5mL以上の生理食塩液又はブドウ糖注射液に用時溶解し、次のごとく投与する。
<頻脈性不整脈(上室性)>
通常、成人にはジルチアゼム塩酸塩として1回10mgを約3分間で緩徐に静注する。なお、年齢、症状により適宜増減する。
<手術時の異常高血圧の救急処置>
1回静注の場合
通常、成人にはジルチアゼム塩酸塩として1回10mgを約1分間で緩徐に静注する。なお、年齢、症状により適宜増減する。
点滴静注の場合
通常、成人には1分間に体重kg当たりジルチアゼム塩酸塩として5〜15μgを点滴静注する。目標値まで血圧を下げ、以後血圧をモニターしながら点滴速度を調節する。
<高血圧性緊急症>
通常、成人には1分間に体重kg当たりジルチアゼム塩酸塩として5〜15μgを点滴静注する。目標値まで血圧を下げ、以後血圧をモニターしながら点滴速度を調節する。
<不安定狭心症>
通常、成人には1分間に体重kg当たりジルチアゼム塩酸塩として1〜5μgを点滴静注する。投与量は低用量から開始し、患者の病態に応じて適宜増減するが、最高用量は1分間に体重kg当たり5μgまでとする。
8. 重要な基本的注意
8.1 心電図と血圧を連続的に監視すること。
8.2 本剤の投与により完全房室ブロック、高度徐脈、更に心停止に至る場合があるので、次の点に十分注意すること。
・治療上必要最小限の用量、また、点滴静注の場合は必要最小限の投与時間にとどめること。
・投与中および投与後は患者の状態の観察を十分に行い、これらの症状の早期発見に留意すること。
[11.1.1参照]
8.3 狭心症発作が15分以上持続するなど重度の発作に対しては、必要に応じて他の治療法(PTCA、CABG等)も検討すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 うっ血性心不全の患者(重篤なうっ血性心不全の患者を除く)
心不全症状を悪化させるおそれがある。[11.1.2参照]
9.1.2 心筋症のある患者(重篤な心筋症のある患者を除く)
心不全症状を悪化させるおそれがある。
9.1.3 急性心筋梗塞のある患者
心不全症状を悪化させるおそれがある。
9.1.4 徐脈、1度の房室ブロックのある患者
心刺激生成抑制作用、心伝導抑制作用が過度にあらわれるおそれがある。[11.1.1参照]
9.1.5 低血圧のある患者(重篤な低血圧のある患者を除く)
血圧を更に低下させるおそれがある。
9.1.6 WPW、LGL症候群を伴う心房細動、心房粗動のある患者
低血圧を伴う心拍数増加、心室細動を来すおそれがある。
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
薬物の排泄が遅延し、作用が増強するおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
薬物の代謝が遅延し、作用が増強するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験で催奇形作用(マウス、ラット、ウサギ:骨格異常、外形異常)及び胎児毒性(マウス、ラット、ウサギ:致死)が報告されている。[2.6参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒトの母乳中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始するなど患者の状態を十分観察しながら慎重に投与すること。一般に高齢者では生理機能が低下している。
10. 相互作用
相互作用序文
本剤は主として代謝酵素チトクロームP450 3A4(CYP3A4)で代謝される。[16.4.2参照]
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| アスナプレビル(スンベプラ) ダクラタスビル塩酸塩/アスナプレビル/ベクラブビル塩酸塩(ジメンシー) [2.7参照] | アスナプレビルの血中濃度が上昇する。 肝胆道系の副作用が発現し、また重症化するおそれがある。 | 本剤がCYP3Aを阻害することにより、左記薬剤の代謝が阻害される。 |
| イバブラジン塩酸塩(コララン) [2.7参照] | 過度の徐脈があらわれることがある。 | 本剤がCYP3Aを阻害することにより、左記薬剤の代謝が阻害され、血中濃度が上昇する。 左記薬剤の心拍数減少作用を相加的に増強する。 |
| ロミタピドメシル酸塩(ジャクスタピッド) [2.7参照] | ロミタピドメシル酸塩の血中濃度が著しく上昇するおそれがある。 | 本剤がCYP3Aを阻害することにより、左記薬剤の代謝が阻害される。 |
10.2 併用注意
| 降圧作用を有する薬剤(降圧剤、硝酸剤等) | 血圧を測定し、用量を調節する。 | 相加的に作用(降圧作用)を増強させると考えられる。 |
| β遮断剤(ビソプロロールフマル酸塩、プロプラノロール塩酸塩、アテノロール等) | 徐脈、房室ブロック、洞房ブロック等があらわれることがある。 心電図をモニターし、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用、陰性変力作用、降圧作用)を増強させると考えられる。特にジギタリス製剤との3剤併用時には注意を要する。 |
| ラウオルフィア製剤(レセルピン等) | 徐脈、房室ブロック、洞房ブロック等があらわれることがある。 心電図をモニターし、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用、陰性変力作用、降圧作用)を増強させると考えられる。特にジギタリス製剤との3剤併用時には注意を要する。 |
| ジギタリス製剤(ジゴキシン、メチルジゴキシン) | 徐脈、房室ブロック等があらわれることがある。 また、これらの不整脈を含めジギタリス製剤の血中濃度上昇による中毒症状(悪心・嘔吐、頭痛、めまい、視覚異常等)があらわれることがある。 心電図をモニターし、また、定期的にジギタリス中毒の有無を観察し、必要に応じてジギタリス製剤の血中濃度を測定する。異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用)を増強させると考えられる。特にβ遮断剤との3剤併用時には注意を要する。 また、本剤はジギタリス製剤の血中濃度を上昇させると考えられる。 |
| 抗不整脈薬(アミオダロン塩酸塩、メキシレチン塩酸塩等) | 徐脈、房室ブロック、洞停止等があらわれることがある。 心電図をモニターし、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用)を増強させると考えられる。 |
| 麻酔剤(イソフルラン等) | 徐脈、房室ブロック、洞停止等があらわれることがある。 心電図をモニターし、異常が認められた場合には減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用)を増強させると考えられる。 |
| フィンゴリモド塩酸塩 | フィンゴリモド塩酸塩の投与開始時に併用すると重度の徐脈や心ブロックが認められることがある。 | 共に徐脈や心ブロックを引き起こすおそれがある。 |
| アプリンジン塩酸塩 | 両剤の血中濃度上昇による症状(徐脈、房室ブロック、洞停止、振戦、めまい、ふらつき等)があらわれることがある。 心電図をモニターし、また、定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | 共通の代謝酵素(チトクロームP450)に影響を及ぼし合い、両剤の血中濃度を上昇させると考えられる。 |
| ジヒドロピリジン系Ca拮抗剤(ニフェジピン、アムロジピンベシル酸塩等) | ジヒドロピリジン系Ca拮抗剤の血中濃度上昇による症状(降圧作用の増強等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| シンバスタチン | シンバスタチンの血中濃度上昇による横紋筋融解症やミオパシーが発現することがある。 定期的に臨床症状を観察し、異常が認められた場合には投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| トリアゾラム | トリアゾラムの血中濃度上昇による症状(睡眠時間の延長等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| ミダゾラム | ミダゾラムの血中濃度上昇による症状(鎮静・睡眠作用の増強等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| カルバマゼピン | カルバマゼピンの血中濃度上昇による症状(眠気、悪心・嘔吐、眩暈等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| セレギリン塩酸塩 | セレギリン塩酸塩の作用、毒性が増強することがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| テオフィリン | テオフィリンの血中濃度上昇による症状(悪心・嘔吐、頭痛、不眠等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| シロスタゾール | シロスタゾールの作用が増強することがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| アピキサバン | アピキサバンの作用が増強することがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| ビノレルビン酒石酸塩 | ビノレルビン酒石酸塩の作用が増強することがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| シクロスポリン | シクロスポリンの血中濃度上昇による症状(腎障害等)があらわれることがある。 定期的に臨床症状を観察し、また、シクロスポリンの血中濃度を測定し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| タクロリムス水和物 | タクロリムスの血中濃度上昇による症状(腎障害等)があらわれることがある。 定期的に臨床症状を観察し、また、タクロリムスの血中濃度を測定し、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤の代謝酵素(チトクロームP450)を阻害することにより、これらの薬剤の血中濃度を上昇させると考えられる。 |
| フェニトイン | フェニトインの血中濃度上昇による症状(運動失調、めまい、眼振等)があらわれることがある。 定期的に臨床症状を観察し、異常が認められた場合には減量若しくは投与を中止する。 また、本剤の作用が低下することがある。 | フェニトインの代謝酵素(チトクロームP450)を阻害することにより、フェニトインの血中濃度を上昇させると考えられる。また、フェニトインが本剤の代謝を促進することにより、本剤の血中濃度を低下させると考えられる。 |
| シメチジン | 本剤の血中濃度上昇による症状(降圧作用の増強、徐脈等)があらわれることがある。 血圧を測定し、また、心電図をモニターし、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤が本剤の代謝酵素(チトクロームP450)を阻害することにより、本剤の血中濃度を上昇させると考えられる。 |
| HIVプロテアーゼ阻害剤(リトナビル、サキナビルメシル酸塩等) | 本剤の血中濃度上昇による症状(降圧作用の増強、徐脈等)があらわれることがある。 血圧を測定し、また、心電図をモニターし、異常が認められた場合には減量若しくは投与を中止する。 | これらの薬剤が本剤の代謝酵素(チトクロームP450)を阻害することにより、本剤の血中濃度を上昇させると考えられる。 |
| リファンピシン | 本剤の作用が低下することがある。 定期的に臨床症状を観察し、また、可能であれば本剤の血中濃度を測定し、異常が認められた場合には、他剤への変更あるいは本剤を増量するなどの適切な処置を行う。 | リファンピシンが本剤の代謝酵素(チトクロームP450)を誘導することにより、本剤の血中濃度を低下させると考えられる。 |
| 筋弛緩剤(パンクロニウム臭化物、ベクロニウム臭化物等) | 筋弛緩剤の作用が増強することがある。 筋弛緩作用に注意し、異常が認められた場合には減量若しくは投与を中止する。 | 本剤が神経筋接合部において、シナプス前からのアセチルコリン放出を抑制させると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 完全房室ブロック(0.16%)、高度徐脈等(頻度不明)
11.1.2 うっ血性心不全(頻度不明)[9.1.1参照]
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 循環器 | 徐脈、房室ブロック、血圧低下、房室接合部調律、期外収縮、洞停止、顔面潮紅、脚ブロック、動悸 | 洞房ブロック、めまい、一過性の頻脈 | |
| 精神神経系 | 頭痛、嘔気 | 嘔吐 | |
| 肝臓 | AST、ALT、LDHの上昇 | ALPの上昇 | |
| 腎臓 | 血清クレアチニン、BUNの上昇 | 尿量減少 | |
| 過敏症 | 発疹、そう痒、光線過敏症 | ||
| その他 | 注射部位の局所発赤 | 静脈炎 |
13. 過量投与
13.1 症状
徐脈、完全房室ブロック、心不全、低血圧等があらわれることがある。[11.1.1参照]
13.2 処置
透析によって除去されない。下記等の適切な処置を行うこと。
・徐脈、完全房室ブロック
アトロピン硫酸塩水和物、イソプレナリン等の投与や心臓ペーシングを適用すること。
・心不全、低血圧
強心剤、昇圧剤、輸液等の投与や補助循環を適用すること。
14. 適用上の注意
14.1 薬剤調製時の注意
他剤との配合によりpHが8を超える場合には、ジルチアゼムが析出することがあるので注意すること。
16. 薬物動態
16.1 血中濃度
16.1.1 1回静注
心疾患患者8例にジルチアゼム塩酸塩10mgを1分間で1回静注したとき、投与直後で最高血中濃度に達し、初期で急激に減少、その後緩やかに減衰する。1回静注時の半減期(消失相)は約1.9時間である1)。
16.1.2 点滴静注
非開心術中の患者5例にジルチアゼム塩酸塩を5、10、15μg/kg/分で24時間点滴静注したときの血漿中濃度は注入速度の増加に従って用量依存的に上昇し、投与開始後5〜6時間で定常状態となる。投与終了後は速やかに減少したのち緩やかに消失する2)。
16.4 代謝
16.5 排泄
14C標識ジルチアゼム塩酸塩3mg/kgをSD系雄性ラットに静脈内投与したとき、投与後72時間までの尿中排泄率は34.8%、糞中排泄率は64.6%であった5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<頻脈性不整脈(上室性)>
17.1.1 国内比較試験
ジルチアゼム塩酸塩0.2mg/kg又はプラセボを約3分間で1回静脈内投与した二重盲検比較試験の結果、有効率(有効以上)は発作性上室性頻拍に対して59.3%(16/27例)、頻拍性心房細動・粗動に対して90.2%(37/41例)であった。
副作用発現頻度は、13.2%(9/68例)であった。主な副作用は、顔のほてり4.4%(3/68例)、顔面潮紅2.9%(2/68例)であった6)。
副作用発現頻度は、13.2%(9/68例)であった。主な副作用は、顔のほてり4.4%(3/68例)、顔面潮紅2.9%(2/68例)であった6)。
<手術時の異常高血圧の救急処置>
17.1.2 国内比較試験
ジルチアゼム塩酸塩を10〜30μg/kg/分で静脈内に持続投与、又は対照薬としてニトログリセリンを0.5〜5μg/kg/分で静脈内に持続投与した単純盲検比較試験の結果、ジルチアゼム塩酸塩の有効率(順調以上)は95.7%(88/92例)であった。
副作用発現頻度は、13.0%(12/92例)であった。主な副作用は、房室接合部調律5.4%(5/92例)、徐脈4.3%(4/92例)であった7)。
副作用発現頻度は、13.0%(12/92例)であった。主な副作用は、房室接合部調律5.4%(5/92例)、徐脈4.3%(4/92例)であった7)。
<高血圧性緊急症>
17.1.3 国内一般臨床試験
悪性高血圧、高血圧性脳症、解離性大動脈瘤、急性左心不全等の高血圧性緊急症に対する有効率(有効以上)は100.0%(27/27例)であった。
副作用発現頻度は、18.5%(5/27例)であった8)。
副作用発現頻度は、18.5%(5/27例)であった8)。
<不安定狭心症>
17.1.4 国内臨床試験
無作為単純盲検比較試験の結果、不安定狭心症に対するジルチアゼム塩酸塩の有用性が認められた。有効率(中等度改善以上)は80.0%(32/40例)であった9)。
18. 薬効薬理
18.1 作用機序
末梢血管、冠血管等の血管平滑筋及び房室結節において、細胞内へのCa2+流入を抑制することにより、血管拡張作用及び房室結節伝導時間の延長作用を示し、高血圧、不整脈、狭心症に効果を示す。
18.2 血圧に対する作用
18.2.2 血圧の低下とともに末梢血管抵抗及び心筋酸素消費量を減少させ、心拍出量を増加させる(イヌ)13)。
18.3 不整脈に対する作用
18.3.1 房室結節の伝導時間、有効不応期、並びに機能的不応期を延長させ、上室性の頻脈性不整脈に対し効果をあらわす(イヌ)16)。
18.3.2 心房の電気刺激によって誘発される上室性の頻脈性不整脈を抑制する(ウサギ)17)。
18.4 心筋虚血に対する作用
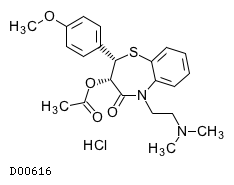
19. 有効成分に関する理化学的知見
19.1. ジルチアゼム塩酸塩
22. 包装
<ジルチアゼム塩酸塩注射用10mg「サワイ」>
10バイアル
<ジルチアゼム塩酸塩注射用50mg「サワイ」>
10バイアル
23. 主要文献
- 江藤晃他, 基礎と臨床, 14 (10), 3082-3088, (1980)
- 溝辺雅一他, 基礎と臨床, 21 (11), 4623-4628, (1987)
- Sugawara,Y.et al., J.Pharmacobio-dyn., 11 (4), 224-233, (1988) »PubMed
- 第十八改正日本薬局方解説書, C-2450-2457, (2021), (廣川書店)
- Nakamura,S.et al., Arzneimittelforschung, 37 (11), 1244-1252, (1987) »PubMed
- 橋場邦武他, Progress in Medicine, 7 (6), 1155-1177, (1987)
- 山村秀夫他, 薬理と治療, 15 (7), 2941-2960, (1987)
- 尾前照雄他, 臨牀と研究, 64 (10), 3221-3236, (1987)
- 木之下正彦他, 医学のあゆみ, 181 (2), 173-198, (1997)
- 佐藤匡徳他, 日本薬理学雑誌, 75 (2), 99-106, (1979) »PubMed
- Takata,Y.et al., Clin.Exp.Hypertens., A5 (6), 827-847, (1983)
- 山口勲他, 日本薬理学雑誌, 75 (2), 191-199, (1979) »PubMed
- 長尾拓他, 日本薬理学雑誌, 77 (2), 195-203, (1981) »PubMed
- Murata,S.et al., Jpn.J.Pharmacol., 32 (6), 1033-1040, (1982) »PubMed
- Sato,M.et al., Arzneimittelforschung, 21 (9), 1338-1343, (1971) »PubMed
- 中谷晴昭他, 日本薬理学雑誌, 76 (8), 697-707, (1980) »PubMed
- 安谷屋均他, 呼吸と循環, 35 (5), 561-567, (1987)
- Nagao,T.et al., Jpn.J.Pharmacol., 27 (2), 330-332, (1977) »PubMed
- Nagao,T.et al., J.Mol.Cell.Cardiol., 12 (1), 29-43, (1980) »PubMed
- Nagao,T.et al., Jpn.J.Pharmacol., 25 (3), 281-288, (1975) »PubMed
- Shimokawa,H.et al., Science, 221 (4610), 560-562, (1983) »PubMed
- Kinoshita,M.et al., Jpn.Circ.J., 49 (2), 179-189, (1985) »PubMed
- Bush,L.R.et al., J.Pharmacol.Exp.Ther., 218 (3), 653-661, (1981) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30