医薬品情報
| 総称名 | アロプリノール |
|---|---|
| 一般名 | アロプリノール |
| 欧文一般名 | Allopurinol |
| 薬効分類名 | 高尿酸血症治療剤 |
| 薬効分類番号 | 3943 |
| ATCコード | M04AA01 |
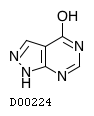
| KEGG DRUG |
D00224
アロプリノール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年4月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アロプリノール錠50mg「アメル」 | Allopurinol Tablets「AMEL」 | 共和薬品工業 | 3943001F2086 | 10.4円/錠 | 処方箋医薬品 |
| アロプリノール錠100mg「アメル」 (後発品) | Allopurinol Tablets「AMEL」 | 共和薬品工業 | 3943001F1322 | 8円/錠 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
下記の場合における高尿酸血症の是正
痛風、高尿酸血症を伴う高血圧症
6. 用法及び用量
通常、成人は1日量アロプリノールとして200〜300mgを2〜3回に分けて食後に経口投与する。年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
血中尿酸値を測定しながら投与し、治療初期1週間は1日100mg投与が望ましい。[8.3参照]
8. 重要な基本的注意
8.1 本剤の投与により皮膚症状又は過敏症状が発現し、重篤な症状に至ることがあるので、発熱、発疹等が認められた場合には直ちに投与を中止し、適切な処置を行うこと。[11.1.1、11.1.2、15.1.3参照]
8.2 急性痛風発作がおさまるまで、本剤の投与を開始しないこと。
8.3 投与初期に尿酸の移動により、痛風発作の一時的な増強をみることがある。[7.参照]
8.4 本剤投与中に痛風が増悪した場合にはコルヒチン、インドメタシン等を併用すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
投与量の減量や投与間隔の延長を考慮すること。本剤やその代謝物の排泄が遅延し高い血中濃度が持続する。特に腎不全患者に副作用が発現した場合は重篤な転帰をたどることがあり、死亡例も報告されている。
9.3 肝機能障害患者
9.3.1 肝疾患を有する患者又はその既往歴のある患者
定期的に肝機能検査を実施すること。肝障害が発現又は増悪するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(マウス)の妊娠10日目又は13日目に50及び100mg/kgを腹腔内投与したところ、胎児に催奇形作用が認められたと報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へ本剤及びその代謝物が移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
高い血中濃度が持続するおそれがあるので、用量に留意して慎重に投与すること。本剤の主代謝物は主として腎から排泄される。高齢者では腎機能が低下していることが多い。
10. 相互作用
相互作用序文
本剤はキサンチンオキシダーゼを阻害する。[18.1参照]
薬物代謝酵素用語
キサンチンオキシダーゼ
10.2 併用注意
| メルカプトプリン水和物 アザチオプリン | 骨髄抑制等の副作用を増強する。 これらの薬剤の用量を1/3〜1/4に減量すること。 | 本剤がアザチオプリンの代謝酵素であるキサンチンオキシダーゼを阻害する。その結果6-メルカプトプリンの血中濃度が上昇する。 |
| ビダラビン | ビダラビンの作用を増強し、幻覚、振戦、神経障害等が発現したとの報告がある。 副作用の発現に注意すること。 | 本剤がビダラビンの代謝を抑制し、ビダラビンの作用を増強すると報告されている。 |
| クマリン系抗凝血剤 ワルファリンカリウム | クマリン系抗凝血剤の作用を増強するとの報告がある。 凝固能の変動に注意し、クマリン系抗凝血剤の投与量の減量あるいは投与間隔の延長を考慮すること。 | 本剤による肝代謝酵素活性の低下作用により、クマリン系抗凝血剤の代謝を阻害するためクマリン系抗凝血剤の半減期が延長すると報告されている。 |
| クロルプロパミド | クロルプロパミドの作用を増強する。 血糖値の変動に注意し、クロルプロパミドの投与量の減量あるいは投与間隔の延長を考慮すること。 | 尿細管分泌の競合によりクロルプロパミドの半減期が延長すると報告されている。 |
| シクロホスファミド水和物 | 骨髄抑制が発現したとの報告がある。 定期的に血液検査を行い、白血球減少等の副作用の発現に注意すること。 | 本剤又は本剤の代謝物がシクロホスファミドの肝代謝を阻害する、又は、シクロホスファミド腎排泄を競合阻害すると報告されている。 |
| シクロスポリン | シクロスポリンの血中濃度が上昇し、腎機能低下が発現したとの報告がある。 シクロスポリンの投与量に注意すること。 | 本剤がシクロスポリンの肝代謝を阻害するためシクロスポリンの血中濃度が上昇すると報告されている。 |
| フェニトイン | フェニトインの血中濃度が上昇し、嗜眠が発現したとの報告がある。 フェニトインの投与量に注意すること。 | 本剤がフェニトインの肝代謝を阻害するためフェニトインの血中濃度が上昇すると報告されている。 |
| キサンチン系薬剤 テオフィリン等 | キサンチン系薬剤(テオフィリン等)の血中濃度が上昇する。 キサンチン系薬剤の投与量に注意すること。 | 本剤がテオフィリンの代謝酵素であるキサンチンオキシダーゼを阻害するためテオフィリンの血中濃度が上昇すると報告されている。 |
| ジダノシン | 健康成人及びHIV患者において、ジダノシンのCmax及びAUCが2倍に上昇したとの報告がある。 ジダノシンの投与量に注意すること。 なお、ジダノシンの半減期には影響は見られていない。 | 本剤がジダノシンの代謝酵素であるキサンチンオキシダーゼを阻害するため、ジダノシンの血中濃度が上昇すると考えられる。 |
| ペントスタチン | 重症の過敏反応(過敏性血管炎)が発現したとの報告がある。 | 機序は不明である。 |
| カプトプリル | 過敏症状(Stevens-Johnson症候群、関節痛等)が発現したとの報告がある。 | 機序は不明である。特に腎障害のある患者では注意すること。 |
| ヒドロクロロチアジド | 重症の過敏反応(悪寒、全身性の皮疹等)が発現したとの報告がある。 | 機序は不明である。 |
| アンピシリン | 発疹の発現が増加するとの報告がある。 | 機序は不明であるが、本剤又は高尿酸血症によりアンピシリンの過敏反応が増強される可能性が報告されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、はく脱性皮膚炎等の重篤な皮膚障害又は過敏性血管炎(いずれも頻度不明)
11.1.2 薬剤性過敏症症候群(頻度不明)
11.1.3 ショック、アナフィラキシー(いずれも頻度不明)
11.1.4 再生不良性貧血、汎血球減少、無顆粒球症、血小板減少(いずれも頻度不明)
11.1.5 劇症肝炎等の重篤な肝機能障害、黄疸(いずれも頻度不明)
11.1.6 腎不全、腎不全の増悪、間質性腎炎を含む腎障害(いずれも頻度不明)
11.1.7 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難等の呼吸器症状があらわれた場合には、速やかに胸部X線等の検査を実施すること。
11.1.8 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等の症状があらわれることがある。
11.1.9 無菌性髄膜炎(頻度不明)
項部硬直、発熱、頭痛、悪心・嘔吐又は意識障害等の症状を伴う無菌性髄膜炎があらわれることがある。なお、本剤投与後数時間で発症した例も報告されている。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | そう痒、関節痛 | |
| 血液 | 貧血 | 白血球減少、紫斑、好酸球増多、リンパ節症 | |
| 腎臓 | 腎機能異常 | ||
| 消化器 | 食欲不振、胃部不快感、軟便、下痢 | 口内炎 | |
| 全身症状 | 全身倦怠感 | 浮腫 | 脱力感 |
| その他 | 脱毛 | CK上昇、味覚障害、女性化乳房、末梢神経障害 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 使用中は摂水量を多くし、1日の尿量を2L以上とすることが望ましい。
15.1.2 外国における疫学調査報告で、本剤の投与により白内障があらわれたとの報告がある3)。
15.1.3 漢民族(Han-Chinese)を対象としたレトロスペクティブな研究において、アロプリノールによる中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)及び皮膚粘膜眼症候群(Stevens-Johnson症候群)等の重症薬疹発症例のHLA型を解析した結果、51例中全ての症例がHLA-B*5801保有者であったとの報告がある4)。また、別の研究では、アロプリノールにより中毒性表皮壊死融解症及び皮膚粘膜眼症候群を発症した日本人及びヨーロッパ人において、それぞれ10例中4例(40%)、27例中15例(55%)がHLA-B*5801保有者であったとの報告もある5)6)。なお、HLA-B*5801の保有率は漢民族では20-30%に対し、日本人及びヨーロッパ人では1-2%である。[8.1、11.1.1参照]
15.2 非臨床試験に基づく情報
動物実験において、鉄剤と併用した場合に、本剤の大量投与により、肝の鉄貯蔵量が増加したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
アロプリノール錠50mg「アメル」とザイロリック錠50を、クロスオーバー法によりそれぞれ1錠(アロプリノールとして50mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された7)。
(注)本剤の承認された用法は、食後投与である。
| 判定パラメータ | 参考パラメータ | |||
| AUC(0→8) (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
| アロプリノール錠50mg「アメル」 | 306.50±71.33 | 185.12±82.25 | 1.14±0.36 | 1.08±0.25 |
| ザイロリック錠50 | 294.34±91.00 | 187.02±80.61 | 1.32±0.46 | 0.93±0.17 |
血漿中未変化体濃度(生物学的同等性)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.4 代謝
アロプリノールはキサンチンオキシダーゼにより酸化されて、大部分がオキシプリノールとなる8)。
16.5 排泄
患者に14C-アロプリノール169mg注)を単回経口投与した時、一部は未変化体のまま尿中に排泄され、残りの大部分はオキシプリノールに代謝されて、48時間で投与量の約40%が尿中に排泄された。また、投与量の20%が未吸収のまま48時間で糞便中に排泄された9)(外国人データ)。
注)本剤の承認用量は、1日200〜300mgを2〜3回に分けて食後投与である。
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. アロプリノール
22. 包装
<アロプリノール錠50mg「アメル」>
100錠[10錠(PTP)×10]
<アロプリノール錠100mg「アメル」>
100錠[10錠(PTP)×10]
1,200錠[10錠(PTP)×120]
23. 主要文献
- Fujii T,et al., Jpn J Pharmacol., 22, 201-206, (1972) »PubMed
- 厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
- Garbe E,et al., Arch Ophthalmol., 116, 1652-1656, (1998) »PubMed
- Hung SI,et al., Proc Natl Acad Sci USA., 102, 4134-4139, (2005) »PubMed
- Kaniwa N,et al., Pharmacogenomics., 9, 1617-1622, (2008) »PubMed
- Lonjou C,et al., Pharmacogenetics and Genomics., 18, 99-107, (2008) »PubMed
- 社内資料:生物学的同等性試験[錠50mg]
- Elion GB,et al., Am J Med., 45, 69-77, (1968) »PubMed
- Elion GB,et al., Biochem Pharmacol., 15, 863-880, (1966) »PubMed
- Elion GB, Ann Rheum Dis., 25, 608-614, (1966) »PubMed
- 伊佐真之,他, 日本薬理学雑誌, 64, 108-122, (1968) »PubMed
- Rundles RW,et al., Trans Assoc Am Physicians., 76, 126-140, (1963)
- 大島良雄,他, リウマチ, 8, 349-370, (1968)
- Rundles RW, Ann Rheum Dis., 25, 615-620, (1966) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
共和薬品工業株式会社
お問い合わせ窓口
〒530-0005
大阪市北区中之島3-2-4
電話:0120-041-189
FAX:06-6121-2858
製品情報問い合わせ先
共和薬品工業株式会社
お問い合わせ窓口
〒530-0005
大阪市北区中之島3-2-4
電話:0120-041-189
FAX:06-6121-2858
26. 製造販売業者等
26.1 製造販売元
共和薬品工業株式会社
大阪市北区中之島3-2-4