医薬品情報
| 総称名 | ケイキサレート |
|---|---|
| 一般名 | ポリスチレンスルホン酸ナトリウム |
| 欧文一般名 | Sodium Polystyrene Sulfonate |
| 製剤名 | ポリスチレンスルホン酸ナトリウム(Sodium Polystyrene Sulfonate)製剤 |
| 薬効分類名 | 高カリウム血症改善剤 |
| 薬効分類番号 | 2190 |
| ATCコード | V03AE01 |
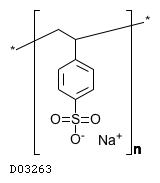
| KEGG DRUG |
D03263
ポリスチレンスルホン酸ナトリウム
|
| KEGG DGROUP |
DG01160
ポリスチレンスルホン酸
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第2版)

|
4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ケイキサレートドライシロップ76% | KAYEXALATE DRYSYRUP 76% | 鳥居薬品 | 2190009R1025 | 8.2円/g |
4. 効能または効果
急性および慢性腎不全による高カリウム血症
6. 用法及び用量
通常、成人1日量39.24g(ポリスチレンスルホン酸ナトリウムとして1日量30g)を2〜3回に分け、その1回量を水50〜150mLに懸濁し、経口投与する。症状に応じて適宜増減。
8. 重要な基本的注意
過量投与を防ぐため、血清カリウム値及び血清ナトリウム値を測定しながら投与すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| ジギタリス製剤 ジギトキシン ジゴキシン ラナトシドC 等 | ジギタリス中毒の症状(食欲不振、悪心・嘔吐、下痢、不整脈、頻脈、高度の徐脈、視覚異常、眩暈、頭痛、失見当識、錯乱など)の増強があらわれることがある。 併用する際には血清カリウム値の観察を十分に行い、慎重に投与する。また、血清カリウム値低下に伴う上記症状の出現時には、減量又は投与を中止する。 | 本剤により血清カリウム値が低下するとジギタリス製剤が心筋Na+-K+ATPaseに結合しやすくなり、ジギタリス製剤の効果が強く発現する。 |
| アルミニウム、マグネシウム又はカルシウムを含有する制酸剤又は緩下剤1)2)3) ケイ酸アルミニウム 水酸化アルミニウムゲル・水酸化マグネシウム スクラルファート水和物 沈降炭酸カルシウム 等 | 本剤の作用が減弱するおそれがある。 併用により全身性アルカローシスなどの症状があらわれたとの報告がある。 | 含有陽イオンと結合し、本剤のカリウム交換能が低下する。腸管内に分泌された重炭酸ナトリウムが再吸収される。 |
| 甲状腺ホルモン製剤 レボチロキシン 等 | 左記薬剤の効果が減弱することがあるので、服用時間をずらすなど注意すること。 | 本剤が消化管内で左記薬剤を吸着することにより、これらの薬剤の吸収を阻害すると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 心不全誘発(頻度不明)
ナトリウム摂取を制限するなど十分に注意すること。
11.1.2 腸穿孔、腸潰瘍、腸壊死(いずれも頻度不明)
11.2 その他の副作用
| 頻度不明 | |
| 循環器 | 浮腫注1)、血圧上昇注1) |
| 電解質 | 低カルシウム血症注2)、低カリウム血症 |
| 消化器 | 下痢、悪心、嘔吐、便秘、胃部不快感、食欲不振、腹痛 |
| その他 | 眩暈、倦怠感 |
14. 適用上の注意
14.1 薬剤投与時の注意
本剤の投与では、消化管への蓄積を避けるため、便秘を起こさせないよう注意すること。また、便秘を起こした場合は、浣腸等の適切な方法を用いて排便させること。[11.1.2参照]
16. 薬物動態
16.2 吸収
ラットの小腸を用いた反転腸管による吸収実験において、ポリスチレンスルホン酸ナトリウム及びそのアルカリ分解物の吸収は認められなかった。
16.5 排泄
ラットにポリスチレンスルホン酸ナトリウムを1.1g/匹経口投与し、糞便中の排泄量を測定した結果、24時間後に75.4%、48時間後に95.1%の排泄を認めた。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床成績
| 疾患名\投与経路 | 経口投与 |
| 慢性腎不全による高カリウム血症 | 92.3 (239/258) |
| 急性腎不全による高カリウム血症 | 81.5 (22/27) |
| 計 | 91.6 (261/285) |
注)ケイキサレート散の臨床成績
18. 薬効薬理
18.1 作用機序
本剤は陽イオン交換樹脂のナトリウム型で、腸管内、特に結腸において樹脂のナトリウムの一部はカリウムに置換され、樹脂が糞便あるいは浣腸剤と共に排泄される際、カリウムは体内から除去される。
18.2 カリウム交換容量
18.3 血清カリウム値低下作用
18.4 生物学的同等性試験
19. 有効成分に関する理化学的知見
19.1. ポリスチレンスルホン酸ナトリウム
20. 取扱い上の注意
20.1 本剤は、2包でポリスチレンスルホン酸ナトリウム5g(ケイキサレート散1包)に相当する。また、本剤1.308gがポリスチレンスルホン酸ナトリウム1gに相当する。
20.2 本剤は内服専用剤であるため、注腸投与しないこと。
20.3 誤用に注意し、小児の手のとどかない所に保管すること。
20.4 開封後は、湿気を避けて保存すること。
22. 包装
3.27g×84包(2包×42)
23. 主要文献
- E.T.Schroeder, Gastroenterology., 56 (5), 868-874, (1969)
- P.C.Fernandez et al., N.Engl.J.Med., 286 (1), 23-24, (1972)
- H.A.Ziessman, South.Med.J., 69 (4), 497-499, (1976)
- A.Rashid et al., Am.J.Surg.Pathol., 21 (1), 60-69, (1997)
- B.B.Gerstman et al., Am.J.Kidney Dis., 20 (2), 159-161, (1992)
- 第十八改正 日本薬局方
- R.B.Flinn et al., N.Engl.J.Med., 264 (3), 111-115, (1961)
- 柴垣昌功ほか, medicina., 6 (12), 1388-1392, (1969)
- 高須照夫, 日本臨牀, 28 (7), 1941-1946, (1970) »PubMed
- 社内資料:ケイキサレートドライシロップ76%とケイキサレート散の同等性試験
24. 文献請求先及び問い合わせ先
文献請求先
鳥居薬品株式会社
お客様相談室
〒103-8439
東京都中央区日本橋本町3-4-1
電話:0120-316-834
FAX:03-3231-6890
製品情報問い合わせ先
鳥居薬品株式会社
お客様相談室
〒103-8439
東京都中央区日本橋本町3-4-1
電話:0120-316-834
FAX:03-3231-6890
26. 製造販売業者等
26.1 製造販売元
鳥居薬品株式会社
東京都中央区日本橋本町3-4-1
26.2 提携先
sanofi