医薬品情報
| 総称名 | ラディオガルダーゼ |
|---|---|
| 一般名 | ヘキサシアノ鉄(II)酸鉄(III)水和物 |
| 製剤名 | ヘキサシアノ鉄(II)酸鉄(III)水和物カプセル |
| 薬効分類名 | 放射性セシウム体内除去剤 タリウム及びタリウム化合物解毒剤 |
| 薬効分類番号 | 3929 |
| KEGG DRUG |
D09736
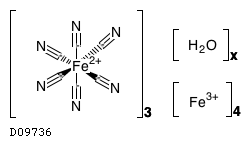
ヘキサシアノ鉄 (II) 酸鉄 (III) 水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年1月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ラディオガルダーゼカプセル500mg | RADIOGARDASE Capsules | 日本メジフィジックス | 392900XM1028 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
○放射性セシウムによる体内汚染の軽減
○タリウム及びタリウム化合物による中毒
6. 用法及び用量
通常,1回6カプセル(ヘキサシアノ鉄(II)酸鉄(III)水和物として3g)を1日3回経口投与する。
なお,患者の状態,年齢,体重に応じて適宜増減する。
なお,患者の状態,年齢,体重に応じて適宜増減する。
7. 用法及び用量に関連する注意
<放射性セシウムによる体内汚染の軽減>
7.1 治療開始後は糞便中及び尿中,又は全身の放射能をシンチレーションカウンタ等で適宜測定し,本剤の投与継続の必要性を検討すること。
7.2 ゴイアニア事故における本剤の投与量を参考に,用量及び投与回数を適宜増減すること。[17.1.2参照]
<タリウム及びタリウム化合物による中毒>
7.3 臨床症状によるほか,必要に応じて血中,尿中又は糞便中のタリウム量を測定し,本剤の投与継続の必要性を検討すること。
8. 重要な基本的注意
8.1 投与中は定期的に血清カリウム濃度の検査を行い,必要に応じてカリウムを補充するなど適切な処置を行うこと。
8.2 本剤の服用により体内で遊離した鉄が吸収され,蓄積される可能性があるため投与期間中は血清フェリチン等の推移を適宜確認することが望ましい。
8.3 便秘を呈する場合は本剤の効果が十分得られない可能性があるため,排便状態を確認し,必要に応じて下剤等の使用を考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 不整脈又は電解質異常がある患者
低カリウム血症により症状が増悪するおそれがある。
9.1.2 消化管の蠕動運動の障害のある患者
本剤と結合した放射性セシウムが消化管局所に滞留することで放射線障害を発現するおそれがある。
9.1.3 鉄代謝異常の患者
長期投与により本剤に含まれる鉄が蓄積するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し,授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。[17.1参照]
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 副腎皮質ホルモン製剤,グリチルリチン製剤,利尿剤 | 低カリウム血症を増悪させるおそれがある。 | これらの薬剤はカリウムの排泄作用を有する。 |
| テトラサイクリン系抗生物質 | テトラサイクリン系抗生物質の吸収が減弱するおそれがある。 | 本剤中の鉄イオンと難溶性のキレートを形成し,テトラサイクリン系抗生物質の吸収を阻害する可能性がある。 |
11. 副作用
11.2 その他の副作用
| 頻度不明 | |
| 消化器 | 便秘,胃部不快感 |
| その他 | 低カリウム血症 |
13. 過量投与
ゴイアニアの事故において,本剤が1日に20g投与された場合に,胃部不快感が認められたとの報告がある1)。
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 本剤容器の蓋はチャイルドロックを施しているため,蓋を強く押しながらねじって開封すること。
14.1.2 本剤の服用により,便が青みを帯びる場合がある。また,便の変色により血便等の発現を見逃すおそれがあるので,注意すること。
14.2 薬剤投与後の注意
排泄物等の取扱いについて,医療法その他の放射線防護に関する法令,関連する告示及び通知等を遵守し,適正に処理すること。[放射性セシウムと結合した本剤は主に糞便中に排泄されるため,本剤投与中の患者の糞便中には放射性セシウムが高濃度に含まれる可能性がある。]
16. 薬物動態
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 放射性セシウムの排泄促進作用
放射性セシウム(137Cs:37kBq)を経口摂取した外国人健康成人7例に,本剤1.0gを1日3回投与したとき,放射性セシウムの生物学的半減期の平均値が94日から31日に短縮した4)。
17.1.2 放射性セシウムの被曝事故
ブラジルのゴイアニアの事故において,放射性セシウム(137Cs)の体内汚染を受けた46例に本剤が投与された。成人及び若年成人には本剤1日3〜10g,小児には本剤1日1〜3gが,2,3又は6回に分けて経口投与された(投与間隔は投与量に応じて調整され,最短2時間間隔で投与された)。46例中25例について,本剤の投与中及び投与中止後の放射性セシウムの生物学的半減期に関するデータが得られ(表1),本剤投与による放射性セシウムの生物学的半減期の短縮が認められた。また,本剤の投与により糞便中/尿中の放射能排泄比が増加した1)。[7.2,9.7参照]
| 年齢 | 投与量 | 患者数a) | 137Csの生物学的半減期b) | 平均短縮率 | |
| 投与中 | 投与中止後 | ||||
| 19歳以上 | 10g/日 | 5例 | 26±6日 | 80±15日 | 69% |
| 6g/日 | 10例 | 25±15日 | |||
| 3g/日 | 6例 | 25±9日 | |||
| 12〜14歳 | 10g/日 | 5例 | 30±12日 | 62±14日 | 46% |
| 4〜9歳 | 3g/日 | 7例 | 24±3日 | 42±4日 | 43% |
17.1.3 タリウムの排泄促進作用
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. ヘキサシアノ鉄(II)酸鉄(III)水和物
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
36カプセル[1容器]
23. 主要文献
- IAEA-TECDOC-1009, 37-45, (1998), (IAEA,Austria)
- Nielsen P,et al., Arzneimittelforschung, 38, 1469-1471, (1988) »PubMed
- Nielsen P,et al., Z Naturforsch, 45c, 681-690, (1990)
- Stroemme A, Symposium on Diagnosis and Treatment of Deposited Radionuclides, 329-332, (1968), (Excerpta Medica Foundation)
- Pelclova D,et al., Human & Experimental Toxicology, 28, 263-272, (2009)
- Miller MA,et al., Hospital Pharmacy, 40, 796-797, (2005)
- Le Gall B,et al., Biochimie, 88, 1837-1841, (2006) »PubMed
- Heydlauf H, Eur J Pharmacol, 6, 340-344, (1969) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日本メジフィジックス株式会社
メディカルインフォメーション担当
〒136-0075
東京都江東区新砂3丁目4番10号
電話:0120-07-6941(フリーダイヤル)
製品情報問い合わせ先
日本メジフィジックス株式会社
メディカルインフォメーション担当
〒136-0075
東京都江東区新砂3丁目4番10号
電話:0120-07-6941(フリーダイヤル)
25. 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
日本メジフィジックス株式会社
東京都江東区新砂3丁目4番10号
26.2 提携先
HEYL Chemisch-pharmazeutische Fabrik GmbH & Co.KG
Berlin Germany
その他の説明
参考情報
容器の開け方
本剤容器の蓋はチャイルドロックを施しているため,次の手順で開封すること。
ステップ1:蓋を強く押す。
ステップ2:押しながら蓋をねじる。