医薬品情報
| 総称名 | ファモチジン |
|---|---|
| 一般名 | ファモチジン |
| 欧文一般名 | Famotidine |
| 薬効分類名 | H2受容体拮抗剤 |
| 薬効分類番号 | 2325 |
| ATCコード | A02BA03 |
| KEGG DRUG |
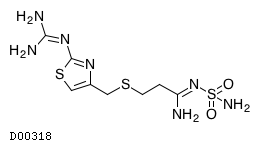
D00318
ファモチジン
|
| KEGG DGROUP |
DG01481
ヒスタミンH2受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年3月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ファモチジン静注10mg「日新」 (後発品) | Famotidine IV 10mg"NISSIN" | 日新製薬-山形 | 2325401A4020 | 100円/管 | 処方箋医薬品注) |
| ファモチジン静注20mg「日新」 (後発品) | Famotidine IV 20mg"NISSIN" | 日新製薬-山形 | 2325401A3031 | 100円/管 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
○上部消化管出血(消化性潰瘍、急性ストレス潰瘍、出血性胃炎による)
○侵襲ストレス(手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・広範囲熱傷)による上部消化管出血の抑制
○麻酔前投薬
5. 効能または効果に関連する注意
<侵襲ストレスによる上部消化管出血の抑制>
手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・広範囲熱傷により、ストレス潰瘍が発症する可能性が考えられる場合に限り使用すること。
なお、広範囲熱傷はBurn Index10以上の熱傷を目安とすること。
なお、広範囲熱傷はBurn Index10以上の熱傷を目安とすること。
6. 用法及び用量
<上部消化管出血(消化性潰瘍、急性ストレス潰瘍、出血性胃炎による)、Zollinger-Ellison症候群、侵襲ストレス(手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・広範囲熱傷)による上部消化管出血の抑制>
通常、成人にはファモチジンとして1回20mgを1日2回(12時間毎)緩徐に静脈内投与する。又は輸液に混合して点滴静注する。なお、年齢・症状により適宜増減する。上部消化管出血及びZollinger-Ellison症候群では、一般的に1週間以内に効果の発現をみるが、内服可能となった後は経口投与に切りかえる。侵襲ストレス(手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・広範囲熱傷)による上部消化管出血の抑制では、術後集中管理又は集中治療を必要とする期間(手術侵襲ストレスは3日間程度、その他の侵襲ストレスは7日間程度)の投与とする。
<麻酔前投薬>
通常、成人にはファモチジンとして1回20mgを麻酔導入1時間前に緩徐に静脈内投与する。
7. 用法及び用量に関連する注意
7.1 腎機能低下患者への投与法
8. 重要な基本的注意
8.1 治療にあたっては経過を十分に観察し、病状に応じ治療上必要最小限の使用(手術侵襲ストレスは3日間程度、その他は7日間程度)にとどめ、本剤で効果がみられない場合には他の療法に切りかえること。なお、血液像、肝機能、腎機能等に注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
症状が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中に移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
本剤を減量するか投与間隔を延長するなど慎重に投与すること。本剤は主として腎臓から排泄されるが、高齢者では、腎機能が低下していることが多いため血中濃度が持続するおそれがある。
10. 相互作用
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(各0.1%未満)
ショック、アナフィラキシー(呼吸困難、全身潮紅、血管浮腫<顔面浮腫、咽頭浮腫等>、蕁麻疹等)があらわれることがある。
11.1.2 再生不良性貧血、汎血球減少、無顆粒球症、溶血性貧血(いずれも頻度不明)、血小板減少(0.1%未満)
再生不良性貧血、汎血球減少、無顆粒球症、溶血性貧血、血小板減少(初期症状として全身倦怠感、脱力、皮下・粘膜下出血、発熱等)があらわれることがあるので、定期的に血液検査を実施し、異常が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.4 肝機能障害、黄疸(いずれも頻度不明)
AST・ALT等の上昇、黄疸があらわれることがある。
11.1.5 横紋筋融解症(頻度不明)
高カリウム血症、ミオグロビン尿、血清逸脱酵素の著明な上昇、筋肉痛等が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.6 QT延長、心室頻拍(Torsades de Pointesを含む)、心室細動(いずれも頻度不明)
特に心疾患(心筋梗塞、弁膜症、心筋症等)を有する患者においてあらわれやすいので、投与後の患者の状態に十分注意すること。[9.1.1参照]
11.1.7 意識障害、痙攣(いずれも頻度不明)
意識障害、全身痙攣(痙直性、間代性、ミオクローヌス性)があらわれることがある。特に腎機能障害を有する患者においてあらわれやすいので、注意すること。[9.2参照]
11.1.8 間質性腎炎、急性腎障害(いずれも頻度不明)
初期症状として発熱、皮疹、腎機能検査値異常(BUN・クレアチニン上昇等)等が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.9 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常等を伴う間質性肺炎があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.10 不全収縮
発現頻度は、承認時までの臨床試験及び使用成績調査結果に基づいている。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹・皮疹、蕁麻疹(紅斑)、顔面浮腫 | ||
| 血液 | 白血球減少 | 好酸球増多 | |
| 消化器 | 便秘 | 下痢・軟便、口渇、悪心・嘔吐、腹部膨満感、食欲不振、口内炎 | |
| 循環器 | 血圧上昇、顔面潮紅、耳鳴 | 徐脈、頻脈、房室ブロック | |
| 肝臓 | AST上昇、ALT上昇、Al-P上昇 | 総ビリルビン上昇、LDH上昇 | 肝機能異常、黄疸 |
| 精神神経系 | 全身倦怠感、無気力感、頭痛、眠気、不眠 | 可逆性の錯乱状態、うつ状態、痙攣、意識障害 | |
| 内分泌系 | 月経不順、女性化乳房 |
14. 適用上の注意
14.1 薬剤調製時の注意
インジケーター(酸素検知剤:ピンク色の錠剤)及び脱酸素剤は品質保持を目的に封入しているため、薬液に溶解しないこと。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与が胃癌による症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
16. 薬物動態
16.1 血中濃度
静脈注射後の血漿中からの消失半減期は約2.6時間である4)。
16.4 代謝
ヒトにファモチジンを投与したときの尿中の代謝物は、S-oxide体のみであり、投与量に対するS-oxide体の割合は静脈内投与で2〜8%である5)。
16.5 排泄
ファモチジン投与後24時間までの未変化体の尿中排泄率は、静脈内投与で71.5〜72.3%である5)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
| 平均Ccr値(mL/min/1.48m2) | t1/2β(h) | AUC(ng・h/mL) | Ctot(mL/min) | |
| 98.9 | n=7 | 2.59 | 857 | 412 |
| 73.8 | n=9 | 2.92 | 909 | 381 |
| 49.2 | n=5 | 4.72 | 1424 | 242 |
| 10.3 | n=10 | 12.07 | 4503 | 84 |
17. 臨床成績
17.1 有効性及び安全性に関する試験
<上部消化管出血>
17.1.1 国内臨床試験
静脈内投与による一般臨床試験(52例)、用量検討試験(84例)及び二重盲検比較試験(59例)の概要は次のとおりである6)7)8)9)。
| 上部消化管出血 | 止血効果: 静脈内投与による止血効果は91.2%(165/181)を示し、二重盲検比較試験によってファモチジンの有用性が認められた。用量検討試験及び二重盲検比較試験における1回20mg、1日2回静脈内投与での止血効果は91.0%(91/100)で、投与36時間以内の止血率は66.0%(66/100)、3日以内の止血率は84.0%(84/100)であった。 止血維持効果: 静脈内投与での止血後経口投与(1回20mg1日2回)による止血維持効果は良好であった。 |
<侵襲ストレス(手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・広範囲熱傷)による上部消化管出血の抑制>
17.1.2 国内臨床試験
<麻酔前投薬>
17.1.3 国内臨床試験
静脈内投与による非盲検比較試験(81例)の概要は次のとおりである18)。
| 麻酔前投薬 | 麻酔時における誤嚥性肺炎の防止を目的とした臨床試験において、ファモチジン1回20mg静脈内投与は、有意に胃液量を減少させ、胃液pHを上昇させた。 |
18. 薬効薬理
18.1 作用機序
胃粘膜壁細胞のH2受容体を遮断し、胃酸分泌を抑制することにより、上部消化管出血の止血、誤嚥性肺炎を防止する4)。
18.2 ヒトでの作用
18.2.1 胃酸及びペプシン分泌抑制作用
(1)基礎及び各種刺激分泌
健康成人又は消化性潰瘍患者における、基礎及び各種刺激剤投与時の2時間胃酸及びペプシン分泌量は、20mg経口投与によりそれぞれ71.6〜99.6%、29.5〜96.9%抑制される。
(2)夜間分泌
健康成人又は消化性潰瘍患者の午後11時から午前6時までの7時間胃酸及びペプシン分泌量は、20mg経口投与によりそれぞれ91.8%、71.8%抑制される24)。
(3)24時間分泌・胃内pH
健康成人の胃酸分泌量は、20mg経口投与により、午後8時から12時間以上にわたり抑制される。胃内pHは、投与12時間後まで4.2〜6.0の範囲で推移する25)。
(4)血中濃度と胃酸分泌抑制作用
血中濃度と胃酸分泌抑制率との間には正の相関関係がみられ、胃酸分泌量を50%抑制するときの血中濃度は13ng/mLである26)。
18.2.2 胃粘膜血流量に及ぼす影響
0.1〜0.2mg/kgの静脈内投与では健康成人の胃粘膜血流量を増加させる傾向が認められる27)。
18.2.3 胃粘液分泌に及ぼす影響
潰瘍患者の胃液中粘液物質濃度に影響を及ぼさない28)。
18.2.4 胃内容排出能に及ぼす影響
胃潰瘍、十二指腸潰瘍患者に20mg経口投与した場合、胃排出能に影響を及ぼさない29)。
18.2.5 肝血行動態に及ぼす影響
20mg静脈内投与は、健康成人の肝血流量、門脈血流量に影響を及ぼさない30)。
18.2.6 血中ガストリン値に及ぼす影響
胃潰瘍、十二指腸潰瘍患者に20mg1日2回、1〜2カ月経口投与した場合、血中ガストリン値に影響を及ぼさない31)。
18.2.7 血中プロラクチン等に及ぼす影響
20mg静脈内投与、20mg1日2回4週間経口投与は、健康成人、消化性潰瘍患者の血中プロラクチン、性腺刺激ホルモン、性ホルモン値に影響を及ぼさない32)。
18.3 動物での作用
19. 有効成分に関する理化学的知見
19.1. ファモチジン
20. 取扱い上の注意
20.1 使用時までフィルム包装を開封しないこと。
20.2 フィルム包装開封後は速やかに使用すること。
20.3 フィルム包装が破損又は剥がれている時、インジケーター(酸素検知剤:ピンク色の錠剤)が青紫〜青色に変色している時、フィルムの内面に水滴が認められる時は使用しないこと。
22. 包装
<ファモチジン静注10mg「日新」>
10mL×10管(ルアーフィットポリエチレンボトル)[脱酸素剤、酸素検知剤入り]
<ファモチジン静注20mg「日新」>
20mL×10管(ルアーフィットポリエチレンボトル)[脱酸素剤、酸素検知剤入り]
20mL×50管(ルアーフィットポリエチレンボトル)[脱酸素剤、酸素検知剤入り]
23. 主要文献
- 猪爪信夫 他, Prog.Med., 16 (11), 2897-2903, (1996)
- 二木芳人, Today's Therapy, 18 (2), 42-45, (1994)
- Lim,S.G.et al., Aliment.Pharmacol.Ther., 7, 317-321, (1993) »PubMed
- 第十八改正日本薬局方解説書, C4521-4524, (2021), (東京:廣川書店)
- Echizen,H.et al., Clin.Pharmacokinet, 21 (3), 178-194, (1991) »PubMed
- 城所 仂 他, 薬理と治療, 11 (9), 3659-3674, (1983)
- 三好秋馬 他, 診療と新薬, 20 (10), 2123-2132, (1983)
- 小坂義種 他, 薬理と治療, 11 (10), 4327-4335, (1983)
- 城所 仂 他, 薬理と治療, 12 (1), 333-351, (1984)
- 田村 晃 他, 新薬と臨床, 39 (12), 2485-2493, (1990)
- 川島康生 他, 新薬と臨床, 39 (11), 2238-2248, (1990)
- 大塚敏文 他, 薬理と治療, 19 (1), 339-349, (1991)
- 青木照明 他, 医学と薬学, 25 (1), 233-242, (1991)
- 大塚敏文 他, 診療と新薬, 27 (12), 2235-2254, (1990)
- 青木照明 他, 医学と薬学, 25 (2), 499-513, (1991)
- 大塚敏文 他, 診療と新薬, 28 (1), 1-12, (1991)
- 大塚敏文 他, 診療と新薬, 28 (1), 13-23, (1991)
- 玉井 直 他, 臨床薬理, 18 (3), 553-564, (1987) »DOI
- 大江慶治 他, 内科宝函, 30 (11), 365-378, (1983)
- 大江慶治 他, 内科宝函, 31 (1), 11-24, (1984)
- 渡部洋三 他, 薬理と治療, 11 (9), 3637-3650, (1983)
- 三好秋馬 他, 基礎と臨床, 17 (9), 2909-2916, (1983)
- 三好秋馬 他, 基礎と臨床, 17 (9), 2917-2927, (1983)
- 大江慶治 他, 内科宝函, 31 (2), 51-62, (1984)
- 池添逸夫 他, 日本消化器病学会雑誌, 80 (Suppl.), 694, (1983)
- Miwa,M.et al., Int.J.Clin.Pharmacol.Ther.Toxicol., 22 (4), 214-217, (1984) »PubMed
- 宮本二郎 他, 薬理と治療, 11 (9), 3651-3658, (1983)
- 森 治樹, 日本臨床, 42 (1), 150-157, (1984) »PubMed
- 原沢 茂 他, 診療と新薬, 20 (9), 1859-1864, (1983)
- 大西久仁彦 他, 薬理と治療, 11 (10), 4301-4304, (1983)
- 三好秋馬 他, 新薬と臨床, 32 (9), 1383-1395, (1983)
- 早川 滉 他, 臨床成人病, 14 (4), 571-577, (1984)
- 竹田正明 他, 基礎と臨床, 17 (9), 2878-2882, (1983)
- Takeda,M.et al., Eur.J.Pharmacol., 91 (4), 371-376, (1983) »PubMed
- Takagi,T.et al., Arch.Int.Pharmacodyn.Ther., 256 (1), 49-58, (1982) »PubMed
- 竹田正明 他, 基礎と臨床, 18 (12), 6125-6134, (1984)
- 西田明登 他, 基礎と臨床, 25 (1), 223-232, (1991)
- Takeda,M.et al., Arzneimittel-Forschung, 32 (7), 734-737, (1982) »PubMed
- 岡部 進 他, 応用薬理, 27 (3), 563-569, (1984)
- Ishihara,Y.et al., Digestion, 27 (1), 29-35, (1983) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日新製薬株式会社
安全管理部
〒994-0069
山形県天童市清池東二丁目3番1号
電話:023-655-2131
FAX:023-655-3419
Email:d-info@yg-nissin.co.jp
製品情報問い合わせ先
日新製薬株式会社
安全管理部
〒994-0069
山形県天童市清池東二丁目3番1号
電話:023-655-2131
FAX:023-655-3419
Email:d-info@yg-nissin.co.jp
26. 製造販売業者等
26.1 製造販売元
日新製薬株式会社
山形県天童市清池東二丁目3番1号