医薬品情報
| 総称名 | エダラボン |
|---|---|
| 一般名 | エダラボン |
| 欧文一般名 | Edaravone |
| 薬効分類名 | 脳保護剤(フリーラジカルスカベンジャー) |
| 薬効分類番号 | 1190 |
| ATCコード | N07XX14 |
| KEGG DRUG |
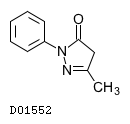
D01552
エダラボン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エダラボン点滴静注30mgバッグ「アイロム」 (後発品) | EDARAVONE for I.V.Infusion | ネオクリティケア製薬 | 1190401G1042 | 1468円/キット | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重篤な腎機能障害のある患者[9.2.1参照]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
脳梗塞急性期に伴う神経症候、日常生活動作障害、機能障害の改善
6. 用法及び用量
通常、成人に1回1袋(エダラボンとして30mg)を、30分かけて1日朝夕2回の点滴静注を行う。
発症後24時間以内に投与を開始し、投与期間は14日以内とする。
発症後24時間以内に投与を開始し、投与期間は14日以内とする。
8. 重要な基本的注意
8.1 本剤の投与は、本剤に関する十分な知識及び脳梗塞の治療経験を持つ医師との連携のもとで行うこと。
8.2 投与に際しては、患者又はそれに代わり得る適切な者に対して、本剤の副作用等について十分な説明を行うこと。
8.3 急性腎障害又は腎機能障害の増悪、重篤な肝障害、播種性血管内凝固症候群(DIC)があらわれ、致命的な経過をたどることがある。これらの症例では、腎機能障害、肝機能障害、血液障害等を同時に発現する重篤な症例が報告されている。
8.4 症状に応じてより短期間で投与を終了することも考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 脱水のある患者
9.1.2 感染症のある患者
9.1.3 心疾患のある患者
9.1.4 高度な意識障害(Japan Coma Scale 100以上:刺激しても覚醒しない)のある患者
投与に際してはリスクとベネフィットを十分考慮すること。致命的な経過をたどる例が多く報告されている。[11.1.1参照]
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
9.2.2 腎機能障害のある患者(重篤な腎機能障害のある患者を除く)
9.3 肝機能障害患者
9.5 妊婦
投与しないことが望ましい。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)において本剤の乳汁移行が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
副作用があらわれた場合は投与を中止し、適切な処置を行うこと。一般に高齢者では生理機能が低下しており、致命的な経過をたどる例が多く報告されている。
10. 相互作用
10.2 併用注意
| 抗生物質 (セファゾリンナトリウム、セフォチアム塩酸塩、ピペラシリンナトリウム等) [8.3.2参照] | 腎機能障害が増悪するおそれがあるので、併用する場合には頻回に腎機能検査を実施するなど観察を十分に行うこと。 | 機序は不明であるが、本剤は主として腎臓から排泄されるため、腎排泄型の抗生物質との併用により、腎臓への負担が増強する可能性が考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 急性腎障害(0.26%)、ネフローゼ症候群(0.02%)
11.1.2 劇症肝炎(頻度不明)、肝機能障害(0.24%)、黄疸(頻度不明)
劇症肝炎等の重篤な肝炎、AST、ALT、ALP、γ-GTP、LDH、ビリルビン等の著しい上昇を伴う肝機能障害、黄疸があらわれることがある。[8.3.1参照]
11.1.3 血小板減少(0.08%)、顆粒球減少(頻度不明)[8.3.1参照]
11.1.4 播種性血管内凝固症候群(DIC)(0.08%)
播種性血管内凝固症候群を疑う血液所見や症状があらわれた場合には、投与を中止し、適切な処置を行うこと。[8.3.1参照]
11.1.5 急性肺障害(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常を伴う急性肺障害があらわれることがあるので、患者の状態を十分に観察し、このような症状があらわれた場合には、投与を中止し、副腎皮質ホルモン剤投与等の適切な処置を行うこと。
11.1.6 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇が認められた場合には、投与を中止し、適切な処置を行うこと。[8.3.1参照]
11.1.7 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(蕁麻疹、血圧低下、呼吸困難等)があらわれることがある。
注)発現頻度は、製造販売後調査の結果を含む。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹、腫脹、紅斑(多形滲出性紅斑等) | 発赤、膨疹、そう痒感 | |
| 血液 | 赤血球減少、白血球増多、白血球減少、ヘマトクリット値減少、ヘモグロビン減少、血小板増加、血小板減少 | ||
| 注射部位 | 注射部発疹、注射部発赤腫脹 | ||
| 肝臓 | ALT上昇 | 総ビリルビン値上昇、AST上昇、LDH上昇、ALP上昇、γ-GTP上昇、ビリルビン尿 | ウロビリノーゲン陽性 |
| 腎臓 | BUN上昇、血清尿酸上昇、血清尿酸低下、蛋白尿、血尿 | 多尿、クレアチニン上昇 | |
| 消化器 | 嘔気 | 嘔吐 | |
| その他 | 発熱、血清コレステロール上昇、血清コレステロール低下、トリグリセライド上昇、血清総蛋白減少、CK上昇、CK低下、血清カリウム低下、尿中ブドウ糖陽性、熱感、血圧上昇、血清カルシウム低下 | 血清カリウム上昇、頭痛 |
14. 適用上の注意
14.1 全般的な注意
針は、ゴム栓の刻印部(凹部)に垂直にゆっくり刺すこと。斜めに刺した場合、削り片の混入及び液漏れの原因となるおそれがある。また、針は同一箇所に繰り返し刺さないこと。
14.2 薬剤調製時の注意
14.2.1 抗痙攣薬の注射液(ジアゼパム、フェニトインナトリウム等)と混合しないこと。白濁することがある。
14.2.2 カンレノ酸カリウムと混合しないこと。白濁することがある。
14.3 薬剤投与時の注意
14.3.1 高カロリー輸液、アミノ酸製剤との混合又は同一経路からの点滴はしないこと。混合すると、その後エダラボンの濃度低下を来すことがある。
14.3.2 容器の目盛りは目安として使用すること。
14.3.3 通気針は不要である。
14.3.4 残液は使用しないこと。
15. その他の注意
15.1 臨床使用に基づく情報
本剤投与中あるいは投与後に、脳塞栓の再発又は脳内出血が認められたとの報告がある。
15.2 非臨床試験に基づく情報
24時間持続静注によるイヌ28日間投与毒性試験において、60mg/kg/日以上の用量で、イヌ39週間反復経口投与毒性試験において、100mg/kg/日以上の用量で、四肢動作の限定、歩行異常等の症状及び病理組織検査における末梢神経及び脊髄(背索)の神経線維変性が観察されたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.3 分布
16.3.1 蛋白結合率
エダラボン(5μM及び10μM)のヒト血清蛋白及びヒト血清アルブミンに対する結合率は、92%及び89〜91%であった3)(in vitro)。
16.4 代謝
16.5 排泄
健康成人男子及び健康高齢者にエダラボンを1日2回2日間反復点滴静脈内投与(0.5mg/kg/30分×2回/日)したとき、各回投与12時間までに尿中に未変化体として0.7〜0.9%、代謝物として71.0〜79.9%が排泄された1)。
16.6 特定の背景を有する患者
16.6.1 高齢者
16.6.2 腎機能障害者
軽度腎機能障害者(6例)、中等度腎機能障害者(8例)又は腎機能正常者(8例)にエダラボン30mgを60分かけて単回点滴静脈内投与したときの血漿中未変化体濃度の推移から求めたパラメータは次のとおりである。腎機能障害の程度に伴い、t1/2の平均値は延長する傾向が認められた。腎機能正常者に対するCmax、AUC0-∞の幾何平均値の比(90%信頼区間)はそれぞれ軽度腎機能障害患者で1.150(0.967-1.366)、1.202(0.991-1.457)、中等度腎機能障害者で1.247(1.063-1.463)、1.294(1.083-1.547)であった5)。[8.3.1、9.2.2参照]
| 薬物動態パラメータ | 軽度腎機能障害 | 中等度腎機能障害 | 腎機能正常 |
| Cmax(ng/mL) | 545.4±92.59 | 593.2±115.4 | 475.9±95.32 |
| AUC0-∞(ng・h/mL) | 771.0±153.6 | 826.4±149.4 | 644.9±153.1 |
| t1/2(h) | 5.38±6.04 | 7.31±5.83 | 2.87±0.38 |
軽度:eGFRが60〜89mL/分/1.73m2、中等度:eGFRが30〜59mL/分/1.73m2、正常:eGFR≧90mL/分/1.73m2
16.6.3 肝機能障害者
(1)重度肝機能障害者(6例)又は肝機能正常者(6例)にエダラボン30mgを60分かけて単回点滴静脈内投与したときの血漿中未変化体濃度の推移から求めたパラメータは次のとおりである。Cmax及びAUC0-∞の幾何平均値の比(90%信頼区間)はそれぞれ1.203(0.819-1.766)及び1.190(0.835-1.696)であった6)。[8.3.1、9.3参照]
| 薬物動態パラメータ | 重度肝機能障害 | 肝機能正常 |
| Cmax(ng/mL) | 347.6±146.8 | 280.3±101.0 |
| AUC0-∞(ng・h/mL) | 497.0±183.8 | 416.3±165.0 |
| t1/2(h) | 3.88±1.12 | 9.51±6.62 |
重度:Child-Pugh分類C
(2)軽度肝機能障害者(8例)、中等度肝機能障害者(6例)又は肝機能正常者(8例)にエダラボン30mgを60分かけて単回点滴静脈内投与したときの血漿中未変化体濃度の推移から求めたパラメータは次のとおりである。肝機能正常者に対するCmax、AUC0-∞の幾何平均値の比(90%信頼区間)はそれぞれ軽度肝機能障害患者で1.203(0.992-1.458)、1.065(0.860-1.320)、中等度肝機能障害者で1.235(1.003-1.521)、1.142(0.906-1.440)であった6)。[8.3.1、9.3参照]
| 薬物動態パラメータ | 軽度肝機能障害 | 中等度肝機能障害 | 肝機能正常 |
| Cmax(ng/mL) | 538.1±182.3 | 533.4±88.57 | 429.0±44.36 |
| AUC0-∞(ng・h/mL) | 727.6±262.0 | 751.5±148.3 | 654.3±107.2 |
| t1/2(h) | 3.14±0.58 | 4.37±1.90 | 4.70±6.92 |
軽度:Child-Pugh分類A、中等度:Child-Pugh分類B
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
発症後72時間以内の脳梗塞急性期患者※1を対象にエダラボン30mg又はプラセボを1日2回14日間投与した、プラセボ対照の二重盲検群間比較試験において、エダラボン群は神経症候、日常生活動作障害の改善を示した。最終全般改善度における改善率の差は32.8%(95%信頼区間:20.3〜45.3%)であり、順位和検定でエダラボン群とプラセボ群の間に有意な差が認められた。この内、発症後24時間以内に投与を開始した患者においては、最終全般改善度における改善率の差は48.2%(95%信頼区間:26.6〜69.7%)であった。全症例及び発症後24時間で層別した最終全般改善度(改善以上)は表1のとおりである。
| エダラボン群 | プラセボ群 | |
| 全症例発症後72時間以内に投与を開始 | 64.8%(81例/125例) | 32.0%(40例/125例) |
| 発症後24時間以内に投与を開始 | 73.8%(31例/42例) | 25.6%(10例/39例) |
また、全症例における3ヵ月以内の退院日(入院中の場合は3ヵ月後)に評価した機能予後(modified Rankin Scale)に関し、エダラボン群とプラセボ群の間に順位和検定で有意な差が認められ、「全く症状なし」の率においてエダラボン群がプラセボ群を上回った(エダラボン群:22.3%(27例/121例)、プラセボ群:10.0%(12例/120例))。この内、発症後24時間以内に投与を開始した患者において、「全く症状なし」の率はエダラボン群:34.1%(14例/41例)、プラセボ群:2.9%(1例/35例)であった。
副作用発現頻度はエダラボン群で7.2%(9/125例)及びプラセボ群で11.2%(14/125例)であった。エダラボン群の主な副作用は、発疹1.6%(2/125例)、肝機能障害3.2%(4/125例)であった7)8)9)10)11)。
なお、両群とも基礎治療として濃グリセリン・果糖を原則併用している。
副作用発現頻度はエダラボン群で7.2%(9/125例)及びプラセボ群で11.2%(14/125例)であった。エダラボン群の主な副作用は、発疹1.6%(2/125例)、肝機能障害3.2%(4/125例)であった7)8)9)10)11)。
なお、両群とも基礎治療として濃グリセリン・果糖を原則併用している。
17.1.2 国内臨床試験
※1 ラジカット注30mg開発時の臨床試験は主として発症後72時間以内の脳梗塞急性期患者を対象に実施された。この全症例を対象にした解析において有効性が認められたが、層別解析の結果、発症後24時間以内に投与を開始した症例において効果がより顕著であったため、承認された用法及び用量においては「発症後24時間以内に投与を開始」と設定された。
注)ラジカット注30mgの承認された用法及び用量の抜粋:発症後24時間以内に投与を開始し、投与期間は14日以内とする。
18. 薬効薬理
18.1 作用機序
ヒドロキシルラジカル(・OH)等のフリーラジカルが虚血に伴う脳血管障害の主要な1因子であることは数多く報告されており、虚血ないし虚血−再開通時にはアラキドン酸代謝系の亢進等によりフリーラジカルの産生が増加する。このフリーラジカルは細胞膜脂質の不飽和脂肪酸を過酸化することにより細胞膜傷害ひいては脳機能障害を引き起こす17)18)。
エダラボンは、フリーラジカルを消去し脂質過酸化を抑制する作用により、脳細胞(血管内皮細胞・神経細胞)の酸化的傷害を抑制する19)。
すなわち、脳梗塞急性期に対しては、脳浮腫、脳梗塞、神経症候、遅発性神経細胞死などの虚血性脳血管障害の進展(増悪)を抑制することにより脳保護作用を示す20)21)。
エダラボンは、フリーラジカルを消去し脂質過酸化を抑制する作用により、脳細胞(血管内皮細胞・神経細胞)の酸化的傷害を抑制する19)。
すなわち、脳梗塞急性期に対しては、脳浮腫、脳梗塞、神経症候、遅発性神経細胞死などの虚血性脳血管障害の進展(増悪)を抑制することにより脳保護作用を示す20)21)。
18.2 脳梗塞急性期に対する作用
18.2.1 脳神経保護作用
NAA(N-acetyl aspartate)は特異的生存神経細胞マーカーであり、脳梗塞発症直後より減少し24時間以降傷害組織ではほとんど観察されなくなるとされる。脳梗塞急性期患者にエダラボンを投与し、1H-MRS(magnetic resonance spectroscopy)により測定したところ、梗塞巣のNAAは、第28病日においてコントロール群に比し有意に保持されていた14)。
18.2.2 梗塞周辺領域血流量低下に対する抑制作用
脳梗塞急性期患者8例にエダラボンを投与し、133Xe-SPECT(シングルフォトン断層法)により局所脳血流量を測定したところ、機能予後(modified Rankin Scale)の良好例5例では、梗塞周辺領域の局所脳血流量低下に対して抑制作用が認められた15)。
18.3 脳虚血モデルに対する脳保護作用
18.3.1 脳浮腫及び脳梗塞抑制作用、神経症候軽減作用
18.3.2 遅発性神経細胞死抑制作用
前脳虚血再開通モデル(ラット)において、再開通直後の静脈内投与(3mg/kg)は、遅発性神経細胞死を抑制した28)。
18.4 フリーラジカル消去作用
18.4.1 フリーラジカル消去作用及び脂質過酸化抑制作用
18.4.2 脳虚血モデルに対するフリーラジカル消去作用
18.4.3 フリーラジカルによる血管内皮細胞傷害に対する抑制作用
1μMから15-HPETE(hydroperoxyeicosatetraenoic acid)による培養血管内皮細胞傷害を抑制した32)(in vitro)。
19. 有効成分に関する理化学的知見
19.1. エダラボン
20. 取扱い上の注意
20.1 製品の安定性を保持するため脱酸素剤を封入しているので、外袋は使用直前まで開封しないこと。また、開封後は速やかに使用すること。
20.2 以下の場合には使用しないこと。
・外袋が破損しているときや内容液が漏出しているとき。
・インジケーター(ピンクの錠剤)が青紫〜青色に変色しているとき。
・内容液に混濁、析出物など異常が認められたとき。
・ゴム栓部のシールがはがれているとき。
20.3 インジケーター(ピンクの錠剤)を正常に働かせるため直射日光にさらさないこと。
22. 包装
100mL×10袋(プラスチック製バッグ入)
23. 主要文献
- 横田愼一,他, 臨床薬理, 28 (3), 693-702, (1997) »DOI
- 血漿中濃度(ラジカット注:2001年4月4日承認、申請資料概要へ.3.(1).3))
- 山本美奈子,他, 薬理と治療, 25 (Suppl.7), 1755-1763, (1997)
- 代謝(ラジカット注:2001年4月4日承認、申請資料概要へ.3)
- Nakamaru Y,et al., Clin Ther., 42 (9), 1699-1714, (2020) »PubMed
- Nakamaru Y,et al., Clin Ther., 42 (8), 1467-1482, (2020) »PubMed
- Otomo E,et al., Cerebrovasc Dis., 15 (3), 222-229, (2003)
- 第III相試験(ラジカット注:2001年4月4日承認、申請資料概要ト.1.(4))
- 第III相試験 層別解析(ラジカット注:2001年4月4日承認、申請資料概要ト.1.(4).5))
- 第III相試験 機能予後(ラジカット注:2001年4月4日承認、申請資料概要ト.1.(4).6))
- 第III相試験 副作用及び臨床検査値(ラジカット注:2001年4月4日承認、申請資料概要ト.1.(4).7))
- 大友英一,他, Ther Res., 19 (4), 1311-1332, (1998)
- MCI-186脳梗塞急性期研究会, 医学のあゆみ, 185 (11), 841-863, (1998)
- Houkin K,et al., J Stroke Cerebrovasc Dis., 7 (5), 315-322, (1998) »PubMed
- 三森研自,他, Ther Res., 19 (4), 1333-1345, (1998)
- 有効性のまとめ(ラジカット注:2001年4月4日承認、申請資料概要ト.3.(1))
- 起源又は発見の経緯及び開発の経緯(ラジカット注:2001年4月4日承認、申請資料概要イ.1)
- 虚血脳内の脂質過酸化障害とラジカル消去薬の生理的意義(ラジカット注:2001年4月4日承認、申請資料概要ホ.序言)
- In vitro試験(ラジカット注:2001年4月4日承認、申請資料概要ホ.1.(1))
- In vivo試験 脳虚血保護作用(ラジカット注:2001年4月4日承認、申請資料概要ホ.1)
- 臨床効果を支持する作用(ラジカット注:2001年4月4日承認、申請資料概要ホ.2.(3))
- Mizuno A,et al., Gen Pharmacol., 30 (4), 575-578, (1998) »PubMed
- Abe K,et al., Stroke., 19 (4), 480-485, (1988) »PubMed
- 高松康雄,他, 薬理と治療, 25 (Suppl.7), 1785-1791, (1997)
- Kawai H,et al., J Pharmacol Exp Ther., 281 (2), 921-927, (1997) »PubMed
- Nishi H,et al., Stroke., 20 (9), 1236-1240, (1989) »PubMed
- 薬理作用(ラジカット注:2001年4月4日承認、審査報告書2.ホ)
- Yamamoto T,et al., Brain Res., 762 (1-2), 240-242, (1997) »PubMed
- 渡辺俊明,他, 薬理と治療, 25 (Suppl.7), 1691-1698, (1997)
- Yamamoto Y,et al., Redox Rep., 2 (5), 333-338, (1996) »PubMed
- 脳ホモジネートでの脂質過酸化に対する抑制作用(ラジカット注:2001年4月4日承認、申請資料概要ホ.1.(1).1))
- Watanabe T,et al., Prostaglandins Leukot Essent Fatty Acids., 33 (1), 81-87, (1988) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ネオクリティケア製薬株式会社
学術情報フリーダイヤル
〒112-0006
東京都文京区小日向4-2-8
電話:0120-265-321
FAX:03-5840-5145
製品情報問い合わせ先
ネオクリティケア製薬株式会社
学術情報フリーダイヤル
〒112-0006
東京都文京区小日向4-2-8
電話:0120-265-321
FAX:03-5840-5145
26. 製造販売業者等
26.1 製造販売元
ネオクリティケア製薬株式会社
神奈川県厚木市旭町四丁目18番29号