医薬品情報
| 総称名 | ネキシウム |
|---|---|
| 一般名 | エソメプラゾールマグネシウム水和物 |
| 欧文一般名 | Esomeprazole Magnesium Hydrate |
| 製剤名 | エソメプラゾールマグネシウム水和物カプセル |
| 薬効分類名 | プロトンポンプ・インヒビター |
| 薬効分類番号 | 2329 |
| ATCコード | A02BC05 |
| KEGG DRUG |
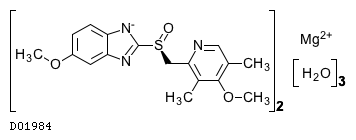
D01984
エソメプラゾールマグネシウム水和物
|
| KEGG DGROUP |
DG01646
プロトンポンプ阻害薬 (PPI)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(用量変更、用法変更)(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ネキシウムカプセル10mg | Nexium capsules | アストラゼネカ | 2329029M1027 | 34.7円/カプセル | 処方箋医薬品注) |
| ネキシウムカプセル20mg | Nexium capsules | アストラゼネカ | 2329029M2023 | 59.3円/カプセル | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対して過敏症の既往歴のある患者
2.2 アタザナビル硫酸塩、リルピビリン塩酸塩を投与中の患者[10.1参照]
4. 効能または効果
<ネキシウムカプセル10mg>
○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、非びらん性胃食道逆流症、Zollinger-Ellison症候群、非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制、低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制
○下記におけるヘリコバクター・ピロリの除菌の補助
<ネキシウムカプセル20mg>
○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、Zollinger-Ellison症候群、非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制、低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制
○下記におけるヘリコバクター・ピロリの除菌の補助
5. 効能または効果に関連する注意
<非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
5.1 関節リウマチ、変形性関節症等における疼痛管理等のために非ステロイド性抗炎症薬を長期継続投与している患者を投与対象とし、投与開始に際しては、胃潰瘍又は十二指腸潰瘍の既往を確認すること。
<低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
5.2 血栓・塞栓の形成抑制のために低用量のアスピリンを継続投与している患者を投与対象とし、投与開始に際しては、胃潰瘍又は十二指腸潰瘍の既往を確認すること。
<ヘリコバクター・ピロリの除菌の補助>
5.3 進行期胃MALTリンパ腫に対するヘリコバクター・ピロリ除菌治療の有効性は確立していない。
5.4 特発性血小板減少性紫斑病に対しては、ガイドライン等を参照し、ヘリコバクター・ピロリ除菌治療が適切と判断される症例にのみ除菌治療を行うこと。
5.5 早期胃癌に対する内視鏡的治療後胃以外には、ヘリコバクター・ピロリ除菌治療による胃癌の発症抑制に対する有効性は確立していない。
5.6 ヘリコバクター・ピロリ感染胃炎に用いる際には、ヘリコバクター・ピロリが陽性であること及び内視鏡検査によりヘリコバクター・ピロリ感染胃炎であることを確認すること。
6. 用法及び用量
<ネキシウムカプセル10mg>
胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison症候群
成人
通常、成人にはエソメプラゾールとして1回20mgを1日1回経口投与する。なお、通常、胃潰瘍、吻合部潰瘍では8週間まで、十二指腸潰瘍では6週間までの投与とする。
小児
通常、1歳以上の幼児及び小児にはエソメプラゾールとして、体重20kg未満では1回10mgを、体重20kg以上では症状に応じて1回10〜20mgを1日1回経口投与する。なお、通常、胃潰瘍、吻合部潰瘍では8週間まで、十二指腸潰瘍では6週間までの投与とする。
逆流性食道炎
成人
通常、成人にはエソメプラゾールとして1回20mgを1日1回経口投与する。なお、通常、8週間までの投与とする。
さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回10〜20mgを1日1回経口投与する。
さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回10〜20mgを1日1回経口投与する。
小児
通常、1歳以上の幼児及び小児にはエソメプラゾールとして、体重20kg未満では1回10mgを、体重20kg以上では症状に応じて1回10〜20mgを1日1回経口投与する。なお、通常、8週間までの投与とする。
さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回10mgを1日1回経口投与する。なお、体重20kg以上では症状に応じて1回20mgまで増量できる。
さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回10mgを1日1回経口投与する。なお、体重20kg以上では症状に応じて1回20mgまで増量できる。
非びらん性胃食道逆流症
成人
通常、成人にはエソメプラゾールとして1回10mgを1日1回経口投与する。なお、通常、4週間までの投与とする。
小児
通常、1歳以上の幼児及び小児にはエソメプラゾールとして、1回10mgを1日1回経口投与する。なお、通常、4週間までの投与とする。
非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制
成人
通常、成人にはエソメプラゾールとして1回20mgを1日1回経口投与する。
小児
通常、1歳以上の幼児及び小児にはエソメプラゾールとして、1回10mgを1日1回経口投与する。
低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制
成人
通常、成人にはエソメプラゾールとして1回20mgを1日1回経口投与する。
小児
通常、1歳以上の幼児及び小児にはエソメプラゾールとして、1回10mgを1日1回経口投与する。
ヘリコバクター・ピロリの除菌の補助
通常、成人にはエソメプラゾールとして1回20mg、アモキシシリン水和物として1回750mg(力価)及びクラリスロマイシンとして1回200mg(力価)の3剤を同時に1日2回、7日間経口投与する。なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、1回400mg(力価)1日2回を上限とする。
プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの3剤投与によるヘリコバクター・ピロリの除菌治療が不成功の場合は、これに代わる治療として、通常、成人にはエソメプラゾールとして1回20mg、アモキシシリン水和物として1回750mg(力価)及びメトロニダゾールとして1回250mgの3剤を同時に1日2回、7日間経口投与する。
<ネキシウムカプセル20mg>
胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison症候群
成人
通常、成人にはエソメプラゾールとして1回20mgを1日1回経口投与する。なお、通常、胃潰瘍、吻合部潰瘍では8週間まで、十二指腸潰瘍では6週間までの投与とする。
小児
通常、体重20kg以上の幼児及び小児にはエソメプラゾールとして、症状に応じて1回10〜20mgを1日1回経口投与する。なお、通常、胃潰瘍、吻合部潰瘍では8週間まで、十二指腸潰瘍では6週間までの投与とする。
逆流性食道炎
成人
通常、成人にはエソメプラゾールとして1回20mgを1日1回経口投与する。なお、通常、8週間までの投与とする。
さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回10〜20mgを1日1回経口投与する。
さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回10〜20mgを1日1回経口投与する。
小児
通常、体重20kg以上の幼児及び小児にはエソメプラゾールとして、症状に応じて1回10〜20mgを1日1回経口投与する。なお、通常、8週間までの投与とする。
さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回10mgを1日1回経口投与する。なお、体重20kg以上では症状に応じて1回20mgまで増量できる。
さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回10mgを1日1回経口投与する。なお、体重20kg以上では症状に応じて1回20mgまで増量できる。
非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制
通常、成人にはエソメプラゾールとして1回20mgを1日1回経口投与する。
低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制
通常、成人にはエソメプラゾールとして1回20mgを1日1回経口投与する。
ヘリコバクター・ピロリの除菌の補助
通常、成人にはエソメプラゾールとして1回20mg、アモキシシリン水和物として1回750mg(力価)及びクラリスロマイシンとして1回200mg(力価)の3剤を同時に1日2回、7日間経口投与する。なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、1回400mg(力価)1日2回を上限とする。
プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの3剤投与によるヘリコバクター・ピロリの除菌治療が不成功の場合は、これに代わる治療として、通常、成人にはエソメプラゾールとして1回20mg、アモキシシリン水和物として1回750mg(力価)及びメトロニダゾールとして1回250mgの3剤を同時に1日2回、7日間経口投与する。
7. 用法及び用量に関連する注意
ネキシウムカプセル10mg
<逆流性食道炎>
7.1 成人又は体重20kg以上の幼児及び小児において、1日10mgの維持療法で再発が認められた場合は1日20mgで再治療を行うこと。
7.2 最大用量での維持療法で再発が認められた場合、あるいは予期せぬ体重減少、吐血、嚥下障害等の症状が認められた場合は、改めて内視鏡検査等を行い、その結果に基づいて他の適切な治療法に切り替えることを考慮すること。
<非びらん性胃食道逆流症>
7.3 投与開始2週後を目安として効果を確認し、症状の改善傾向が認められない場合には、酸逆流以外の原因が考えられるため他の適切な治療への変更を考慮すること。
ネキシウムカプセル20mg
<逆流性食道炎>
7.1 成人又は体重20kg以上の幼児及び小児において、1日10mgの維持療法で再発が認められた場合は1日20mgで再治療を行うこと。
7.2 最大用量での維持療法で再発が認められた場合、あるいは予期せぬ体重減少、吐血、嚥下障害等の症状が認められた場合は、改めて内視鏡検査等を行い、その結果に基づいて他の適切な治療法に切り替えることを考慮すること。
8. 重要な基本的注意
<効能共通>
8.1 血液像、肝機能、腎機能等に注意すること。
<逆流性食道炎>
8.2 逆流性食道炎の維持療法については、再発・再燃を繰り返す患者に対し投与することとし、本来維持療法の必要のない患者に投与することのないよう留意すること。また、維持療法中は定期的に内視鏡検査を実施するなど観察を十分に行うことが望ましい。なお、次の事項に十分注意すること。
8.2.1 再発の既往歴、症状の程度等を考慮して維持療法の用量を選択すること。
8.2.2 寛解状態が良好に保たれていると判断された場合は休薬又は減量を考慮すること。
8.2.3 定期的に血液像、肝機能、腎機能等の検査を行うことが望ましい。
<非びらん性胃食道逆流症>
8.3 投与に際しては問診により胸やけ、胃液逆流感等の酸逆流症状が繰り返し見られること(1週間あたり2日以上)を確認の上投与すること。なお、本剤の投与が胃癌、食道癌等の悪性腫瘍及び他の消化器疾患による症状を隠蔽することがあるので、内視鏡検査等によりこれらの疾患でないことを確認すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者
9.3 肝機能障害患者
肝代謝型であり、血中濃度が高くなるおそれがある。[16.4参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のラセミ体であるオメプラゾールでの動物実験(ラット経口5mg/kg)で、母乳中へ移行することが報告されている。
9.7 小児等
国内において、低出生体重児、新生児、乳児を対象とした臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始すること。一般に肝機能、その他生理機能が低下していることが多い。
10. 相互作用
相互作用序文
主として肝代謝酵素CYP2C19及び一部CYP3A4で代謝される。
また、胃酸分泌抑制作用により、併用薬剤の吸収を上昇又は低下させることがある。[16.4参照]
また、胃酸分泌抑制作用により、併用薬剤の吸収を上昇又は低下させることがある。[16.4参照]
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
10.2 併用注意
| ジアゼパム フェニトイン シロスタゾール [16.7.1参照] | これらの薬剤の作用を増強することがある。 | 本剤は主に肝臓のチトクロームP450系薬物代謝酵素CYP2C19で代謝されるため、本剤と同じ代謝酵素で代謝される薬物の代謝、排泄を遅延させるおそれがある。 |
| ワルファリン [16.7.1参照] | 抗凝血作用を増強し、出血に至るおそれがある。プロトロンビン時間国際標準比(INR)値等の血液凝固能の変動に十分注意しながら投与すること。 | 本剤は主に肝臓のチトクロームP450系薬物代謝酵素CYP2C19で代謝されるため、本剤と同じ代謝酵素で代謝される薬物の代謝、排泄を遅延させるおそれがある。 |
| タクロリムス水和物 | タクロリムスの作用を増強することがある。 | 相互作用の機序は不明である。 これらの薬剤の血中濃度が上昇することがある。 |
| メトトレキサート | 高用量のメトトレキサートを投与する場合は、一時的に本剤の投与を中止することを考慮すること。 | 相互作用の機序は不明である。 これらの薬剤の血中濃度が上昇することがある。 |
| ジゴキシン メチルジゴキシン | これらの薬剤の作用を増強することがある。 | 本剤の胃酸分泌抑制作用によりジゴキシンの加水分解が抑制され、ジゴキシンの血中濃度が上昇することがある。 |
| イトラコナゾール | これらの薬剤の作用を減弱することがある。 | 本剤の胃酸分泌抑制作用によりこれらの薬剤の溶解性が低下し、これらの薬剤の血中濃度が低下することがある。 |
| チロシンキナーゼ阻害剤 ゲフィチニブ ニロチニブ エルロチニブ | これらの薬剤の作用を減弱することがある。 | 本剤の胃酸分泌抑制作用によりこれらの薬剤の溶解性が低下し、これらの薬剤の血中濃度が低下することがある。 |
| ボリコナゾール | 本剤の作用を増強することがある。 | 本剤のCmax及びAUCが増加するおそれがある。ボリコナゾールは本剤の代謝酵素(CYP2C19及びCYP3A4)を阻害することが考えられる。 |
| ネルフィナビルメシル酸塩 | ネルフィナビルの作用を減弱することがある。 | 相互作用の機序は不明である。 ネルフィナビルの血中濃度が低下することがある。 |
| セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | 本剤の作用を減弱することがある。 | セイヨウオトギリソウが本剤の代謝酵素(CYP2C19及びCYP3A4)を誘導し、本剤の代謝が促進され血中濃度が低下することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(血管浮腫、気管支痙攣等)があらわれることがある。
11.1.2 汎血球減少症、無顆粒球症、溶血性貧血(いずれも頻度不明)、血小板減少(1%未満)
11.1.3 劇症肝炎、肝機能障害、黄疸、肝不全(いずれも頻度不明)
11.1.4 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.5 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.6 間質性腎炎、急性腎障害(いずれも頻度不明)
腎機能検査値(BUN、クレアチニン等)に注意すること。
11.1.7 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があらわれることがある。
11.1.8 低ナトリウム血症(頻度不明)
11.1.9 錯乱状態(頻度不明)
錯乱、激越、攻撃性、幻覚等があらわれることがある。
11.1.10 視力障害(頻度不明)
頻度は成人を対象としたカプセル剤の臨床試験(初回承認時及びアジア共同第III相比較試験)に基づき算出している。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹、皮膚炎、そう痒症、蕁麻疹 | 光線過敏、多形紅斑 | |
| 消化器 | 腹痛、下痢、嘔吐、便秘、口内炎、カンジダ症、口渇 | 鼓腸、悪心、顕微鏡的大腸炎(collagenous colitis、lymphocytic colitis) | |
| 肝臓 | 肝酵素上昇 | ||
| 血液 | 白血球数減少 | ||
| 精神神経系 | 頭痛、錯感覚、傾眠、浮動性めまい | 不眠症、うつ病 | |
| その他 | CK上昇、回転性めまい、女性化乳房、味覚障害 | 脱毛症、関節痛、筋痛、霧視、倦怠感、多汗症、筋力低下、低マグネシウム血症(低カルシウム血症、低カリウム血症を伴うことがある)、末梢性浮腫 |
| 5%以上 | 1〜5%未満 | 1%未満注) | |
| 過敏症 | 発疹 | ||
| 消化器 | 下痢・軟便(33.4%)、 味覚異常(10.5%) | 口内炎、腹痛、食道炎、悪心、腹部膨満感、便秘 | 舌炎、口渇、十二指腸炎 |
| 肝臓 | AST上昇 | 肝機能異常、ALT上昇、Al-P上昇、ビリルビン上昇、LDH上昇 | |
| 血液 | 好酸球数増多、血小板数減少、貧血、白血球数増多、白血球分画異常 | ||
| 精神神経系 | 頭痛、しびれ感、めまい、睡眠障害 | ||
| その他 | 尿糖陽性 | 尿蛋白陽性、尿酸上昇、総コレステロール上昇、QT延長、発熱、倦怠感、カンジダ症、動悸、霧視 |
12. 臨床検査結果に及ぼす影響
<ヘリコバクター・ピロリの除菌の補助>
エソメプラゾール等のプロトンポンプインヒビターやアモキシシリン水和物、クラリスロマイシン等の抗生物質及びメトロニダゾールの服用中や投与終了直後では、13C-尿素呼気試験の判定が偽陰性になる可能性があるため、13C-尿素呼気試験による除菌判定を行う場合には、これらの薬剤の投与終了後4週以降の時点で実施することが望ましい。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
<効能共通>
15.1.1 本剤の長期投与中に良性の胃ポリープを認めたとの報告がある。
15.1.2 本剤の投与が、胃癌による症状を隠蔽することがあるので、悪性でないことを確認して投与すること。
15.1.3 海外における複数の観察研究で、プロトンポンプインヒビターによる治療において骨粗鬆症に伴う股関節骨折、手関節骨折、脊椎骨折のリスク増加が報告されている。特に、高用量及び長期間(1年以上)の治療を受けた患者で、骨折のリスクが増加した。
15.1.4 海外における主に入院患者を対象とした複数の観察研究で、プロトンポンプインヒビターを投与した患者においてクロストリジウム・ディフィシルによる胃腸感染のリスク増加が報告されている。
<非びらん性胃食道逆流症>
15.1.5 食道内酸逆流の高リスクであると考えられる中高齢者、裂孔ヘルニアを合併する患者のいずれにも該当しない場合には本剤の治療効果が得られにくい可能性がある。
15.2 非臨床試験に基づく情報
15.2.1 ラットに本剤のラセミ体であるオメプラゾール1.7mg/kg以上を2年間経口投与した毒性試験で、胃にカルチノイドの発生がみられたとの報告がある。このカルチノイドの発生にはラットに種特異性が認められている。
15.2.2 ラットに類薬であるランソプラゾール(50mg/kg/日)、アモキシシリン水和物(500mg/kg/日)及びクラリスロマイシン(160mg/kg/日)を併用投与した試験で、母動物での毒性の増強とともに胎児の発育抑制の増強が認められている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性被験者(n=24、CYP2C19のhomo EM、hetero EM及びPM注)が同数)にエソメプラゾール10mg及び20mgを空腹時に単回経口投与したときの未変化体の薬物動態パラメータは以下のとおりである1)。
| 投与量 | Cmax(ng/mL) | Tmax(hr) | AUC(ng・hr/mL) | T1/2(hr) |
| 10mg | 245.2(186.5-328.1) | 2.50(1.00-5.00) | 552.6a)(369.6-822.1) | 1.05a)(0.85-1.31) |
| 20mg | 490.5(369.6-645.9) | 2.75(0.75-6.00) | 1115.6(801.3-1557.8) | 1.08(0.91-1.26) |
16.1.2 反復投与
健康成人男性被験者(n=24、CYP2C19のhomo EM、hetero EM及びPM注)が同数)にエソメプラゾール10mg及び20mgを1日1回5日間反復経口投与したときの第5日目(空腹時投与)の未変化体の薬物動態パラメータは以下のとおりである1)。
| 投与量 | Cmax(ng/mL) | Tmax(hr) | AUC(ng・hr/mL) | T1/2(hr) |
| 10mg | 376.5(283.2-497.4) | 1.75(1.00-5.00) | 822.1a)(556.1-1219.3) | 1.16a)(0.94-1.43) |
| 20mg | 884.2(670.1-1167.5) | 2.25(1.00-4.00) | 2068.9(1485.2-2880.6) | 1.25(1.06-1.46) |
投与3日目及び5日目のCmaxは同程度であったことから、反復投与開始後3日には血漿中エソメプラゾール濃度は定常状態に到達したと考えられた。投与5日目の投与後12時間における血漿中エソメプラゾール濃度はほぼ検出限界以下に低下し、1日1回反復投与しても累積は認められなかった1)。
16.1.3 幼児及び小児
幼児及び小児患者にエソメプラゾール10mg及び20mgを1日1回5日間以上反復経口投与したところ、未変化体の薬物動態パラメータは以下のとおりであった2)。
| 被験者の年齢及び体重 | 投与量 | n | エソメプラゾールの薬物動態パラメータ | |||
| Cmax(ng/mL)a) | Tmax(hr)b) | AUCτ(ng・hr/mL)a) | T1/2(hr)c) | |||
| 1歳以上 10kg以上20kg未満 | 10mg | 9 | 854(141.7%) | 1.58(1.03-5.92) | 2261(42.6%)d) | 0.80±0.18d) |
| 1〜11歳 20kg以上 | 10mg | 10 | 537(110.4%) | 1.52(0.92-6.00) | 995(78.3%)e) | 0.97±0.55e) |
| 20mg | 10 | 1908(41.5%) | 1.47(0.93-1.52) | 3459(50.9%) | 1.08±0.44 | |
| 12〜14歳 20kg以上 | 10mg | 9 | 311(91.7%) | 1.57(0.93-2.95) | 619(105.5%) | 1.37±0.88 |
| 20mg | 10 | 981(51.3%) | 1.75(0.95-3.00) | 1918(33.6%) | 1.06±0.25 | |
注)
homo EM:CYP2C19*1/*1
hetero EM:CYP2C19*1/*2又はCYP2C19*1/*3
PM:CYP2C19*2/*2、CYP2C19*2/*3又はCYP2C19*3/*3
16.3 分布
16.3.1 血漿蛋白結合
エソメプラゾール(添加濃度:2又は20μmol/L)のヒト血漿蛋白結合率(in vitro)は97%であった3)。
16.4 代謝
16.5 排泄
外国人のデータでは、14C標識エソメプラゾールを単回経口投与したとき、投与放射能の約95%が48時間までに尿中及び糞中に排泄され、尿中排泄量と糞便中排泄量の比は約4対1であった3)。
16.6 特定の背景を有する患者
16.6.1 高齢者
外国人のデータでは、エソメプラゾールを健康高齢被験者に1日1回5日間反復経口投与したとき、投与5日目のAUC及びCmaxは非高齢の症候性胃食道逆流症患者よりも高い傾向を示し、幾何平均の比(健康高齢/非高齢患者)は各々1.25(95%信頼区間:0.94-1.67)、1.18(同:0.91-1.52)であった5)。
16.6.2 肝機能障害患者
外国人のデータでは、エソメプラゾールを肝機能障害患者に1日1回5日間反復経口投与したとき、AUCτは、肝機能低下のない症候性胃食道逆流症患者に比べ、重度の肝機能障害患者では約2.3倍高く、軽度〜中程度の肝機能障害患者でもその比は1.4〜1.8であった6)。
16.7 薬物相互作用
16.7.1 ジアゼパム、フェニトイン又はワルファリン
16.7.2 その他の薬剤
17. 臨床成績
17.1 有効性及び安全性に関する試験
<逆流性食道炎>
17.1.1 国内第III相試験(成人)
逆流性食道炎を対象とした二重盲検比較試験では、オメプラゾール20mg、エソメプラゾール20mg又は40mgが1日1回最大8週間投与され、投与8週時のそれぞれの治癒率[95%信頼区間]は87.4%(166/190例)[81.9%、91.4%]、87.3%(165/189例)[81.8%、91.3%]及び90.0%(171/190例)[84.9%、93.5%]であり、オメプラゾール20mgに対する本剤20mg及び40mgの非劣性が認められている13)。
副作用発現頻度は、エソメプラゾール20mg群で7.9%(15/189例)であった。主な副作用は下痢2例(1.1%)、アラニン・アミノトランスフェラーゼ増加2例(1.1%)及び血中クレアチンホスホキナーゼ増加2例(1.1%)であった。
17.1.2 国内第III相試験(成人)
逆流性食道炎の治癒患者を対象とした二重盲検比較試験において、オメプラゾール10mgと比較したエソメプラゾール10mg及び20mgの1日1回24週間投与時における逆流性食道炎の再発抑制効果が認められている14)。
| エソメプラゾール20mg(188例) | エソメプラゾール10mg(188例) | オメプラゾール10mg(187例) | |
| 再発例数 | 14例 | 22例 | 31例 |
| 投与24週後の非再発率a)[95%信頼区間] | 92.0%[88.0〜96.0%] | 87.5%[82.7〜92.4%] | 82.7%[77.2〜88.3%] |
| ハザード比[95%信頼区間] | 0.62[0.32〜1.21] (エソメプラゾール20mg群vsエソメプラゾール10mg群) 0.43[0.23〜0.80] (エソメプラゾール20mg群vsオメプラゾール10mg群) | ||
| p値b) | p=0.158 (エソメプラゾール20mg群vsエソメプラゾール10mg群) p=0.007 (エソメプラゾール20mg群vsオメプラゾール10mg群) | ||
Kaplan-Meier法による逆流性食道炎の非再発率
副作用発現頻度は、エソメプラゾール20mg群で10.8%(15/139例)及びエソメプラゾール10mg群で8.8%(11/125例)であった。主な副作用はエソメプラゾール20mg群で血中クレアチンホスホキナーゼ増加2例(1.4%)であり、エソメプラゾール10mg群で下痢2例(1.6%)及び血中クレアチンホスホキナーゼ増加2例(1.6%)であった。
<非ステロイド性抗炎症薬(NSAID)投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
17.1.3 国内第III相試験(成人)
消化性潰瘍の既往を有するNSAID継続服用患者を対象とした二重盲検比較試験においてエソメプラゾール20mgの1日1回24週間投与時における胃潰瘍又は十二指腸潰瘍の再発抑制効果が認められている15)。
| エソメプラゾール20mg(173例) | プラセボ(168例) | |
| 発症例数 | 6例 | 56例 |
| 投与24週間後の非発症率a)[95%信頼区間] | 96.0%[92.8〜99.1%] | 64.4%[56.8〜71.9%] |
| ハザード比[95%信頼区間] | 0.09[0.04〜0.20] | |
| p値b) | p<0.001 | |
Kaplan-Meier法による胃潰瘍又は十二指腸潰瘍の非発症率
副作用発現頻度は、エソメプラゾール20mg群で13.9%(24/173例)であった。主な副作用は上腹部痛2例(1.2%)、下痢2例(1.2%)、便秘2例(1.2%)、嘔吐2例(1.2%)及び肝機能異常2例(1.2%)であった。
17.1.4 国内長期投与試験(成人)
消化性潰瘍の既往を有するNSAID継続服用患者を対象としたエソメプラゾール20mgの1日1回52週間投与時における胃潰瘍又は十二指腸潰瘍の非発症率は以下のとおりである16)。
| 投与群 | 52週後非発症率(Kaplan-Meier法) |
| エソメプラゾール20mg群(130例) | 95.9% |
副作用発現頻度は、エソメプラゾール20mg群で16.9%(22/130例)であった。主な副作用は筋痙縮2例(1.5%)、γ−グルタミルトランスフェラーゼ増加2例(1.5%)、頭痛2例(1.5%)及び肝機能異常2例(1.5%)であった。
<低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
17.1.5 アジア共同第III相試験(成人)
消化性潰瘍の既往を有する低用量アスピリン(81〜324mg)継続服用患者(日本人患者含む)を対象としたアジア共同第III相比較試験の中間解析における結果において、エソメプラゾール20mgの1日1回48週間投与時における胃潰瘍又は十二指腸潰瘍の再発抑制効果が認められている。さらに、中間解析以降、本薬群の被験者のみ投与が継続され、エソメプラゾール20mgを1日1回最長72週間投与時において、投与72週後の非発症率は96.4%であった。なお、本試験においては本薬群、プラセボ群ともに全例ゲファルナートを併用していた17)。
| エソメプラゾール20mg(182例) | プラセボ(182例) | |
| 発症例数 | 2例 | 22例 |
| 投与48週間後の非発症率a)[96.65%信頼区間] | 98.3%[95.7〜100%] | 81.2%[72.7〜89.7%] |
| ハザード比[96.65%信頼区間] | 0.09[0.02〜0.41] | |
| p値b) | p<0.001 | |
Kaplan-Meier法による胃潰瘍又は十二指腸潰瘍の非発症率(中間解析における結果)
エソメプラゾール20mg投与例数214例中31例(14.5%)の副作用が報告されている。主な副作用は、下痢2例(0.9%)、びらん性胃炎2例(0.9%)、腹部膨満2例(0.9%)、胃ポリープ2例(0.9%)、貧血2例(0.9%)等であった。
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍、非びらん性胃食道逆流症、Zollinger-Ellison症候群ならびに胃潰瘍、十二指腸潰瘍、胃MALTリンパ腫、特発性血小板減少性紫斑病、早期胃癌に対する内視鏡的治療後胃、ヘリコバクター・ピロリ感染胃炎におけるヘリコバクター・ピロリの除菌の補助>
国内において成人対象の臨床試験等の副作用発現頻度が明確となる試験を実施していない。
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍、非びらん性胃食道逆流症、逆流性食道炎、又はZollinger-Ellison症候群>
17.1.6 国内第I/III相試験(幼児及び小児)
胃潰瘍、十二指腸潰瘍、吻合部潰瘍、非びらん性胃食道逆流症、逆流性食道炎、又はZollinger-Ellison症候群を有する又は有する疑いのある1〜14歳の患者50例を対象とした非盲検試験では、体重10kg以上20kg未満(10例[第1群])にエソメプラゾール1回10mgを、20kg以上に1回10mg(1〜11歳10例[第2群]、12〜14歳10例[第4群])又は1回20mg(1〜11歳10例[第3群]、12〜14歳10例[第5群])を1日1回最大8週間投与した。各投与群の上部消化器症状(胸やけ、呑酸、心窩部痛、及び上腹部不快感)は、投与前に症状を有していた患者の40%以上の割合で消失した。また、投与前に内視鏡的評価が実施できた患者のうち病理学的所見が認められた3例すべてにおいて投与後に所見が消失した2)。
| 投与群(投与例数) | 第1群(10例) | 第2群(10例) | 第3群(10例) | 第4群(10例) | 第5群(10例) |
| 年齢 | 1歳以上 | 1〜11歳 | 12〜14歳 | ||
| 体重 | 10kg以上20kg未満 | 20kg以上 | |||
| 投与量 | 10mg | 10mg | 20mg | 10mg | 20mg |
| Kaplan-Meier法による最終時点の累積持続消失率 | |||||
| 胸やけ | 100%(2例) | 66.7%(3例) | 100%(1例) | 50%(2例) | 75%(4例) |
| 呑酸 | 75%(4例) | 100%(3例) | 80%(5例) | 50%(4例) | 100%(4例) |
| 心窩部痛 | 100%(2例) | 50%(6例) | 100%(6例) | 40%(5例) | 57.1%(7例) |
| 上腹部不快感 | 100%(3例) | 66.7%(6例) | 100%(4例) | 60%(5例) | 50%(6例) |
1〜14歳の患者50例中2例(4.0%)の副作用が報告されている。その内訳は、下痢及び腹痛、光線過敏性反応各1例(2.0%)であった。
<逆流性食道炎、非ステロイド性抗炎症薬(NSAID)投与時における胃潰瘍又は十二指腸潰瘍の再発抑制、低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
17.1.7 国内第III相試験(幼児及び小児)
逆流性食道炎が治癒した1〜14歳の患者注1)27例(グループ1[体重10kg以上20kg未満]7例、グループ2[体重20kg以上]20例)及び消化性潰瘍の既往を有するNSAID又は低用量アスピリンを継続服用している1〜14歳の患者22例(グループ3[体重10kg以上20kg未満]9例、グループ4[体重20kg以上]13例)を対象とした非盲検試験では、逆流性食道炎の初期治療後の維持療法及び胃潰瘍又は十二指腸潰瘍の再発抑制における、エソメプラゾールの有効性及び安全性を検討した。本試験では、エソメプラゾール10mg(体重10kg以上20kg未満)又は20mg(体重20kg以上)注2)を逆流性食道炎の初期治療後の維持療法では1日1回24週間、NSAID又は低用量アスピリンを継続服用している患者の胃潰瘍又は十二指腸潰瘍の再発抑制では1日1回32週間投与した注3)。逆流性食道炎の再発割合、胃潰瘍又は十二指腸潰瘍の再発割合は以下のとおりである18)。
注1)逆流性食道炎の初期治療期では、グループ1の患者に10mg1日1回、グループ2の患者に20mg1日1回を8週間投与した。
注2)体重20kg以上の患者については10mgで投与を開始することとしたが、治験責任医師等の判断で症状等に応じ20mgに増量可能とした。
注3)逆流性食道炎の初期治療後の維持療法では最長44週間、NSAID又は低用量アスピリンを継続服用している患者の胃潰瘍又は十二指腸潰瘍の再発抑制では最長52週間まで投与を継続可能とした。
| 投与対象 | 逆流性食道炎が治癒した患者 | 消化性潰瘍の既往を有するNSAID又は低用量アスピリンを継続服用している患者 | ||
| 評価期間 | 24週間 | 32週間 | ||
| 投与群(投与例数)a) | グループ1(7例) | グループ2(19例b)) | グループ3(9例) | グループ4(13例) |
| 体重 | 10kg以上20kg未満 | 20kg以上 | 10kg以上20kg未満 | 20kg以上 |
| 再発例数c) | 0例 | 1例d) | 1例e) | 0例 |
| 再発割合[95%信頼区間]c),f) | 0.0%[0.0〜41.0%] | 5.3%[0.1〜26.0%] | 11.1%[0.3〜48.2%] | 0.0%[0.0〜24.7%] |
グループ1の7例中1例(14.3%)で副作用が報告されている。報告された副作用は、便秘及び好酸球性食道炎各1例(14.3%)であった。グループ2、3及び4で副作用は報告されていない。
18. 薬効薬理
18.1 作用機序
胃壁細胞の細胞膜上に存在する受容体へ各種酸分泌刺激物質が結合することにより、胃壁細胞内において一連の胃酸分泌反応がおきる。この反応の最終過程では、胃壁細胞内からH+を放出し、代わりにK+を取り込むプロトンポンプと呼ばれる酵素が働いている。エソメプラゾールは、このプロトンポンプの働きを阻害することによって、胃酸分泌を抑制する。
18.2 ヒトでの作用
18.2.1 胃内pHに及ぼす影響
18.3 非臨床試験における作用
19. 有効成分に関する理化学的知見
19.1. エソメプラゾールマグネシウム水和物
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ネキシウムカプセル10mg>
100カプセル[10カプセル(PTP)×10]
140カプセル[14カプセル(PTP)×10]
500カプセル[10カプセル(PTP)×50]
700カプセル[14カプセル(PTP)×50]
500カプセル[瓶、バラ、乾燥剤入り]
<ネキシウムカプセル20mg>
100カプセル[10カプセル(PTP)×10]
140カプセル[14カプセル(PTP)×10]
500カプセル[10カプセル(PTP)×50]
700カプセル[14カプセル(PTP)×50]
500カプセル[瓶、バラ、乾燥剤入り]
23. 主要文献
- 社内資料(日本人健康成人被験者における反復投与試験), (2004)
- 社内資料(日本人小児患者における第I/III相試験), (2016)
- Andersson,T.,et al., Clin.Pharmacokinet., 40 (6), 411-426, (2001) »PubMed
- Abelo,A.,et al., Drug Metab.Dispos., 28 (8), 966-972, (2000) »PubMed
- Hasselgren,G.,et al., Clin.Pharmacokinet., 40 (2), 145-150, (2001) »PubMed »DOI
- Sjovall,H.,et al., Eur.J.Gastroenterol.Hepatol., 14 (5), 491-496, (2002) »PubMed »DOI
- Li,XQ.,et al., Drug Metab.Dispos., 32 (8), 821-827, (2004) »PubMed »DOI
- 社内資料(in vitro代謝酵素阻害), (1998)
- Andersson,T.,et al., Clin.Pharmacokinet., 40 (7), 523-537, (2001) »PubMed »DOI
- Hassan-Alin,M.,et al., Clin.Drug Investig., 25 (11), 731-740, (2005) »PubMed »DOI
- 八木道夫, 臨床医薬, 27 (10), 747-756, (2011)
- Niazi,M.,et al., Int.J.Clin.Pharmacol.Ther., 47 (9), 564-569, (2009) »PubMed »DOI
- 木下芳一 他, 日消誌, 110 (2), 234-242, (2013) »DOI
- 木下芳一 他, 日消誌, 110 (8), 1428-1438, (2013) »DOI
- Sugano,K.,et al., Aliment.Pharmacol.Ther., 36 (2), 115-125, (2012) »PubMed »DOI
- Sugano,K.,et al., BMC Gastroenterology., 13, 54, (2013) »PubMed »DOI
- Sugano,K.,et al., Gut., 63 (7), 1061-1068, (2014) »PubMed »DOI
- 社内資料(日本人小児患者における第III相試験), (2023)
- 長嶋浩貴 他, 臨床医薬, 27 (10), 735-746, (2011)
- 社内資料(ウサギH+,K+-ATPaseに対する作用), (1988)
- 社内資料(単離ウサギ胃底腺における作用), (1997)
- 社内資料(胃瘻ラットにおける作用), (2002)
- 社内資料(Heidenhain Pouchイヌにおける作用), (2002)
24. 文献請求先及び問い合わせ先
文献請求先
アストラゼネカ株式会社
メディカルインフォメーションセンター
〒530-0011
大阪市北区大深町3番1号
電話:0120-189-115
製品情報問い合わせ先
アストラゼネカ株式会社
メディカルインフォメーションセンター
〒530-0011
大阪市北区大深町3番1号
電話:0120-189-115
26. 製造販売業者等
26.1 製造販売元
アストラゼネカ株式会社
大阪市北区大深町3番1号