医薬品情報
| 総称名 | トラゼンタ |
|---|---|
| 一般名 | リナグリプチン |
| 欧文一般名 | Linagliptin |
| 製剤名 | リナグリプチン製剤 |
| 薬効分類名 | 胆汁排泄型選択的DPP-4阻害剤 −2型糖尿病治療剤− |
| 薬効分類番号 | 3969 |
| ATCコード | A10BH05 |
| KEGG DRUG |
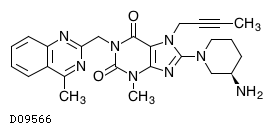
D09566
リナグリプチン
|
| KEGG DGROUP |
DG01601
DPP-4阻害薬
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第3版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トラゼンタ錠5mg | Trazenta Tablets 5mg | 日本ベーリンガーインゲルハイム | 3969014F1024 | 118.9円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 糖尿病性ケトアシドーシス、糖尿病性昏睡又は前昏睡、1型糖尿病の患者[輸液及びインスリンによる速やかな高血糖の是正が必須となるので本剤を投与すべきでない。]
2.3 重症感染症、手術前後、重篤な外傷のある患者[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤の適用はあらかじめ糖尿病治療の基本である食事療法、運動療法を十分に行った上で効果が不十分な場合に限り考慮すること。
6. 用法及び用量
通常、成人にはリナグリプチンとして5mgを1日1回経口投与する。
8. 重要な基本的注意
8.2 急性膵炎があらわれることがあるので、持続的な激しい腹痛、嘔吐等の初期症状があらわれた場合には、速やかに医師の診察を受けるよう患者に指導すること。[11.1.6参照]
8.3 本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、常に投与継続の必要性について注意を払うこと。本剤を3ヵ月投与しても食後血糖に対する効果が不十分な場合、より適切と考えられる治療への変更を考慮すること。
8.4 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.1参照]
8.5 本剤とGLP-1受容体作動薬はいずれもGLP-1受容体を介した血糖降下作用を有している。両剤を併用した際の臨床試験成績はなく、有効性及び安全性は確認されていない。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断された場合にのみ投与を考慮すること。動物実験(ラット及びウサギ)で、胎児への移行が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で、乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
副作用発現に留意し、経過を十分観察しながら慎重に投与すること。
10. 相互作用
相互作用序文
本剤は主に糞中に未変化体のまま排泄される。尿中に排泄される割合は少量である(5%)。[16.5.2参照]
10.2 併用注意
| 糖尿病用薬 スルホニルアミド系薬剤 スルホニルウレア剤 ビグアナイド系薬剤 インスリン製剤 チアゾリジン系薬剤 α-グルコシダーゼ阻害剤 速効型インスリン分泌促進薬 GLP-1受容体作動薬 SGLT2阻害剤等 [11.1.1参照] | 低血糖症状の発現に注意すること。特に、スルホニルウレア剤又はインスリン製剤と併用する場合、低血糖のリスクが増加するため、これらの薬剤の減量を検討すること。 | 糖尿病用薬との併用時には、本剤の血糖降下作用が増強される。 |
| 血糖降下作用を増強する薬剤 サリチル酸剤 モノアミン酸化酵素阻害剤 リトナビル等 [16.7.1参照] | 更に血糖が低下する可能性があるため、併用する場合には、血糖値その他患者の状態を十分観察しながら投与すること。 | 血糖降下作用が増強されるおそれがある。 |
| 血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン リファンピシン等 [16.7.2参照] | 血糖が上昇する可能性があるため、併用する場合には、血糖値その他患者の状態を十分観察しながら投与すること。 | 血糖降下作用が減弱されるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖(2.1%)
11.1.2 イレウス(頻度不明)
腸閉塞を含むイレウスを起こすおそれがある。高度の便秘、腹部膨満、持続する腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[9.1.2参照]
11.1.3 肝機能障害(頻度不明)
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。
11.1.4 類天疱瘡(頻度不明)
水疱、びらん等があらわれた場合には、皮膚科医と相談し、投与を中止するなど適切な処置を行うこと。
11.1.5 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.6 急性膵炎(頻度不明)
持続的な激しい腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.2参照]
11.2 その他の副作用
| 0.3%以上 | 頻度不明 | |
| 過敏症 | じん麻疹、血管性浮腫、気管支収縮 | |
| 代謝及び栄養障害 | 高トリグリセリド血症、高脂血症 | |
| 神経系障害 | 浮動性めまい | |
| 呼吸器、胸郭及び縦隔障害 | 鼻咽頭炎 | 咳嗽 |
| 胃腸障害 | 腹部膨満、便秘、鼓腸、胃腸炎 | 口内炎 |
| 皮膚及び皮下組織障害 | 発疹 | |
| 全身障害及び投与局所様態 | 浮腫 | |
| 臨床検査 | 体重増加、膵酵素(血中アミラーゼ、リパーゼ)増加、肝酵素(AST、ALT)上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。
PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。
PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人男性に、本剤1、2.5、5、10mgを空腹時単回経口投与したとき注)の血漿中濃度推移を図1に、血漿中未変化体の薬物動態パラメータを表1に示す。Cmax及びAUC0-tzは用量比以下の上昇を示した。1)
図1 健康成人男性に空腹時単回経口投与後の平均血漿中濃度推移(算術平均値+標準偏差)
| パラメータ名[単位] | 1mg n=6 | 2.5mg n=6 | 5mg n=6 | 10mg n=6 |
| AUC0-tz[nM・h] | 196(28.8) | 404(15.7) | 582(32.8) | 847(21.5) |
| Cmax[nM] | 4.27(32.1) | 5.92(18.3) | 9.00(40.6) | 23.1(32.1) |
| tmax[h] | 1.77(1.50-4.00) | 2.00(1.00-8.00) | 6.00(2.00-8.00) | 1.50(1.00-6.00) |
| t1/2[h] | 104(14.0) | 96.9(13.3) | 105(8.26) | 113(18.4) |
16.1.2 反復投与
日本人健康成人男性に、本剤5mgを空腹時1日1回12日間反復経口投与したときの血漿中濃度推移を図2に示す。投与3日後には見かけ上一定濃度となり、Cmax及びAUCτから算出した累積係数は1.4以下であった。1)
図2 健康成人男性に5mg空腹時反復経口投与後の平均血漿中濃度推移(算術平均値±標準偏差、n=6)
日本人2型糖尿病患者(159例)に本剤5mgを1日1回26週間投与したときのトラフ時の血漿中濃度の幾何平均値(幾何変動係数%)は6.42nM(33.0%)〜7.15nM(30.5%)であった。2)
注)本剤の国内承認用量は5mgである。
16.2 吸収
16.2.1 バイオアベイラビリティ
外国人健康成人男性に、本剤10mgを錠剤として経口投与したとき注)及び5mgを静脈内投与したとき(各10例)のデータを用いて絶対バイオアベイラビリティを算出した結果、約30%であった(母集団薬物動態解析による推定値)3)(外国人データ)。
16.2.2 食事の影響
健康成人に、本剤5mgを食後に単回投与したとき、Cmaxは約15%低下した。空腹時投与に比べてtmaxは延長し、AUC0-72hには食事の影響はみられなかった。4)(外国人データ)
| パラメータ名[単位] | 空腹時 n=31 | 食後 n=32 |
| AUC0-72h[nM・h] | 229(25.9) | 236(20.0) |
| Cmax[nM] | 7.04(34.0) | 5.97(19.5) |
| tmax[h] | 1.02(0.517-8.00) | 2.99(0.500-8.00) |
注)本剤の国内承認用量は5mgである。
16.3 分布
リナグリプチンのin vitro血漿蛋白結合率は濃度依存的であり、2nMでの98.8%から20nMでの84%へと減少した。30nM以上では蛋白結合率はほぼ一定であった。5)
16.4 代謝
16.4.1 ヒト肝ミクロソーム及びヒト肝細胞による14C-リナグリプチンの代謝は極めて弱いが、主たる代謝物の生成にはCYP3A4が関与しており、他のCYP酵素の関与はなかった6)。リナグリプチンはヒト肝ミクロソームのCYP3A4活性を競合的に阻害するがその程度は弱く(Ki=115μM)、CYP1A1、1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1、4A11を阻害しなかった。また、ヒト肝ミクロソームのCYP3A4を弱〜中程度に不可逆的に阻害した。7)酵素誘導試験においてCYP1A2、2B6、3A4の誘導はみられなかった8)。(in vitro)
16.4.2 健康成人に14C-リナグリプチン10mgを経口投与したとき注)(6例)、血漿中には主に未変化体が認められ(血漿中放射能に対する割合は約62%)、主な代謝物はCYP3A4によって生成するピペリジニル基の水酸化体であった(血漿中放射能に対する割合は約5%)9)(外国人データ)。
注)本剤の国内承認用量は5mgである。
16.5 排泄
16.5.1 日本人健康成人(6例)に本剤5mgを単回経口投与したときの投与24時間後までの尿中未変化体排泄率は約0.6%であった。腎クリアランスは、単回経口投与時は7.09mL/minであった。1)
16.5.2 外国人健康成人(6例)に14C-リナグリプチン10mg注)を単回経口投与したとき9)、投与後96時間までに投与放射能の約5%が尿中に、約80%が糞中に排泄された。尿及び糞中に排泄された放射能に対する未変化体の割合はそれぞれ71%及び91%であった10)(本剤の国内承認用量は5mgである)。(外国人データ)
16.5.3 リナグリプチンはP-糖蛋白の基質であり、弱い阻害剤であった(IC50:約55μM)11)。(in vitro)
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
健康被験者及び軽度、中等度腎機能障害患者に本剤5mg単回及び反復投与、並びに高度及び末期腎機能障害患者に本剤5mg単回投与を行った(表3)。単回投与後のAUC0-24hは健康被験者に比べて、軽度、中等度、高度、末期腎機能障害患者でそれぞれ約1.3倍、1.6倍、1.4倍、1.5倍であり、Cmaxはそれぞれ約1.3倍、1.6倍、1.5倍、1.5倍であった。反復投与後のAUCτ,ssは健康被験者に比べて、軽度及び中等度腎機能障害患者でそれぞれ約1.1倍及び1.7倍であり、Cmax,ssはそれぞれ約1.0倍及び1.5倍であった。
腎機能正常及び高度腎機能障害を有する2型糖尿病患者に本剤5mg反復投与を行った(表4)。高度腎機能障害を有する2型糖尿病患者における反復投与後のAUCτ,ss及びCmax,ssは腎機能正常2型糖尿病患者に比べて、ともに約1.4倍であった。腎機能障害患者の累積係数は健康被験者と同程度であり、尿中排泄率は腎機能障害の程度によらず全群で低かった。12)(外国人データ)
腎機能正常及び高度腎機能障害を有する2型糖尿病患者に本剤5mg反復投与を行った(表4)。高度腎機能障害を有する2型糖尿病患者における反復投与後のAUCτ,ss及びCmax,ssは腎機能正常2型糖尿病患者に比べて、ともに約1.4倍であった。腎機能障害患者の累積係数は健康被験者と同程度であり、尿中排泄率は腎機能障害の程度によらず全群で低かった。12)(外国人データ)
| パラメータ[単位] | 健康被験者注) n=6 | 軽度腎機能障害注) n=6 | 中等度腎機能障害注) n=6 | 高度腎機能障害注) n=6 | 末期腎機能障害注) n=6 |
| AUC0-24h[nM・h] | 101(32.6) | 130(11.0) | 158(44.3) | 142(26.3) | 155(16.8) |
| Cmax[nM] | 7.32(62.7) | 9.20(18.1) | 11.5(89.1) | 10.8(55.0) | 11.0(28.6) |
| fe0-24h[%] | 0.232(183) | 0.332(117) | 0.368(391) | 0.308(104) | − |
| CLR,0-24h[mL/min] | 4.06(119) | 4.50(132) | 4.12(208) | 3.83(77.0) | − |
| パラメータ[単位] | 腎機能正常注) n=11 | 高度腎機能障害注) n=10 |
| AUCτ,ss[nM・h] | 185(22.8) | 262(43.8) |
| Cmax,ss[nM] | 16.7(32.1) | 22.6(60.8) |
16.6.2 肝機能障害患者
健康被験者(n=8)及び軽度(Child-Pughスコア6、n=8)、中等度(Child-Pughスコア7〜9、n=9)、高度(Child-Pughスコア10〜15、n=8)肝機能障害患者に本剤5mg単回投与、並びに健康被験者及び軽度、中等度肝機能障害患者に本剤5mg1日1回7日間反復投与を行った。反復投与後のAUCτ,ssは健康被験者に比べて軽度及び中等度肝機能障害患者でそれぞれ約0.8倍及び0.9倍であり、Cmax,ssは約0.6倍及び0.9倍であった。また、高度肝機能障害患者のAUC0-24hは健康被験者に比べて1.0倍、Cmaxは0.8倍であった。
肝機能障害患者におけるリナグリプチンの曝露は健康被験者よりやや低く(最大36%:軽度肝機能障害患者のCmax,ss)、肝機能の低下に伴う曝露の増加はみられなかった。13)(外国人データ)
肝機能障害患者におけるリナグリプチンの曝露は健康被験者よりやや低く(最大36%:軽度肝機能障害患者のCmax,ss)、肝機能の低下に伴う曝露の増加はみられなかった。13)(外国人データ)
16.6.3 高齢者
日本人2型糖尿病患者(159例)に本剤5mgを1日1回26週間投与したときのトラフ時の血漿中濃度の幾何平均値(幾何変動係数%)は65歳未満で6.57nM(31.1%)、65歳以上で7.66nM(26.9%)であった2)。
16.7 薬物相互作用
16.7.1 リトナビルとの併用
16.7.2 リファンピシンとの併用
16.7.3 シンバスタチンとの併用
健康成人(20例)に本剤10mg1日1回とシンバスタチン(CYP3A4の基質)40mg1日1回6日間併用投与した注)場合、シンバスタチン及びシンバスタチン酸のAUCτ,ss及びCmax,ssは本剤併用投与により10%〜34%上昇した16)(外国人データ)。
16.7.4 メトホルミンとの併用
健康成人(16例)に本剤10mg注)1日1回とメトホルミン(有機カチオントランスポーターで輸送される)850mg1日3回(2550mg/日)3日間併用投与した場合、メトホルミンのAUCτ,ssに本剤併用投与の影響はみられなかったが、Cmax,ssは11%低下した。リナグリプチンのCmax,ssにメトホルミン併用投与の影響はみられなかったが、AUCτ,ssは20%上昇した17)(外国人データ)。
16.7.5 ピオグリタゾンとの併用
健康成人(20例)に本剤10mg注)1日1回とピオグリタゾン(CYP2C8及び3A4で代謝される)45mg1日1回7日間併用投与した場合、リナグリプチンの薬物動態に対するピオグリタゾン併用投与の影響はみられなかった。ピオグリタゾンのAUCτ,ssに本剤併用投与の影響はみられなかったが、Cmax,ssは14%低下した。ピオグリタゾンの活性代謝物であるM-III及びM-IVのAUCτ,ss及びCmax,ssに本剤併用投与の影響はみられなかった。18)(外国人データ)
16.7.6 グリベンクラミドとの併用
健康成人(20例)に本剤5mg1日1回とグリベンクラミド(CYP2C9で代謝される)1.75mg単回併用投与した場合、リナグリプチンの薬物動態に対するグリベンクラミド併用投与の影響はみられなかった。グリベンクラミドのAUC0-∞及びCmaxは本剤併用投与により14%低下した。19)(外国人データ)
16.7.7 その他の薬剤との併用
注)本剤の国内承認用量は5mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相単独療法試験
日本人の2型糖尿病患者で、グリタゾン系薬剤以外の経口血糖降下薬(1剤又は2剤)を中止し、ウオッシュアウトした患者、もしくは経口血糖降下薬による治療を受けていない患者を対象とした。本剤5mg又は10mgを1日1回12週間及び26週間投与したとき注)の有効性、安全性、忍容性のプラセボ及びボグリボースとの比較検討及び52週継続投与時の長期安全性の検討を行った。
投与12週後のHbA1c(NGSP)のベースラインからの平均変化量は、下表のとおりであった。
投与12週後のHbA1c(NGSP)のベースラインからの平均変化量は、下表のとおりであった。
| リナグリプチン5mg群 n=159 | プラセボ群 n=80 | ||
| ベースラインからの平均変化量(SE) | −0.49(0.06) | 0.39(0.10) | |
| リナグリプチン群とプラセボ群の比較 | 調整平均値(SE)a) | −0.87(0.09) | |
| 95%信頼区間 | (−1.04,−0.70) | ||
| p-value | <0.0001 | ||
投与26週後のHbA1c(NGSP)のベースラインからの平均変化量は、本剤5mg群(n=159)及びボグリボース群(n=162)で、それぞれ−0.44±0.07%(平均値±標準誤差)及び−0.10±0.08%(平均値±標準誤差)であった。本剤5mg群のボグリボース群に対する調整平均変化量の差は、−0.32±0.09%(調整平均値±標準誤差、[95%信頼区間:−0.49〜−0.15%])であった。
本剤5mgを52週間投与した時のHbA1c(NGSP)は、投与開始4週後から有意な低下が認められ、18週後まで更に低下し(−0.55±0.09%[平均値±標準誤差])、52週後でも効果が持続していた。
本剤5mgの52週間投与における副作用の発現割合は10.2%(27/266例)であった。主な副作用は便秘1.9%(5/266例)、腹部膨満1.9%(5/266例)、鼓腸1.5%(4/266例)であり、低血糖は認められなかった。2)
本剤5mgを52週間投与した時のHbA1c(NGSP)は、投与開始4週後から有意な低下が認められ、18週後まで更に低下し(−0.55±0.09%[平均値±標準誤差])、52週後でも効果が持続していた。
本剤5mgの52週間投与における副作用の発現割合は10.2%(27/266例)であった。主な副作用は便秘1.9%(5/266例)、腹部膨満1.9%(5/266例)、鼓腸1.5%(4/266例)であり、低血糖は認められなかった。2)
注)本剤の国内承認用量は5mgである。
17.1.2 国内第III相併用療法長期投与試験
既存の経口血糖降下薬であるビグアナイド薬、速効型インスリン分泌促進薬、チアゾリジン薬、スルホニルウレア剤又はα-グルコシダーゼ阻害薬による治療にもかかわらず、血糖コントロールが不十分な日本人2型糖尿病患者に本剤5mg1日1回52週間投与したときの安全性及び有効性を評価した。このうちスルホニルウレア剤、又はα-グルコシダーゼ阻害薬を基礎治療薬とし、スクリーニング時のeGFRが60mL/分以上の患者を対象として、メトホルミンが投与される対照群を設け、本剤の安全性及び有効性をメトホルミンと比較した。主要評価項目は長期投与時の安全性を確認することとした。
副作用の発現割合は、ビグアナイド薬併用時11.0%(9/82例)、速効型インスリン分泌促進薬併用時10.6%(7/66例)、チアゾリジン薬併用時5.4%(4/74例)、スルホニルウレア剤併用時14.0%(20/143例)、α-グルコシダーゼ阻害薬併用時9.4%(8/85例)であった。低血糖症の副作用発現割合は、ビグアナイド薬併用時0%(0/82例)、速効型インスリン分泌促進薬併用時0%(0/66例)、チアゾリジン薬併用時1.4%(1/74例)、スルホニルウレア剤併用時11.9%(17/143例)、α-グルコシダーゼ阻害薬併用時1.2%(1/85例)であった。その他の安全性は、各基礎治療薬群でほぼ同等であった。
また、いずれの群においても、本剤の追加投与52週後のHbA1c(NGSP)の平均値及びベースラインからの平均変化量は、下表のとおりであった。23)[11.1.1参照]
副作用の発現割合は、ビグアナイド薬併用時11.0%(9/82例)、速効型インスリン分泌促進薬併用時10.6%(7/66例)、チアゾリジン薬併用時5.4%(4/74例)、スルホニルウレア剤併用時14.0%(20/143例)、α-グルコシダーゼ阻害薬併用時9.4%(8/85例)であった。低血糖症の副作用発現割合は、ビグアナイド薬併用時0%(0/82例)、速効型インスリン分泌促進薬併用時0%(0/66例)、チアゾリジン薬併用時1.4%(1/74例)、スルホニルウレア剤併用時11.9%(17/143例)、α-グルコシダーゼ阻害薬併用時1.2%(1/85例)であった。その他の安全性は、各基礎治療薬群でほぼ同等であった。
また、いずれの群においても、本剤の追加投与52週後のHbA1c(NGSP)の平均値及びベースラインからの平均変化量は、下表のとおりであった。23)[11.1.1参照]
| 併用薬剤 | n | HbA1c(NGSP)(%) 平均値(SD) | 95%信頼区間 | |
| ビグアナイド薬 | ベースライン | 82 | 7.98(0.75) | |
| 投与52週後 | 82 | 7.10(0.82) | ||
| ベースラインからの平均変化量 | 82 | −0.88(0.64) | (−1.02,−0.74) | |
| 速効型インスリン分泌促進薬 | ベースライン | 63 | 7.92(0.82) | |
| 投与52週後 | 63 | 7.19(0.75) | ||
| ベースラインからの平均変化量 | 63 | −0.73(0.65) | (−0.89,−0.57) | |
| チアゾリジン薬 | ベースライン | 73 | 7.86(0.83) | |
| 投与52週後 | 73 | 7.07(0.74) | ||
| ベースラインからの平均変化量 | 73 | −0.79(0.50) | (−0.90,−0.67) | |
| スルホニルウレア剤 | ベースライン | 140 | 8.12(0.78) | |
| 投与52週後 | 140 | 7.42(0.91) | ||
| ベースラインからの平均変化量 | 140 | −0.70(0.70) | (−0.82,−0.59) | |
| α-グルコシダーゼ阻害薬 | ベースライン | 85 | 7.87(0.75) | |
| 投与52週後 | 85 | 6.96(0.75) | ||
| ベースラインからの平均変化量 | 85 | −0.91(0.61) | (−1.04,−0.78) |
17.2 製造販売後調査等
17.2.1 インスリン製剤との併用療法 国際共同製造販売後臨床試験
基礎インスリン製剤(中間型、持効型溶解)のみによる治療、もしくは基礎インスリン製剤に加えてメトホルミン及び/又はα-グルコシダーゼ阻害薬併用による治療にもかかわらず血糖コントロールが不十分な2型糖尿病患者302例(日本人102例を含む)を対象に、本剤5mg1日1回24週間(日本人のみ52週間)投与して有効性、安全性並びに忍容性のプラセボとの比較検討を行った。24週におけるHbA1c(主要評価項目:NGSP)のベースラインからの調整平均変化量は下表のとおりであった。また、52週におけるHbA1c(NGSP)のベースラインからの調整平均変化量(日本人患者のみの結果)は、本剤5mg群(n=51)及びプラセボ群(n=50)で、それぞれ−0.86±0.08%(調整平均値±標準誤差)及び−0.29±0.09%(調整平均値±標準誤差)、本剤5mg群のプラセボ群に対する調整平均変化量の差は−0.58±0.12%(調整平均値±標準誤差、[95%信頼区間:−0.82〜−0.34%])であった。
24週までの低血糖の副作用発現割合は本剤5mg群で13.9%(21/151例)、プラセボ群で9.3%(14/151例)であった。また、52週までの低血糖の副作用発現割合(日本人患者のみの結果)は、本剤5mg群で26.9%(14/52例)、プラセボ群で18.0%(9/50例)であった。24)[11.1.1参照]
24週までの低血糖の副作用発現割合は本剤5mg群で13.9%(21/151例)、プラセボ群で9.3%(14/151例)であった。また、52週までの低血糖の副作用発現割合(日本人患者のみの結果)は、本剤5mg群で26.9%(14/52例)、プラセボ群で18.0%(9/50例)であった。24)[11.1.1参照]
| 全体集団 | リナグリプチン5mg群 n=147 | プラセボ群 n=145 | |
| ベースラインからの調整平均変化量(SE) | −1.01(0.06) | −0.38(0.07) | |
| リナグリプチン群とプラセボ群の比較 | 調整平均値(SE) | −0.63(0.09) | |
| 95%信頼区間 | (−0.81,−0.46) | ||
| p-value | <0.0001 | ||
18. 薬効薬理
18.1 作用機序
リナグリプチンはジペプチジルペプチダーゼ-4(DPP-4)の競合的かつ可逆的な選択的阻害剤である。DPP-4は膜結合型プロテアーゼのひとつで、腎臓、肝臓、腸、リンパ球及び血管内皮細胞など多くの組織において広く発現している。DPP-4の生理的基質のうち重要なものはインクレチンと呼ばれるグルカゴン様ペプチド1(GLP-1)とグルコース依存性インスリン分泌刺激ポリペプチド(GIP)である。DPP-4のペプチダーゼ活性を阻害することにより、これらの内因性インクレチンホルモンレベルの上昇によりインスリン分泌が上昇し、グルカゴン放出が抑制される。25)GLP-1とGIPはいずれも、強力なグルコース依存性インスリン分泌刺激作用を発揮し、この作用により食後の血糖コントロールを改善する。
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. リナグリプチン
22. 包装
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
500錠[瓶、バラ、乾燥剤入り]
23. 主要文献
- 社内資料:健康成人を対象とした単回および反復投与試験(2011年7月1日承認、CTD 2.7.6.2)
- 社内資料:検証試験(2011年7月1日承認、CTD 2.7.6.4)
- Retlich S,et al., Clin Pharmacokinet., 49 (12), 829-840, (2010) »PubMed
- Graefe-Mody U.et al., Clin Ther., 33 (8), 1096-1103, (2011)
- 社内資料:非臨床薬物動態試験(血漿蛋白結合)(2011年7月1日承認、CTD 2.6.4.4)
- 社内資料:非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.6.4.5)
- 社内資料:非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.7.2.3)
- 社内資料:非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.6.4.5)
- 社内資料:健康成人を対象とした14C標識体単回投与試験(2011年7月1日承認、CTD 2.7.6.2)
- 社内資料:ヒトでの代謝物検討試験
- 社内資料:非臨床薬物動態試験(トランスポーター)(2011年7月1日承認、CTD 2.6.4.4)
- Graefe-Mody U,et al., Diabetes Obes Metab., 13 (10), 939-946, (2011) »PubMed
- Graefe-Mody U,et al., Br J Clin Pharmacol., 74 (1), 75-85, (2012) »PubMed
- 社内資料:リトナビルとの薬物相互作用試験(2011年7月1日承認、CTD 2.7.2.2)
- 社内資料:リファンピシンとの薬物相互作用試験(2011年7月1日承認、CTD 2.7.2.2)
- Graefe-Mody U,et al., Int J Clin Pharmacol Ther., 48 (6), 367-374, (2010) »PubMed
- Graefe-Mody EU,et al., Curr Med Res Opin., 25 (8), 1963-1972, (2009) »PubMed
- Graefe-Mody EU,et al., Int J Clin Pharmacol Ther., 48 (10), 652-661, (2010) »PubMed
- Graefe-Mody U,et al., Drug Metab Pharmacokinet., 26 (2), 123-129, (2011) »PubMed
- Graefe-Mody EU,et al., Int J Clin Pharmacol Ther., 49 (5), 300-310, (2011) »PubMed
- Friedrich C,et al., Eur J Drug Metab Pharmacokinet., 36 (1), 17-24, (2011) »PubMed
- Friedrich C,et al., Clin Drug Investig., 31 (9), 643-653, (2011) »PubMed
- 社内資料:併用療法長期投与試験(2013年3月25日承認、CTD 2.7.4.2)
- 社内資料:インスリン併用療法試験
- Rauch T,et al., Diabetes Ther., 3 (1), 10, (2012) »PubMed
- 社内資料:非臨床薬効薬理試験(2011年7月1日承認、CTD 2.6.2.2)
- 社内資料:非臨床薬効薬理試験(2011年7月1日承認、CTD 2.6.2.2)
- Horie Y,et al., Clin Ther., 33 (7), 973-989, (2011) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017
東京都品川区大崎2丁目1番1号 ThinkPark Tower
電話:0120-189-779 (受付時間)9:00〜18:00(土・日・祝日・弊社休業日を除く)
製品情報問い合わせ先
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017
東京都品川区大崎2丁目1番1号 ThinkPark Tower
電話:0120-189-779 (受付時間)9:00〜18:00(土・日・祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
日本ベーリンガーインゲルハイム株式会社
東京都品川区大崎2丁目1番1号