医薬品情報
| 総称名 | タモキシフェン |
|---|---|
| 一般名 | タモキシフェンクエン酸塩 |
| 欧文一般名 | Tamoxifen Citrate |
| 製剤名 | タモキシフェンクエン酸塩錠 |
| 薬効分類名 | 抗乳癌剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L02BA01 |
| KEGG DRUG |
D00966
タモキシフェンクエン酸塩
|
| KEGG DGROUP |
DG01585
エストロゲン受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タモキシフェン錠10mg「サワイ」 (後発品) | TAMOXIFEN Tablets[SAWAI] | 沢井製薬 | 4291003F1228 | 15.5円/錠 | 処方箋医薬品注) |
| タモキシフェン錠20mg「サワイ」 (後発品) | TAMOXIFEN Tablets[SAWAI] | 沢井製薬 | 4291003F2062 | 29.8円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 妊婦又は妊娠している可能性のある女性[9.5参照]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人にはタモキシフェンとして1日20mgを1〜2回に分割経口投与する。
なお、症状により適宜増量できるが、1日最高量はタモキシフェンとして40mgまでとする。
なお、症状により適宜増量できるが、1日最高量はタモキシフェンとして40mgまでとする。
8. 重要な基本的注意
8.1 本剤は内分泌療法剤であり、がんに対する薬物療法について十分な知識・経験を持つ医師のもとで、本剤による治療が適切と判断される患者についてのみ使用すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 白血球減少あるいは血小板減少のある患者
白血球減少、血小板減少を悪化させるおそれがある。[11.1.1参照]
9.1.2 遺伝性血管浮腫のある患者
遺伝性血管浮腫の症状を誘発又は悪化させるおそれがある。
9.4 生殖能を有する者
9.4.2 妊娠する可能性のある女性には、本剤投与中及び最終投与後9カ月間において避妊する必要性及び適切な避妊法について説明すること。また、ホルモン剤以外の避妊法を用いること。[9.5、15.2.2、15.2.3参照]
9.4.3 男性には、本剤投与中及び最終投与後6カ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[15.2.2参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は、主として肝代謝酵素CYP3A4及びCYP2D6により代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2D6
10.2 併用注意
| クマリン系抗凝血剤 ワルファリン等 | 抗凝血作用が増強することがあるので、抗凝血剤を減量するなど、慎重に投与すること。 | タモキシフェンがワルファリンの肝臓での代謝を阻害する可能性が考えられている。 |
| リトナビル | 本剤のAUCが上昇することが予想される。 | リトナビルのチトクロームP-450に対する競合的阻害作用により、本剤のAUCが上昇することが予想される。 |
| リファンピシン | 本剤の血中濃度が低下したとの報告がある。 | リファンピシンにより、CYP3A4が誘導され、本剤の代謝が促進される可能性がある。 |
| 選択的セロトニン再取り込み阻害剤(SSRI) パロキセチン等 | 本剤の作用が減弱するおそれがある。併用により乳癌による死亡リスクが増加したとの報告がある。 | CYP2D6阻害作用により本剤の活性代謝物の血漿中濃度が低下したとの報告がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 無顆粒球症、白血球減少、好中球減少、貧血、血小板減少(いずれも頻度不明)[9.1.1参照]
11.1.2 視力異常(0.4%)、視覚障害(頻度不明)
視力異常、また、角膜の変化、白内障、網膜症、網膜萎縮、視神経症、視神経炎、視神経萎縮等の視覚障害があらわれることがあるので、視力低下、かすみ目等があらわれた場合には眼科的検査を行い、異常があれば投与を中止すること。
11.1.3 血栓塞栓症、静脈炎(いずれも頻度不明)
本剤の投与により、肺塞栓症、下肢静脈血栓症、脳血栓症、下肢血栓性静脈炎等の血栓塞栓症、静脈炎があらわれることがある。なお、細胞毒性を有する抗癌剤との併用で血栓塞栓症の危険性を増大させるおそれがあるので、投与にあたっては十分に観察すること。
11.1.4 劇症肝炎、肝炎、胆汁うっ滞、肝不全(いずれも頻度不明)
劇症肝炎、肝炎、胆汁うっ滞等の重篤な肝障害があらわれることがある。また、肝不全に至ることがある。
11.1.5 高カルシウム血症(頻度不明)
骨転移のある患者で投与開始初期に、高カルシウム血症があらわれることがある。
11.1.6 子宮筋腫、子宮内膜ポリープ、子宮内膜増殖症、子宮内膜症(いずれも頻度不明)
不正出血等の異常な婦人科学的症状がみられた場合には直ちに検査を行うなど適切な処置を行うこと。[8.2参照]
11.1.7 間質性肺炎(頻度不明)
11.1.8 アナフィラキシー、血管浮腫(いずれも頻度不明)
アナフィラキシー、血管浮腫等の過敏症状があらわれることがある。
11.1.9 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.1.10 水疱性類天疱瘡(頻度不明)
11.1.11 膵炎(頻度不明)
血清トリグリセライド上昇によると考えられる膵炎があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 肝臓 | 肝機能異常、脂肪肝(非アルコール性脂肪性肝炎を含む) | ||
| 生殖器 | 無月経、性器出血 | 月経異常、腟分泌物、卵巣嚢腫、卵巣嚢胞、陰部そう痒、子宮頸管ポリープ、腟ポリープ | |
| 消化器 | 悪心・嘔吐 | 食欲不振、下痢 | 腹痛 |
| 精神神経系 | 頭痛、眩暈・めまい、不眠、抑うつ状態、感覚異常(錯感覚、味覚異常を含む) | ||
| 皮膚 | 発疹、発汗、脱毛 | 皮膚血管炎、皮膚エリテマトーデス、晩発性皮膚ポルフィリン症、放射線照射リコール反応 | |
| 筋・骨格系 | 筋肉痛 | ||
| その他 | ほてり・潮紅 | 体重増加、浮腫、骨痛、腫瘍部の疼痛・発赤、倦怠感、疲労、頻尿、高トリグリセライド血症、下肢痙攣 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外において、QT間隔の延長、Torsade de pointesの発現が報告されている。
15.1.2 海外の臨床試験で、本剤の投与により対側乳癌以外の二次発癌がみられたとの報告があるが、本剤との関連性は十分明らかにされておらず、評価も確立されていない。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 乳癌患者にタモキシフェン20mgを単回経口投与した場合、速やかに吸収され、6〜7.5時間後に最高血中濃度(22.2〜26.3ng/mL)に達し、血中半減期は20.6〜33.8時間であった。また、連続経口投与(1回10mg1日2回投与)による血中濃度の推移は、投与後6週間目まで上昇し、その後ほぼ一定であった6)。
16.1.2 生物学的同等性試験
タモキシフェン錠20mg「サワイ」とノルバデックス錠20mgを健康成人男子にそれぞれ1錠(タモキシフェンとして20mg)空腹時単回経口投与(クロスオーバー法)し、血漿中タモキシフェン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された7)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-170hr(ng・hr/mL) | |
| タモキシフェン錠20mg「サワイ」 | 43.8±7.0 | 4.9±1.1 | 95.8±18.2 | 2097±417 |
| ノルバデックス錠20mg | 44.2±7.5 | 4.9±1.1 | 100.9±25.7 | 2079±369 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.4 代謝
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 第III相海外術後補助療法大規模比較試験
世界21カ国で実施した閉経後早期乳癌患者の術後補助療法大規模比較試験において14)15)、追跡期間の中央値約47カ月時点でのアナストロゾール・タモキシフェン併用群(アナストロゾール1mg/日+タモキシフェン20mg/日)(3,125例)とタモキシフェン群(タモキシフェン20mg/日+プラセボ)(3,116例)との比較では、無病期間のハザード比1.04(95%信頼区間0.92-1.19、p=0.5)であり、アナストロゾールの併用による追加効果は認められなかった。
アナストロゾール・タモキシフェン併用群で安全性評価対象症例3,097例中1,979例(63.9%)に副作用が認められた。また、タモキシフェン群3,094例中1,962例(63.4%)に副作用が認められた。
アナストロゾール・タモキシフェン併用群で安全性評価対象症例3,097例中1,979例(63.9%)に副作用が認められた。また、タモキシフェン群3,094例中1,962例(63.4%)に副作用が認められた。
18. 薬効薬理
18.1 作用機序
タモキシフェンは乳癌組織等のエストロゲンレセプターに対しエストロゲンと競合的に結合し、抗エストロゲン作用を示すことによって抗乳癌作用を発揮するものと考えられる。
18.2 抗腫瘍効果
18.3 エストロゲンレセプターとの結合能
19. 有効成分に関する理化学的知見
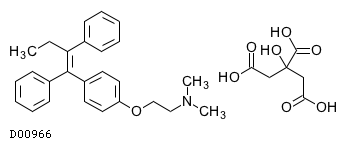
19.1. タモキシフェンクエン酸塩
20. 取扱い上の注意
アルミピロー包装開封後は、遮光して保存すること。
22. 包装
<タモキシフェン錠10mg「サワイ」>
PTP
100錠(10錠×10)
<タモキシフェン錠20mg「サワイ」>
PTP
100錠(10錠×10)
23. 主要文献
- Fisher,B.et al., J.Natl.Cancer Inst., 86 (7), 527-537, (1994) »PubMed
- Wickerham,D.L.et al., J.Clin.Oncol., 20 (11), 2758-2760, (2002) »PubMed
- Lahti,E.et al., Obestet.Gynecol., 81 (5), 660-664, (1993)
- Neven,P.et al., Lancet, 1, 375-376, (1989) »PubMed
- Ismail,S.M.et al., Histopathology, 30 (2), 187-191, (1997) »PubMed
- 和田富雄他, 薬理と治療, 8 (2), 415-422, (1980)
- 社内資料:生物学的同等性試験
- Adam,H.K.et al., Biochem.Pharmacol., 27, 145-147, (1979)
- Wilkinson,P.et al., Cancer Chemother.Pharmacol., 5 (2), 109-111, (1980) »PubMed
- Jacolot,F.et al., Biochem.Pharmacol., 41 (12), 1911-1919, (1991) »PubMed
- Stearns,V.et al., J.Natl.Cancer Inst., 95 (23), 1758-1764, (2003) »PubMed
- Fromson,J.M.et al., Xenobiotica, 3 (11), 711-714, (1973) »PubMed
- 第十八改正日本薬局方解説書, C-3098-3101, (2021), (廣川書店)
- The ATAC(Arimidex,Tamoxifen Alone or in Combination)Trialists'Group:Cancer, 98 (9), 1802-1810, (2003)
- The ATAC(Arimidex,Tamoxifen Alone or in Combination)Trialists'Group:Lancet, 359 (9324), 2131-2139, (2002)
- 久保田哲朗他, 癌と化学療法, 7 (2), 257-264, (1980)
- Jordan,V.C., Eur.J.Cancer, 12 (6), 419-424, (1976)
- Tanaka,M.et al., Jpn.J.Clin.Oncol., 8 (2), 141-148, (1978)
- 斉藤一史他, 薬理と治療, 7 (8), 2305-2310, (1979)
- Patterson,J.et al., Breast Cancer Res.Treat., 2, 363-374, (1982)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30