医薬品情報
| 総称名 | アシクロビル |
|---|---|
| 一般名 | アシクロビル |
| 欧文一般名 | Aciclovir |
| 薬効分類名 | 抗ウイルス化学療法剤 |
| 薬効分類番号 | 6250 |
| ATCコード | D06BB03 J05AB01 |
| KEGG DRUG |
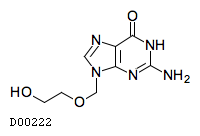
D00222
アシクロビル
|
| KEGG DGROUP |
DG02840
抗ヘルペスウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アシクロビル顆粒40%「サワイ」 (後発品) | ACICLOVIR Granules[SAWAI] | 沢井製薬 | 6250002D1164 | 42円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分あるいはバラシクロビル塩酸塩に対し過敏症の既往歴のある患者
4. 効能または効果
[成人]
[小児]
5. 効能または効果に関連する注意
<効能共通>
5.1 本剤は、主として免疫機能の低下を伴わない患者に適応される。悪性腫瘍、自己免疫疾患などの免疫機能の低下した患者には、アシクロビル注射剤の点滴静脈内投与等を考慮すること。
<水痘>
5.2 16歳以上の水痘に対する本剤の使用経験はない。
<性器ヘルペスの再発抑制>
5.3 性器ヘルペスの発症を繰り返す患者(免疫正常患者においては、おおむね年6回以上の頻度で再発する者)に対して投与すること。
5.4 体重40kg以上に限り投与すること。
6. 用法及び用量
[成人]
<単純疱疹>
通常、成人には1回アシクロビルとして200mgを1日5回経口投与する。
<造血幹細胞移植における単純ヘルペスウイルス感染症(単純疱疹)の発症抑制>
通常、成人には1回アシクロビルとして200mgを1日5回造血幹細胞移植施行7日前より施行後35日まで経口投与する。
<帯状疱疹>
通常、成人には1回アシクロビルとして800mgを1日5回経口投与する。
なお、年齢、症状により適宜増減する。
[小児]
<単純疱疹>
通常、小児には体重1kg当たり1回アシクロビルとして20mgを1日4回経口投与する。ただし、1回最高用量は200mgとする。
<造血幹細胞移植における単純ヘルペスウイルス感染症(単純疱疹)の発症抑制>
通常、小児には体重1kg当たり1回アシクロビルとして20mgを1日4回造血幹細胞移植施行7日前より施行後35日まで経口投与する。ただし、1回最高用量は200mgとする。
<帯状疱疹>
通常、小児には体重1kg当たり1回アシクロビルとして20mgを1日4回経口投与する。ただし、1回最高用量は800mgとする。
<水痘>
通常、小児には体重1kg当たり1回アシクロビルとして20mgを1日4回経口投与する。ただし、1回最高用量は800mgとする。
<性器ヘルペスの再発抑制>
通常、小児には体重1kg当たり1回アシクロビルとして20mgを1日4回経口投与する。ただし、1回最高用量は200mgとする。
なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 本剤の投与は、発病初期に近いほど効果が期待できるので、早期に投与を開始することが望ましい。
<単純疱疹>
7.3 本剤を5日間使用し、改善の兆しが見られないか、あるいは悪化する場合には、他の治療に切り替えること。ただし、初発型性器ヘルペスは重症化する場合があるため、本剤を10日間まで使用可能とする。
<帯状疱疹>
7.4 原則として皮疹出現後5日以内に投与を開始すること。
7.5 本剤を7日間使用し、改善の兆しが見られないか、あるいは悪化する場合には、他の治療に切り替えること。
<水痘>
7.6 原則として皮疹出現後3日以内に投与を開始すること。
7.7 本剤を5日間使用し、改善の兆しが見られないか、あるいは悪化する場合には、他の治療に切り替えること。
<性器ヘルペスの再発抑制>
7.8 本剤を1年間投与後、投与継続の必要性について検討することが推奨される。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.2.1 腎障害のある患者、腎機能が低下している患者
9.3 肝機能障害患者
9.3.1 肝障害のある患者
肝障害が増悪するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)の妊娠10日目に、母動物に腎障害のあらわれる大量(200mg/kg/day以上)を皮下投与した実験では、胎児に頭部及び尾の異常が認められたと報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。アシクロビルは、ヒト母乳中への移行が報告されている。[16.3.4参照]
9.7 小児等
低出生体重児及び新生児を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
アシクロビルは、OAT1、MATE1及びMATE2-Kの基質である。[16.7参照]
薬物代謝酵素用語
OAT1
薬物代謝酵素用語
MATE1
薬物代謝酵素用語
MATE2-K
10.2 併用注意
| プロベネシド | 本剤の排泄が抑制され、本剤の平均血漿中半減期が18%延長し、平均血漿中濃度曲線下面積が40%増加するとの報告がある2)。特に腎機能低下の可能性がある患者(高齢者等)には慎重に投与すること。 | プロベネシドは尿細管分泌に関わるOAT1及びMATE1を阻害するため、本剤の腎排泄が抑制されると考えられる。 |
| シメチジン | アシクロビルの排泄が抑制され、アシクロビルの平均血漿中濃度曲線下面積が27%増加するとの報告がある(バラシクロビル塩酸塩でのデータ)3)。特に腎機能低下の可能性がある患者(高齢者等)には慎重に投与すること。 | シメチジンは尿細管分泌に関わるOAT1、MATE1及びMATE2-Kを阻害するため、アシクロビルの腎排泄が抑制されると考えられる。 |
| ミコフェノール酸 モフェチル | 本剤及びミコフェノール酸 モフェチル代謝物の排泄が抑制され、両方の平均血漿中濃度曲線下面積が増加するとの報告がある4)。特に腎機能低下の可能性がある患者(高齢者等)には慎重に投与すること。 | 本剤とミコフェノール酸 モフェチル代謝物が尿細管分泌で競合すると考えられる。 |
| テオフィリン | 本剤との併用によりテオフィリンの中毒症状があらわれることがある5)。 | 機序は不明であるが、本剤がテオフィリンの代謝を阻害するためテオフィリンの血中濃度が上昇することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシーショック、アナフィラキシー(いずれも頻度不明)
アナフィラキシーショック、アナフィラキシー(呼吸困難、血管性浮腫等)があらわれることがある。
11.1.2 汎血球減少、無顆粒球症、血小板減少、播種性血管内凝固症候群(DIC)、血小板減少性紫斑病(いずれも頻度不明)
11.1.4 精神神経症状(頻度不明)
11.1.5 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.6 呼吸抑制、無呼吸(いずれも頻度不明)
11.1.7 間質性肺炎(頻度不明)
11.1.8 肝炎、肝機能障害、黄疸(いずれも頻度不明)
11.1.9 急性膵炎(頻度不明)
発現頻度には使用成績調査の結果を含む。
11.2 その他の副作用
| 0.1%〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発熱、発疹、水疱、紅斑、蕁麻疹、そう痒 | 固定薬疹、光線過敏症 | |
| 血液 | 貧血、白血球増多、好酸球増多 | リンパ球増多、血小板増多、顆粒球減少、血小板減少、好塩基球増多、リンパ球減少 | 出血、紫斑 |
| 肝臓 | 肝腫大、肝機能検査値異常(AST、ALT等の上昇) | ||
| 腎臓・泌尿器 | BUN上昇 | 血清クレアチニン値上昇、血尿、尿円柱、蛋白尿、膿尿、排尿困難 | 乏尿、結晶尿、尿閉 |
| 消化器 | 下痢、軟便、嘔気、嘔吐、腹痛、胃痛、心窩部痛、胃不快感 | 消化不良、食欲不振、舌炎 | 胃炎、口渇、便秘、鼓腸放屁 |
| 精神神経系 | 振戦、めまい、感情鈍麻、傾眠、眠気 | 意識障害、見当識障害、情動失禁、うつ状態、そう状態、集中力障害、徘徊、離人症、興奮、健忘、多弁、不眠、不安、言語障害、独語、異常感覚、運動失調、歩行異常、不随意運動、れん縮、しびれ感、眼振等 | |
| 循環器 | 動悸 | 頻脈、不整脈、胸痛、血圧上昇、血圧低下 | |
| 筋骨格 | 関節痛、筋肉痛 | ||
| 全身症状 | 頭痛 | 悪寒、発熱、全身倦怠感 | 失神、蒼白、ほてり、浮腫、脱力感、筋力低下 |
| その他 | 血清トリグリセライド値上昇、尿糖 | 咽頭炎、血清アルブミン低下、血清カリウム値上昇、AG比低下、血清コレステロール値上昇 | 肺炎、呼吸困難、喘鳴、胸水、疼痛、難聴、結膜炎、視力異常、味覚障害、脱毛、発汗、低ナトリウム血症、血清蛋白低下 |
13. 過量投与
15. その他の注意
15.2 非臨床試験に基づく情報
骨髄小核試験において、高用量(マウス腹腔内投与、180mg/kg以上)で染色体異常の誘発性を疑わせる所見が得られている。Ames試験、マウス優性致死試験等では陰性であったが、マウスに180、360、720mg/kgを腹腔内1回投与した骨髄小核試験では、小核出現頻度に用量相関性の有意な増加が認められた。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人にアシクロビル200mg及び800mgを単回経口投与した場合、投与約1.3時間後にそれぞれ最高血漿中濃度0.63μg/mL及び0.94μg/mLに達し、血漿中濃度半減期は約2.5時間であった6)。
16.1.2 反復投与
16.1.3 生物学的同等性試験
アシクロビル顆粒40%「サワイ」とゾビラックス顆粒40%を健康成人男子にそれぞれ0.5g(アシクロビルとして200mg)空腹時単回経口投与(クロスオーバー法)し、血漿中アシクロビル濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された8)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-24hr(ng・hr/mL) | |
| アシクロビル顆粒40%「サワイ」 | 357±89 | 1.88±0.73 | 3.51±1.15 | 2167±685 |
| ゾビラックス顆粒40% | 338±95 | 1.84±0.94 | 3.34±0.78 | 2018±710 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 血漿蛋白結合率
In vitroでのアシクロビルの血漿蛋白結合率は22〜33%であった9)。
16.3.2 水疱中アシクロビル濃度
アシクロビル200mgの1日4時間毎反復経口投与時、水疱中アシクロビル濃度は血漿中濃度と同程度であった10)(外国人データ)。
16.3.3 膣分泌物中アシクロビル濃度
性器ヘルペス患者へのアシクロビル200mgの1日5回10日間経口投与時、膣分泌物中への移行(投与終了0.5〜1時間後:約0.43μg/g)が認められた11)(外国人データ)。
16.3.4 乳汁中アシクロビル濃度
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 小児等
16.7 薬物相互作用
17. 臨床成績
17.1 有効性及び安全性に関する試験
<単純疱疹>
17.1.1 国内臨床試験
成人を対象としたプラセボ対照二重盲検比較試験22)においてアシクロビルの有用性が認められた。
<造血幹細胞移植における単純ヘルペスウイルス感染症(単純疱疹)の発症抑制>
17.1.2 国内臨床試験
成人及び小児を対象とした同種骨髄移植患者におけるプラセボ対照二重盲検比較試験23)では、単純ヘルペスウイルス感染症の発症率は、アシクロビル投与群0%(0/28例)、プラセボ投与群24.1%(7/29例)と有意に抑制された。
<帯状疱疹>
17.1.3 国内臨床試験
成人を対象としたプラセボ対照二重盲検比較試験24)においてアシクロビルの有用性が認められ、アシクロビル群での主な副作用は嘔吐4.6%(4/87例)及び嘔気2.3%(2/87例)であった。
18. 薬効薬理
18.1 作用機序
18.2 抗ウイルス作用
18.2.1 単純ヘルペスウイルスに対する作用
18.2.2 水痘・帯状疱疹ウイルスに対する作用
19. 有効成分に関する理化学的知見
19.1. アシクロビル
22. 包装
分包
0.5g×100包
バラ[乾燥剤入り]
100g
23. 主要文献
- Stahlmann,R.et al., Infection, 15, 261-262, (1987) »PubMed
- Laskin,O.L.et al., Antimicrob.Agents Chemother., 21, 804-807, (1982) »PubMed
- De Bony,F.et al., Antimicrob.Agents Chemother., 46, 458-463, (2002) »PubMed
- Bullingham,R.E.S.et al., Clin.Pharmacokinet., 34, 429-455, (1998) »PubMed
- Maeda,Y.et al., Biol.Pharm.Bull., 19, 1591-1595, (1996) »PubMed
- 笹征史他, 臨床医薬, 6, 427-439, (1990)
- 第十八改正日本薬局方解説書, C-62-68, (2021), (廣川書店)
- 社内資料:生物学的同等性試験
- Perry,C.M.et al., Drugs, 52, 754-772, (1996) »PubMed
- de Miranda,P.et al., J.Antimicrob.Chemother., 12 (suppl.B), 29-37, (1983)
- Van Dyke,R.B.et al., Am.J.Med., 73 (1A), 172-175, (1982) »PubMed
- Lau,R.J.et al., Obstet.Gynecol., 69, 468-471, (1987) »PubMed
- 笹征史他, 臨床薬理, 18, 523-536, (1987) »DOI
- Laskin,O.L.et al., Am.J.Med., 73 (1A), 197-201, (1982) »PubMed
- 南谷幹夫他, 小児科臨床, 40, 3153-3162, (1987)
- Sullender,W.M.et al., Antimicrob.Agents Chemother., 31, 1722-1726, (1987) »PubMed
- 矢部みはる他, 臨床とウイルス, 15, 397-401, (1987)
- Cheng,Y.et al., Drug Metab.Dispos., 40, 617-624, (2012) »PubMed
- Takeda,M.et al., J.Pharmacol.Exp.Ther., 300, 918-924, (2002) »PubMed
- Nies,A.T.et al., Expert Opin.Drug Metab.Toxicol., 8, 1565-1577, (2012) »PubMed
- Tanihara,Y.et al., Biochem.Pharmacol., 74, 359-371, (2007) »PubMed
- 新村眞人他, 臨床とウイルス, 16, 73-84, (1988)
- 正岡徹他, 臨床とウイルス, 15, 255-264, (1987)
- 新村眞人他, 臨床とウイルス, 18, 464-473, (1990)
- Biron,K.K.et al., Antimicrob.Agents Chemother., 18, 443-447, (1980) »PubMed
- Furman,P.A.et al., J.Virol., 32, 72-77, (1979) »PubMed
- Furman,P.A.et al., Antimicrob.Agents Chemother., 20, 518-524, (1981) »PubMed
- St.Clair,M.H.et al., Antimicrob.Agents Chemother., 18, 741-745, (1980) »PubMed
- Miller,W.H.et al., J.Biol.Chem., 255, 7204-7207, (1980) »PubMed
- Al-Hasani,A.M.et al., J.Antimicrob.Chemother., 18 (Suppl.B), 113-119, (1986)
- McLaren,C.et al., Am.J.Med., 73 (1A), 376-379, (1982) »PubMed
- Kern,E.R.et al., Am.J.Med., 73 (1A), 100-108, (1982) »PubMed
- 武藤茂生他, 小児科臨床, 36, 2785-2790, (1983)
- Machida,H., Antimicrob.Agents Chemother., 29, 524-526, (1986) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30