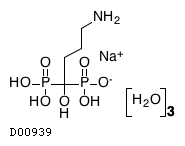
医薬品情報
| 総称名 | アレンドロン酸 |
|---|---|
| 一般名 | アレンドロン酸ナトリウム水和物 |
| 欧文一般名 | Alendronate Sodium Hydrate |
| 薬効分類名 | 骨粗鬆症治療剤 |
| 薬効分類番号 | 3999 |
| ATCコード | M05BA04 |
| KEGG DRUG |
D00939
アレンドロン酸ナトリウム水和物
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年1月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アレンドロン酸錠35mg「DK」 | Alendronate Tablets 35mg"DK" | 大興製薬 | 3999018F2044 | 229.2円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
本剤の適用にあたっては、日本骨代謝学会の診断基準等を参考に、骨粗鬆症との診断が確定している患者を対象とすること。
6. 用法及び用量
通常、成人にはアレンドロン酸として35mgを1週間に1回、朝起床時に水約180mLとともに経口投与する。
なお、服用後少なくとも30分は横にならず、飲食(水を除く)並びに他の薬剤の経口摂取も避けること。
なお、服用後少なくとも30分は横にならず、飲食(水を除く)並びに他の薬剤の経口摂取も避けること。
7. 用法及び用量に関連する注意
7.1 本剤は水のみで服用すること。水以外の飲み物(Ca、Mg等の含量の特に高いミネラルウォーターを含む)、食物及び他の薬剤と一緒に服用すると、吸収を抑制するおそれがある。
8. 重要な基本的注意
8.1 本剤は咽喉頭、食道等の粘膜に対し局所刺激症状を引き起こすおそれがある。特に適切に服用しない患者では、食道、口腔内に重度の副作用が発現する可能性があるので、服用法について患者を十分指導し、理解させること。[7.2、11.1.1参照]
8.2 本剤の投与により、上部消化管に関する副作用が報告されているので、観察を十分に行い、副作用の徴候又は症状(嚥下困難、嚥下痛又は胸骨下痛の発現又は胸やけの発現・悪化等)に注意し、患者に対して、これらの症状があらわれた場合は、本剤の服用を中止して診察を受けるよう指導すること。[11.1.1、11.1.2参照]
8.3 患者には、食事等から十分なカルシウムを摂取させること。[11.1.4参照]
8.4 低カルシウム血症がある場合には、本剤投与前に低カルシウム血症を治療すること。また、ビタミンD欠乏症又はビタミンD代謝異常のようなミネラル代謝障害がある場合には、あらかじめ治療を行うこと。[2.4、11.1.4参照]
8.5 ビスホスホネート系薬剤による治療を受けている患者において、顎骨壊死・顎骨骨髄炎があらわれることがある。報告された症例の多くが抜歯等の顎骨に対する侵襲的な歯科処置や局所感染に関連して発現している。リスク因子としては、悪性腫瘍、化学療法、血管新生阻害薬、コルチコステロイド治療、放射線療法、口腔の不衛生、歯科処置の既往等が知られている。
本剤の投与開始前は口腔内の管理状態を確認し、必要に応じて、患者に対し適切な歯科検査を受け、侵襲的な歯科処置をできる限り済ませておくよう指導すること。本剤投与中に侵襲的な歯科処置が必要になった場合には本剤の休薬等を考慮すること。
また、口腔内を清潔に保つこと、定期的な歯科検査を受けること、歯科受診時に本剤の使用を歯科医師に告知して侵襲的な歯科処置はできる限り避けることなどを患者に十分説明し、異常が認められた場合には、直ちに歯科・口腔外科を受診するように指導すること。[11.1.6参照]
本剤の投与開始前は口腔内の管理状態を確認し、必要に応じて、患者に対し適切な歯科検査を受け、侵襲的な歯科処置をできる限り済ませておくよう指導すること。本剤投与中に侵襲的な歯科処置が必要になった場合には本剤の休薬等を考慮すること。
また、口腔内を清潔に保つこと、定期的な歯科検査を受けること、歯科受診時に本剤の使用を歯科医師に告知して侵襲的な歯科処置はできる限り避けることなどを患者に十分説明し、異常が認められた場合には、直ちに歯科・口腔外科を受診するように指導すること。[11.1.6参照]
8.6 ビスホスホネート系薬剤を使用している患者において、外耳道骨壊死が発現したとの報告がある。これらの報告では、耳の感染や外傷に関連して発現した症例も認められることから、外耳炎、耳漏、耳痛等の症状が続く場合には、耳鼻咽喉科を受診するよう指導すること。[11.1.7参照]
8.7 ビスホスホネート系薬剤を長期使用している患者において、非外傷性又は軽微な外力による大腿骨転子下、近位大腿骨骨幹部、近位尺骨骨幹部等の非定型骨折が発現したとの報告がある。これらの報告では、完全骨折が起こる数週間から数ヵ月前に大腿部、鼠径部、前腕部等において前駆痛が認められている報告もあることから、このような症状が認められた場合には、X線検査等を行い、適切な処置を行うこと。また、両側性の骨折が生じる可能性があることから、片側で非定型骨折が起きた場合には、反対側の部位の症状等を確認し、X線検査を行うなど、慎重に観察すること。X線検査時には骨皮質の肥厚等、特徴的な画像所見がみられており、そのような場合には適切な処置を行うこと。[11.1.8参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 嚥下困難、食道炎、胃炎、十二指腸炎、又は潰瘍等の上部消化管障害がある患者
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
9.4 生殖能を有する者
妊娠する可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
ビスホスホネート系薬剤は骨基質に取り込まれた後に全身循環へ徐々に放出される。全身循環への放出量はビスホスホネート系薬剤の投与量・期間に相関する。ビスホスホネート系薬剤の中止から妊娠までの期間と危険性との関連は明らかではない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
動物実験(ラット)でアレンドロン酸が乳汁中に移行することが報告されている。
動物実験(ラット)でアレンドロン酸が乳汁中に移行することが報告されている。
9.7 小児等
小児等の骨粗鬆症を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| カルシウム、マグネシウム等の金属を含有する経口剤: カルシウム補給剤 制酸剤 マグネシウム製剤等 | 本剤の服用後少なくとも30分経ってから服用すること。 | 本剤は多価の陽イオン(Ca、Mg等)とキレートを形成することがあるので、併用すると本剤の吸収を低下させる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
副作用の頻度は35mg製剤(35mg/週)の臨床試験及び特定使用成績調査の合計より算出した。
副作用の頻度は35mg製剤(35mg/週)の臨床試験及び特定使用成績調査の合計より算出した。
11.1.1 食道・口腔内障害
11.1.2 胃・十二指腸障害
11.1.3 肝機能障害、黄疸(いずれも頻度不明)
AST、ALTの上昇を伴う肝機能障害、黄疸があらわれることがある。
11.1.4 低カルシウム血症(0.09%)
痙攣、テタニー、しびれ、失見当識、QT延長等を伴う低カルシウム血症があらわれることがある。異常が認められた場合にはカルシウム剤の点滴投与等を考慮すること。[2.4、8.3、8.4、9.2.1参照]
11.1.5 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.6 顎骨壊死・顎骨骨髄炎(0.03%)[8.5参照]
11.1.7 外耳道骨壊死(頻度不明)[8.6参照]
11.1.8 大腿骨転子下、近位大腿骨骨幹部、近位尺骨骨幹部等の非定型骨折(頻度不明)[8.7参照]
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 消化器 | 胃痛・心窩部痛、胃不快感・胃重感・腹部不快感 | 腹痛、嘔吐、食欲不振、腹部膨満感、口内炎、胃酸逆流、咽喉頭痛、咽喉頭不快感、おくび、嘔気、便秘、下痢、胃炎、消化不良 | 鼓腸放屁、口内乾燥、嚥下困難、歯肉腫脹 |
| 皮膚・皮膚付属器 | 発疹、かゆみ、脱毛、蕁麻疹 | 紅斑、湿疹 | |
| 血液 | 貧血(赤血球数減少、ヘモグロビン低下等)、白血球数減少、血小板数減少 | ||
| 肝臓 | 肝機能異常(AST上昇、ALT上昇、γ-GTP上昇等) | ||
| 腎臓 | BUN上昇 | 頻尿、排尿困難 | |
| 中枢・末梢神経系 | 浮動性めまい、頭痛 | 回転性めまい、知覚減退 | |
| 筋・骨格系 | 関節痛注)、背(部)痛注)、筋肉痛注)、骨痛注)、筋痙攣 | ||
| 精神・神経系 | 不眠(症) | ||
| 電解質代謝 | 血清リン低下、血清カリウム上昇 | ||
| 眼 | 眼症状(かすみ、異和感等)、強膜炎 | ぶどう膜炎、上強膜炎 | |
| その他 | 胸痛、倦怠(感)、味覚倒錯、末梢性浮腫、顔面浮腫、動悸、脱力(感)、発熱、気分不良、ほてり(顔面紅潮、熱感等)、CK上昇、血圧上昇 | 血管浮腫、LDH上昇、総コレステロール値上昇、血清アルブミン低下、下肢痛 |
13. 過量投与
13.1 症状
低カルシウム血症、低リン酸血症、並びに上部消化管障害(胃不調、胸やけ、食道炎、胃炎、又は潰瘍等)が発現することがある。
13.2 処置
アレンドロン酸と結合させるために、ミルクあるいは制酸剤等の投与を考慮する。
食道に対する刺激の危険性があるので嘔吐を誘発してはならず、患者を立たせるか、上体を起こして座らせること。
食道に対する刺激の危険性があるので嘔吐を誘発してはならず、患者を立たせるか、上体を起こして座らせること。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。
PTPシートの誤飲により、硬い鋭角部が食道粘膜に刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
PTPシートの誤飲により、硬い鋭角部が食道粘膜に刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人男子にアレンドロン酸として5、10、20及び40mgを含有する錠剤を、朝食の2時間前に単回経口投与したとき(各群n=5〜6)の血清中アレンドロン酸濃度は、5及び10mg投与群では全例で定量限界(11.5ng/mL)未満であった。20mgでは6例中2例(13.1、18.3ng/mL)で、40mgでは6例中4例(13.8〜79.3ng/mL)で投与2時間後にわずかに検出された2)。
16.1.2 健康成人男子(n=6)に、アレンドロン酸として20mgを含有する錠剤を、朝食の2時間前に1日1回7日間反復経口投与したとき、血清中アレンドロン酸濃度は6例中の1例で投与4日目(27.0ng/mL)と7日目(19.0ng/mL)に、別の1例で7日目(11.7ng/mL)に、それぞれわずかに検出された他、すべて定量限界(11.5ng/mL)未満であった2)。
16.1.3 生物学的同等性試験
アレンドロン酸錠35mg「DK」とボナロン錠35mgを、クロスオーバー法によりそれぞれ1錠(アレンドロン酸として35mg)健康成人男子に絶食単回経口投与して血漿中アレンドロン酸濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、判定パラメータの対数値の平均値の差がlog(0.90)〜log(1.11)の範囲内であり、且つ、溶出試験で溶出挙動が類似していると判定されたことから、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-8(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| アレンドロン酸錠35mg「DK」 | 53.6±26.0 | 21.5±18.4 | 1.3±0.6 | 1.5±0.2 |
| ボナロン錠35mg | 61.5±39.8 | 22.3±15.8 | 1.2±0.6 | 1.5±0.3 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
生物学的利用率の幾何平均値は、非高齢者及び高齢者でそれぞれ2.49%及び2.83%であった4)。
16.4 代謝
16.5 排泄
16.5.1 健康成人男子にアレンドロン酸として5、10、20及び40mgを含有する錠剤を、朝食の2時間前に単回経口投与したとき(各群n=5〜6)の投与後48時間までの尿中排泄率は0.65〜1.41%(幾何平均値)であり、投与量による有意な差は認められなかった。そのほとんどは投与後6時間までに排泄された6)。
16.5.2 非高齢女性(閉経後60歳未満、n=8)及び高齢女性(閉経後65歳以上、n=8)に2期クロスオーバー法でアレンドロン酸ナトリウム水和物を経口(アレンドロン酸として5mg)及び静脈内点滴(アレンドロン酸として0.1mg)投与し、投与後48時間までの尿中排泄量を測定したとき、下記の結果が得られている4)。
| 対象 | 尿中排泄率#(%) | |
| 静脈内投与 | 経口投与 | |
| 非高齢者 | 44.7 | 1.11 |
| 高齢者 | 44.1 | 1.25 |
16.5.3 閉経後女性(n=23)に2期クロスオーバー法で、アレンドロン酸として5及び35mgを含有する錠剤を朝食の2時間前に単回経口投与したとき、投与後48時間までの尿中排泄率の幾何平均値比(35mg錠/5mg錠)は1.02であった7)。
| 投与量(mg) | 尿中排泄率#(%) | 幾何平均比 | |
| 比 | 90%信頼区間 | ||
| 5 | 0.47 | 1.02 | 0.79〜1.32 |
| 35 | 0.48 | ||
16.5.4 海外で行われた試験において、閉経後女性にアレンドロン酸として10mgを含有する錠剤を、単回経口投与(朝食の2、1、0.5時間前、直後及び2時間後の5期クロスオーバー法)したとき(n=49)の投与後36時間までの尿中排泄量(幾何平均値)は、朝食2、1及び0.5時間前の投与ではそれぞれ12.68μg、8.88μg及び6.78μgであり、朝食2時間前に投与した場合が最も多かった。一方、朝食直後及び2時間後の投与では多くが定量限界未満であった8)。
16.5.5 海外で行われた試験において、閉経後女性にアレンドロン酸として10mgを含有する錠剤を、水、コーヒー又はオレンジジュースと同時に単回経口投与(3期クロスオーバー法)したとき(n=40)の投与後24時間までの尿中排泄量(幾何平均値)は、水(19.20μg)を同時に摂取した場合と比べ、コーヒー(7.43μg)、オレンジジュース(6.77μg)では約60%減少した9)10)。
(注)本剤の承認された用法及び用量はアレンドロン酸として週1回35mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 骨密度試験
(1)国内第III相試験
退行期骨粗鬆症患者(有効性評価対象297例)における52週間の二重盲検試験において、アレンドロン酸ナトリウム水和物錠(35mg/週)投与の腰椎(L1-L4)骨密度の増加率(投与52週後)は6.4%であり、対照薬の5mg(5mg/日)投与の5.8%と比較して骨密度増加効果は同等であった。また、大腿骨骨密度(投与52週後)においても、それぞれ3.0%(35mg/週)及び2.8%(5mg/日)と同程度の骨密度増加効果を示した。なお、安全性において、アレンドロン酸ナトリウム水和物錠(35mg/週)投与の副作用発現率は、5mg(5mg/日)投与と同程度であった11)。
本試験における35mg製剤(35mg/週)の安全性評価対象168例中22例(13.1%)に28件の副作用が認められた。主な症状は消化管障害であり、24件[上腹部痛4件(2.4%)、胃不快感4件(2.4%)、胃潰瘍3件(1.8%)、胃炎3件(1.8%)等]であった。また、臨床検査値異常変動は168例中6例(3.6%)に10件認められた。主なものはγ-GTP上昇4件(2.4%)、AST上昇2件(1.2%)、ALT上昇2件(1.2%)であった。なお、5%を超える頻度の副作用は認められなかった12)。
(2)海外第III相試験(参考)
閉経後骨粗鬆症患者1,258例における12ヵ月間の二重盲検比較試験において、70mg/週投与による腰椎(L1-L4)の骨密度の増加率は5.1%であり、10mg/日投与の5.4%と同等性を示した。また、大腿骨骨密度(12ヵ月後)においても、それぞれ2.9%(70mg/週)及び3.1%(10mg/日)と同程度の骨密度増加効果を示した。なお、安全性において、それぞれの投与法における副作用発現率は同程度であった13)。
17.1.2 骨折試験(参考)
(1)国内第III相試験
退行期骨粗鬆症患者365例における2年間の二重盲検比較試験(骨折発生頻度)において、胸腰椎の新規骨折発生率は5mg製剤(5mg/日)投与で12.2%、対照薬(アルファカルシドール、1μg/日)で16.7%であり、対照薬に対する5mg製剤(5mg/日)の非劣性が検証された。この試験において、投与6ヵ月以降に発生した胸腰椎の新規骨折発生率は、5mg製剤(5mg/日)投与では対照薬に比して8.4%低く統計的に有意差を認めた(相対危険減少率66%)。また、2年間における胸腰椎での複数の新規骨折発生率は5mg製剤(5mg/日)投与では対照薬に比して4.9%低かった(相対危険減少率67%)14)。さらに、延長試験として実施された3年間の成績においても投与6ヵ月以降に発生した胸腰椎の新規骨折発生率は、5mg製剤(5mg/日)投与で7.8%、対照薬で18.8%であり、5mg製剤(5mg/日)の有意な椎体骨折抑制効果が3年間にわたり確認された15)。
(2)海外第III相試験
(注)本剤の承認された用法及び用量はアレンドロン酸として週1回35mgである。
18. 薬効薬理
18.1 作用機序
18.2 骨量減少に対する作用
| 動物種 | 方法 | 結果 |
| 卵巣摘出ラット23) | アレンドロン酸として0.04〜5mg/kg/日を卵巣摘出の翌日から2ヵ月間経口投与 | 卵巣摘出による骨量減少をアレンドロン酸として1mg/kg/日以上の投与量で骨石灰化に障害を与えずに抑制した。 |
| 卵巣摘出ラット24) | アレンドロン酸として0.1、0.5mg/kg/日を卵巣摘出の翌日から12ヵ月間経口投与 | アレンドロン酸として0.5mg/kg/日の1年間の経口投与により、卵巣摘出による腰椎の骨量の減少を抑制し、卵巣非摘出ラットと同様の骨強度を維持した。 |
| 卵巣摘出ヒヒ25)26) | アレンドロン酸として0.04、0.19mg/kgを、卵巣摘出後2週に1回、2年間静脈内投与 | アレンドロン酸として0.04mg/kg以上で骨代謝回転亢進が卵巣非摘出群レベルまで抑制されることが、生化学的マーカー及び骨形態により示された。また、海綿骨量を骨石灰化を障害せずに増加させ、皮質骨の粗鬆性の亢進を防止した。腰椎の海綿骨の強度はアレンドロン酸ナトリウム水和物投与により増加し、骨量と骨強度には正の相関が認められた。 |
18.3 骨石灰化に対する影響
18.4 骨強度、骨折治癒過程に対する影響
19. 有効成分に関する理化学的知見
19.1. アレンドロン酸ナトリウム水和物
22. 包装
20錠[2錠(シート)×10]
23. 主要文献
- MID-NETを用いた調査結果の概要(MID-NETを用いたビスホスホネート製剤の腎機能障害患者における低カルシウム血症のリスク評価に関するデータベース調査), (https://www.pmda.go.jp/files/000249186.pdf)
- 中島光好、他, 臨床薬理, 26, 475-89, (1995) »DOI
- 大興製薬株式会社:生物学的同等性に関する資料(社内資料)
- 坪井實、他, 診療と新薬, 35, 43-9, (1998)
- 代謝(フォサマック錠・ボナロン錠:2001年6月20日承認、申請資料概要ヘ.2.(3))
- 単回投与試験(フォサマック錠・ボナロン錠:2001年6月20日承認、申請資料概要ヘ.3.(1).1))
- 成瀬信次、他, 臨床医薬, 20, 1227-34, (2004)
- 吸収に及ぼす食事の影響(フォサマック錠・ボナロン錠:2001年6月20日承認、申請資料概要ヘ.3.(4).2))
- Gertz BJ,et al., Clin Pharmacol Ther., 58, 288-98, (1995) »PubMed
- 吸収に及ぼす飲料の影響(フォサマック錠・ボナロン錠:2001年6月20日承認、申請資料概要ヘ.3.(4).3))
- Uchida S,et al., J Bone Miner Metab., 23, 382-8, (2005) »PubMed
- 国内第III相二重盲検比較試験(フォサマック錠・ボナロン錠:2006年7月26日承認、申請資料概要2.7.6.3)
- Schnitzer T,et al., Aging(Milano)., 12, 1-12, (2000) »PubMed
- Kushida K,et al., Curr Ther Res., 63, 606-20, (2002)
- Kushida K,et al., J Bone Miner Metab., 22, 462-8, (2004) »PubMed
- Black DM,et al., Lancet., 348, 1535-41, (1996) »PubMed
- Shiraki M,et al., Osteoporos Int., 10, 183-92, (1999) »PubMed
- Liberman UA,et al., N Engl J Med., 333, 1437-43, (1995) »PubMed
- 本剤の国内外用量差について(本邦:5mg/海外:10mg)(フォサマック錠・ボナロン錠:2001年6月20日承認、申請資料概要ト.4.(6).3))
- Hochberg MC,et al., Arthritis Rheum., 42, 1246-54, (1999) »PubMed
- Masarachia P,et al., Bone., 19, 281-90, (1996) »PubMed
- Sato M,et al., J Clin Invest., 88, 2095-105, (1991) »PubMed
- Azuma Y,et al., J Pharmacol Exp Ther., 286, 128-35, (1998) »PubMed
- 卵巣摘出ラット(フォサマック錠・ボナロン錠:2001年6月20日承認、申請資料概要ホ.1.(2).1))
- Balena R,et al., J Clin Invest., 92, 2577-86, (1993) »PubMed
- 卵巣摘出ヒヒ(フォサマック錠・ボナロン錠:2001年6月20日承認、申請資料概要ホ.1.(2).2))
- 動物を用いた薬効薬理試験のまとめ(フォサマック錠・ボナロン錠:2001年6月20日承認、申請資料概要ホ.1.(5))
- Peter CP,et al., J Pharmacol Exp Ther., 276, 271-6, (1996) »PubMed
- Balena R,et al., J Pharmacol Exp Ther., 276, 277-83, (1996) »PubMed
- Peter CP,et al., J Orthop Res., 14, 74-9, (1996) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日本ケミファ株式会社
安全管理部
〒101-0032
東京都千代田区岩本町2丁目2-3
電話:0120-47-9321
03-3863-1225
03-3863-1225
FAX:03-3861-9567
製品情報問い合わせ先
日本ケミファ株式会社
安全管理部
〒101-0032
東京都千代田区岩本町2丁目2-3
電話:0120-47-9321
03-3863-1225
03-3863-1225
FAX:03-3861-9567
26. 製造販売業者等
26.1 製造販売元
大興製薬株式会社
埼玉県川越市下赤坂560番地1
26.2 販売元
日本ケミファ株式会社
東京都千代田区岩本町2丁目2-3