医薬品情報
| 総称名 | エリザス |
|---|---|
| 一般名 | デキサメタゾンシペシル酸エステル |
| 欧文一般名 | Dexamethasone cipecilate |
| 製剤名 | デキサメタゾンシペシル酸エステル点鼻粉末 |
| 薬効分類名 | 粉末噴霧式アレルギー性鼻炎治療剤 |
| 薬効分類番号 | 1329 |
| ATCコード | H02AB02 S02BA06 S03BA01 |
| KEGG DRUG |
D07073
デキサメタゾンシペシル酸エステル
|
| KEGG DGROUP |
DG00011
デキサメタゾン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2020年7月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エリザス点鼻粉末200μg28噴霧用 | Erizas Nasal Powder | 日本新薬 | 1329712R1021 | 799.8円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 有効な抗菌剤の存在しない感染症、全身の真菌症の患者[症状を増悪するおそれがある。]
2.2 本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人には1日1回、各鼻腔に1噴霧ずつ(1噴霧あたりデキサメタゾンシペシル酸エステルとして200μg)投与する。
8. 重要な基本的注意
8.1 本剤の投与期間中に鼻症状の悪化がみられた場合には、抗ヒスタミン剤等の抗アレルギー剤あるいは、全身性ステロイド剤を短期間併用し、症状の軽減にあわせて併用薬剤を徐々に減量すること。
8.2 通年性の患者において長期に使用する場合は、症状の改善状態が持続するようであれば、本剤の減量又は休薬につとめること。
8.3 本剤投与後、全身性ステロイド剤を減量する場合は、本剤の噴霧開始後、症状の安定をみて徐々に行う。減量にあたっては一般のステロイド剤の減量法に準ずる。
8.4 本剤投与後、全身性ステロイド剤を減量あるいは離脱する場合、気管支喘息、ときに湿疹、蕁麻疹、眩暈、動悸、倦怠感、顔のほてり、結膜炎等の症状が発現・増悪することがある。このような症状があらわれた場合には適切な処置を行うこと。
8.5 本剤の十分な臨床効果を得るためには継続的に使用すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 鼻咽喉感染症(有効な抗菌剤の存在しない感染症、全身の真菌症を除く)の患者
症状を増悪するおそれがある。
9.1.2 反復性鼻出血の患者
出血を増悪するおそれがある。
9.1.3 重症な肥厚性鼻炎や鼻茸の患者
本剤の鼻腔内での作用を確実にするため、これらの症状がある程度減少するよう他の療法を併用するとよい。
9.1.4 長期又は大量の全身性ステロイド療法を受けている患者
副腎皮質機能不全が考えられるので、本剤投与後、全身性ステロイド剤を減量あるいは離脱する場合、減量中並びに離脱後も副腎皮質機能検査を行い、外傷、手術、重症感染症等の侵襲には十分に注意を払うこと。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤は動物実験で胚・胎児死亡率の増加(ウサギ)、生存胎児数減少(ウサギ)、生存胎児体重の低下(ラット、ウサギ)、骨化進行度への影響(ラット、ウサギ)及び流産(ウサギ)が報告されている。なお、本剤の動物実験では催奇形性は認められていないが、一般に、グルココルチコイドは動物に対して催奇形性を有するとされている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤は動物実験で乳汁中に移行することが報告されている(ラット)。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
アナフィラキシー(呼吸困難、全身潮紅、血管浮腫、蕁麻疹等)があらわれることがある。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | |
| 鼻腔 | 鼻部不快感 | |
| 口腔並びに呼吸器 | 咽頭不快感 | |
| 肝臓 | ALT上昇 | AST上昇、総ビリルビン上昇、直接ビリルビン上昇 |
| 血液 | 白血球数増加、白血球数減少、好中球数減少 | |
| その他 | トリグリセリド上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
以下の点を患者に指導すること。
・定められた用法及び用量を厳重に守るよう、患者に指示すること。
・本剤は鼻腔粘膜への噴霧のみに使用させること。
・患者には添付の使用説明書を渡し、使用方法を指導すること。
・使用説明書に従って、充填操作を行い、息を止めた状態でポンプ部を押して鼻腔内に噴霧させること。これら一連の操作を各鼻腔について行わせること。
・鼻汁の多い場合は、十分鼻をかんだ後、噴霧させること。
・アルミ袋開封後は、なるべく速やかに使用するよう指導すること。
15. その他の注意
15.1 臨床使用に基づく情報
レセルピン系製剤、α-メチルドパ製剤等の降圧剤には、副作用として鼻閉がみられることがある。このような降圧剤服用中のアレルギー性鼻炎の患者に、本剤を投与すると、鼻閉症状に対する本剤の効果が隠蔽されるおそれがあるので、臨床的観察を十分に行いながら投与すること。
16. 薬物動態
16.1 血中濃度
健康成人に本剤400μgを単回又は1日1回14日間反復鼻腔内噴霧した場合、血漿中の未変化体及び主要活性代謝物である脱シクロヘキサンカルボン酸体濃度は、ともに定量下限(16pg/mL)未満であった。
16.3 分布
16.3.1 組織内移行(参考)
ラットに3H標識したデキサメタゾンシペシル酸エステルを0.1mg/kg鼻腔内投与した場合、投与後30分では、投与部位を含む頭部に投与放射能の27.3%が存在したが、血液を含むその他の組織/器官では0.1%以下であった。大腸及び大脳を除くすべての組織の放射能濃度が投与後2時間にCmaxを示し、最も多く存在した肝臓で0.7%であった3)。
16.4 代謝
ヒト肝ミクロソーム及びヒト肝S9画分を用いたin vitro代謝試験において、デキサメタゾンシペシル酸エステルはカルボキシルエステラーゼ(CES)により主要活性代謝物である脱シクロヘキサンカルボン酸体に加水分解され、更にCYP3A4、CYP1A2及びCESにより代謝されることが確認された4)。
16.5 排泄
健康成人に本剤800μgを1日1回14日間反復鼻腔内噴霧した場合、尿中には未変化体(6例中1例)及び主要活性代謝物である脱シクロヘキサンカルボン酸体(6例中5例)が検出されており、最終投与後72時間までの尿中累積排泄率はそれぞれ0.023%及び0.020%であった2)。
注)本剤の承認された1日用量は400μgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
通年性アレルギー性鼻炎患者406例を対象として、本剤400μg/日(分1)、フルチカゾンプロピオン酸エステル(FP)200μg/日(分2)又はプラセボ(分1)を2週間投与するランダム化二重盲検比較試験を実施した。主要評価項目である3鼻症状(くしゃみ発作、鼻汁及び鼻閉)合計スコアの変化量(最終投与時−投与前)を下表に記載した。その結果、本剤のFPに対する非劣性が検証された(非劣性限界値Δ=0.6)。また、本剤はプラセボ群に比し有意に優れていることが確認された(対応のないt検定、P<0.001)5)。副作用発現頻度は、本剤群で8.0%(13/162例)であった。主な副作用は、ALT上昇1.2%(2/162例)であった。
| 投与群 | 例数 | 投与前(標準偏差) | 変化量(標準偏差) | 群間差(95%信頼区間) |
| 本剤400μg/日 (分1) | 162 | 6.45(1.41) | −2.03(1.95) | 本剤vsFP 0.07(−0.32〜0.46) 本剤vs本剤プラセボ −1.11(−1.58〜−0.64) |
| FP200μg/日 (分2) | 161 | 6.40(1.51) | −2.10(1.77) | |
| 本剤プラセボ (分1) | 83 | 6.41(1.67) | −0.93(1.39) |
17.3 その他
18. 薬効薬理
18.1 作用機序
主として鼻粘膜局所における、粘膜型肥満細胞・好酸球・リンパ球浸潤の抑制、サイトカインの産生抑制、血管透過性及び腺分泌の抑制、アラキドン酸代謝阻害によるロイコトリエン・プロスタグランジン産生の抑制等の抗炎症作用・抗アレルギー作用が寄与すると考えられる。
18.2 抗アレルギー作用
感作モルモットのアレルギー性鼻炎モデルにおいて、点鼻投与により鼻炎誘発後30分間のくしゃみ発現回数を軽減し、誘発後3〜7時間の鼻閉(鼻腔抵抗値)を軽減した。その効果は、フルチカゾンプロピオン酸エステルと同程度であった6)。
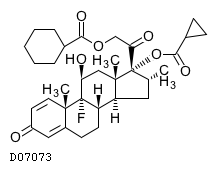
19. 有効成分に関する理化学的知見
19.1. デキサメタゾンシペシル酸エステル
20. 取扱い上の注意
使用期間中は、アルミ袋に入れてチャックを閉じ、高温、多湿を避けて保管させること。
22. 包装
2本、10本
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
製品情報問い合わせ先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
26. 製造販売業者等
26.1 製造販売元
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14