医薬品情報
| 総称名 | ゾルピデム酒石酸塩 |
|---|---|
| 一般名 | ゾルピデム酒石酸塩 |
| 欧文一般名 | Zolpidem Tartrate |
| 薬効分類名 | 入眠剤 |
| 薬効分類番号 | 1129 |
| ATCコード | N05CF02 |
| KEGG DRUG |
D00706
ゾルピデム酒石酸塩
|
| KEGG DGROUP |
DG03202
睡眠薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ゾルピデム酒石酸塩錠5mg「日新」 (後発品) | Zolpidem Tartrate Tablets 5mg "NISSIN" | 日新製薬-山形 | 1129009F1300 | 10.4円/錠 | 向精神薬(第三種向精神薬), 習慣性医薬品注1), 処方箋医薬品注2) |
| ゾルピデム酒石酸塩錠10mg「日新」 (後発品) | Zolpidem Tartrate Tablets 10mg "NISSIN" | 日新製薬-山形 | 1129009F2307 | 11.2円/錠 | 向精神薬(第三種向精神薬), 習慣性医薬品注1), 処方箋医薬品注2) |
1. 警告
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
本剤の投与は、不眠症の原疾患を確定してから行うこと。なお、統合失調症あるいは躁うつ病に伴う不眠症には本剤の有効性は期待できない。
6. 用法及び用量
通常、成人にはゾルピデム酒石酸塩として1回5〜10mgを就寝直前に経口投与する。なお、高齢者には1回5mgから投与を開始する。年齢、症状、疾患により適宜増減するが、1日10mgを超えないこととする。
7. 用法及び用量に関連する注意
7.1 本剤に対する反応には個人差があり、また、もうろう状態、睡眠随伴症状(夢遊症状等)は用量依存的にあらわれるので、本剤を投与する場合には少量(1回5mg)から投与を開始すること。やむを得ず増量する場合は観察を十分に行いながら慎重に投与すること。ただし、10mgを超えないこととし、症状の改善に伴って減量に努めること。[1.、7.2、11.1.3参照]
8. 重要な基本的注意
8.1 連用により薬物依存を生じることがあるので、漫然とした継続投与による長期使用を避けること。本剤の投与を継続する場合には、治療上の必要性を十分に検討すること。[11.1.1参照]
8.2 本剤の影響が翌朝以後に及び、眠気、注意力・集中力・反射運動能力などの低下が起こることがあるので、自動車の運転など危険を伴う機械の操作に従事させないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 肺性心、肺気腫、気管支喘息及び脳血管障害の急性期などで呼吸機能が高度に低下している患者
治療上やむを得ないと判断される場合を除き、投与しない。呼吸抑制により炭酸ガスナルコーシスを起こしやすい。[11.1.4参照]
9.1.2 衰弱患者
薬物の作用が強くあらわれ、副作用が発現しやすい。
9.1.3 心障害のある患者
血圧低下があらわれるおそれがあり、症状の悪化につながるおそれがある。
9.1.4 脳に器質的障害のある患者
作用が強くあらわれるおそれがある。
9.2 腎機能障害患者
排泄が遅延し、作用が強くあらわれるおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本薬はヒトで胎盤を通過することが報告されており、妊娠後期に本剤を投与された患者より出生した児に呼吸抑制、痙攣、振戦、易刺激性、哺乳困難等の離脱症状があらわれることがある。なお、これらの症状は、新生児仮死として報告される場合もある。
9.6 授乳婦
授乳を避けさせること。母乳中へ移行することが報告されており、新生児に嗜眠を起こすおそれがある。[16.3.1参照]
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
本剤は、主として肝薬物代謝酵素CYP3A4及び一部CYP2C9、CYP1A2で代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP1A2
10.2 併用注意
| 麻酔剤 | 呼吸抑制があらわれることがあるので、慎重に投与すること。 | 相加的に呼吸が抑制される可能性がある。 |
| 中枢神経抑制剤 フェノチアジン誘導体 バルビツール酸誘導体 等 | 相互に中枢神経抑制作用が増強することがあるので、慎重に投与すること。 | 本剤及びこれらの薬剤は中枢神経抑制作用を有する。 |
| アルコール(飲酒) | 精神機能・知覚・運動機能等の低下が増強することがあるので、できるだけ飲酒を控えさせること。 | アルコールはGABAA受容体に作用すること等により中枢神経抑制作用を示すため、併用により相互に中枢神経抑制作用を増強することがある。 |
| リファンピシン [16.7.1参照] | 本剤の血中濃度が低下し、作用が減弱するおそれがある。 | 薬物代謝酵素CYP3A4が誘導され、本剤の代謝が促進される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 依存性、離脱症状
連用により薬物依存(頻度不明)を生じることがあるので、観察を十分に行い、用量及び使用期間に注意し慎重に投与すること。また、連用中における投与量の急激な減少ないし投与の中止により、反跳性不眠、いらいら感等の離脱症状(0.1〜5%未満)があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。[8.1参照]
11.1.2 精神症状、意識障害
せん妄(頻度不明)、錯乱(0.1〜5%未満)、幻覚、興奮、脱抑制(各0.1%未満)、意識レベルの低下(頻度不明)等の精神症状及び意識障害があらわれることがある。
11.1.3 一過性前向性健忘(0.1〜5%未満)、もうろう状態(頻度不明)、睡眠随伴症状(夢遊症状等)(頻度不明)
11.1.4 呼吸抑制(頻度不明)
呼吸機能が高度に低下している患者に投与した場合、炭酸ガスナルコーシスを起こすことがあるので、このような場合には気道を確保し、換気をはかるなど適切な処置を行うこと。[9.1.1参照]
11.1.5 肝機能障害、黄疸
AST、ALT、γ‐GTP、Al‐Pの上昇等を伴う肝機能障害、黄疸(いずれも頻度不明)があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 精神神経系 | ふらつき、眠気、頭痛、残眠感、頭重感、めまい、不安、悪夢、気分高揚 | 錯視 | しびれ感、振戦 |
| 血液 | 白血球増多、白血球減少 | ||
| 肝臓 | ALT上昇、γ‐GTP上昇、AST上昇、LDH上昇 | ||
| 腎臓 | 蛋白尿 | ||
| 消化器 | 悪心、嘔吐、食欲不振、腹痛 | 下痢 | 口の錯感覚、食欲亢進 |
| 循環器 | 動悸 | ||
| 過敏症 | 発疹、そう痒感 | ||
| 骨格筋 | 倦怠感、疲労、下肢脱力感 | 筋痙攣 | |
| 眼 | 複視 | 視力障害、霧視 | |
| その他 | 口渇、不快感 | 味覚異常、転倒注1) |
13. 過量投与
13.1 症状
本剤単独の過量投与では、傾眠から昏睡までの意識障害が報告されているが、さらに中枢神経抑制症状、血圧低下、呼吸抑制、無呼吸等の重度な症状があらわれるおそれがある。
13.2 処置
本剤の過量投与が明白又は疑われた場合の処置としてフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与する場合には、使用前にフルマゼニルの使用上の注意を必ず読むこと。なお、本剤は血液透析では除去されない。
14. 適用上の注意
14.1 薬剤調製時の注意
錠剤分割後は遮光保存すること。
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
投与した薬剤が特定されないままにフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与された患者で、新たに本剤を投与する場合、本剤の鎮静、抗痙攣作用が変化、遅延するおそれがある。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
<ゾルピデム酒石酸塩錠5mg「日新」>
ゾルピデム酒石酸塩錠5mg「日新」とマイスリー錠5mgを、クロスオーバー法によりそれぞれ1錠(ゾルピデム酒石酸塩として5mg)健康成人男子に絶食時単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された1)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| ゾルピデム酒石酸塩錠5mg「日新」 | 410.08±139.36 | 102.75±23.95 | 0.9±0.4 | 2.5±0.6 |
| マイスリー錠5mg | 395.06±115.61 | 105.68±27.41 | 0.9±0.5 | 2.9±0.9 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<ゾルピデム酒石酸塩錠10mg「日新」>
ゾルピデム酒石酸塩錠10mg「日新」とマイスリー錠10mgを、クロスオーバー法によりそれぞれ1錠(ゾルピデム酒石酸塩として10mg)健康成人男子に絶食時単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された2)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| ゾルピデム酒石酸塩錠10mg「日新」 | 732.76±247.20 | 186.05±59.03 | 1.1±0.5 | 2.6±0.9 |
| マイスリー錠10mg | 695.41±237.89 | 177.12±61.67 | 1.0±0.5 | 2.6±1.0 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 乳汁中への移行
16.4 代謝
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
16.6.3 高齢者
16.7 薬物相互作用
18. 薬効薬理
18.1 作用機序
ゾルピデム酒石酸塩はベンゾジアゼピン系化合物ではないが、ベンゾジアゼピン結合部位に選択的に結合し、同様の作用を示す。ベンゾジアゼピン結合部位は抑制性神経伝達物質GABAA受容体のサブユニットに存在し、ここに結合することによりGABAA受容体へのGABAの親和性を高め、GABAA系の神経抑制機構を増強して催眠鎮静作用を示す12)。
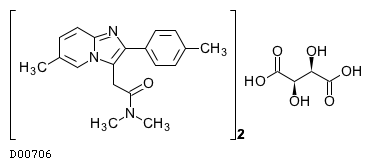
19. 有効成分に関する理化学的知見
19.1. ゾルピデム酒石酸塩
22. 包装
<ゾルピデム酒石酸塩錠5mg「日新」>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
500錠[バラ]
<ゾルピデム酒石酸塩錠10mg「日新」>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
500錠[バラ]
23. 主要文献
- 社内資料:生物学的同等性試験(錠5mg)
- 社内資料:生物学的同等性試験(錠10mg)
- Pons,G.et al., Eur.J.Clin.Pharmacol., 37 (3), 245-248, (1989) »PubMed
- 海外健康成人・薬物動態(マイスリー錠:2002年9月22日承認、申請資料概要ヘ.2.3)(1)、(2))
- ラット及びマウスでの代謝物及び類縁物質の薬理作用(マイスリー錠:2002年9月22日承認、申請資料概要ホ.1.5))
- Pichard,L.et al., Drug Metab.Dispos., 23 (11), 1253-1262, (1995) »PubMed
- Moltke,L.L.et al., Br.J.Clin.Pharmacol., 48 (1), 89-97, (1999)
- 海外慢性腎障害患者・薬物動態(マイスリー錠:2002年9月22日承認、申請資料概要ヘ.3.2)(3))
- 海外肝硬変患者・薬物動態(マイスリー錠:2002年9月22日承認、申請資料概要ヘ.3.2)(2))
- 高齢不眠症患者・薬物動態(マイスリー錠:2002年9月22日承認、申請資料概要ヘ.3.2)(1))
- Villikka,K.et al., Clin.Pharmacol.Ther., 62 (6), 629-634, (1997) »PubMed
- 第十八改正日本薬局方解説書, C3033-3038, (2021), (東京:廣川書店)
24. 文献請求先及び問い合わせ先
文献請求先
日新製薬株式会社
安全管理部
〒994-0069
山形県天童市清池東二丁目3番1号
電話:023-655-2131
FAX:023-655-3419
Email:d-info@yg-nissin.co.jp
製品情報問い合わせ先
日新製薬株式会社
安全管理部
〒994-0069
山形県天童市清池東二丁目3番1号
電話:023-655-2131
FAX:023-655-3419
Email:d-info@yg-nissin.co.jp
25. 保険給付上の注意
投薬期間制限医薬品に関する情報
本剤の投薬量は1回30日分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
日新製薬株式会社
山形県天童市清池東二丁目3番1号