医薬品情報
| 総称名 | プレドニゾロン吉草酸エステル酢酸エステル |
|---|---|
| 一般名 | プレドニゾロン吉草酸エステル酢酸エステル |
| 欧文一般名 | Prednisolone Valerate Acetate |
| 製剤名 | プレドニゾロン吉草酸エステル酢酸エステル製剤 |
| 薬効分類名 | 外用副腎皮質ホルモン剤 |
| 薬効分類番号 | 2646 |
| ATCコード | D07AA03 D07XA02 |
| KEGG DRUG |
D03301
プレドニゾロン吉草酸エステル酢酸エステル
|
| KEGG DGROUP |
DG00093
プレドニゾロン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| プレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」 (後発品) | PREDNISOLONE VALERATE ACETATE OINTMENT | 陽進堂 | 2646720M1098 | 13.4円/g | |
| プレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」 (後発品) | PREDNISOLONE VALERATE ACETATE CREAM | 陽進堂 | 2646720N1107 | 13.4円/g |
2. 禁忌
次の患者には投与しないこと
2.1 細菌・真菌・スピロヘータ・ウイルス皮膚感染症及び動物性皮膚疾患(疥癬、けじらみ等)[感染を悪化させるおそれがある。]
2.2 本剤の成分に対し過敏症の既往歴のある患者
2.3 鼓膜に穿孔のある湿疹性外耳道炎[穿孔部位の治癒の遅延及び感染のおそれがある。]
2.4 潰瘍(ベーチェット病は除く)、第2度深在性以上の熱傷・凍傷[皮膚の再生が抑制され、治癒が遅延するおそれがある。]
4. 効能または効果
5. 効能または効果に関連する注意
皮膚感染を伴う湿疹・皮膚炎には使用しないことを原則とするが、やむを得ず使用する必要がある場合には、あらかじめ適切な抗菌剤(全身適用)、抗真菌剤による治療を行うか、又はこれらとの併用を考慮すること。
6. 用法及び用量
通常1日1〜数回、適量を患部に塗布する。
なお、症状により適宜増減する。また、症状により密封法を行う。
なお、症状により適宜増減する。また、症状により密封法を行う。
8. 重要な基本的注意
8.2 本剤の使用により症状の改善がみられない場合又は症状の悪化をみる場合は使用を中止すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、大量又は長期にわたる広範囲の使用を避けること。[8.1参照]
9.7 小児等
長期・大量使用又は密封法(ODT)は避けること。発育障害をきたすおそれがある。また、おむつは密封法と同様の作用があるので注意すること。[8.1参照]
9.8 高齢者
大量又は長期にわたる広範囲の使用を避けること。一般に生理機能が低下している。[8.1参照]
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止するなど適切な処置を行うこと。
11.1.1 眼圧亢進、緑内障、白内障(いずれも頻度不明)
眼瞼皮膚への使用に際しては、眼圧亢進、緑内障、白内障を起こすことがある。大量又は長期にわたる広範囲の使用、密封法(ODT)により、緑内障、白内障等があらわれることがある。[8.1参照]
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 皮膚の感染症注1) | 皮膚の真菌症(カンジダ症、白癬症等)、細菌感染症(伝染性膿痂疹、毛のう炎等)、ウイルス感染症 | |
| その他の皮膚症状 | 魚鱗癬様皮膚変化、一過性の刺激感、乾燥 | ざ瘡様発疹注2)、酒さ様皮膚炎・口囲皮膚炎(ほほ、口囲等に潮紅、丘疹、膿疱、毛細血管拡張を生じる)注2)、ステロイド皮膚(皮膚萎縮、毛細血管拡張、紫斑)注2)、多毛注2)、色素脱失等注2) |
| 過敏症 | 紅斑等の過敏症状 | |
| 下垂体・副腎皮質系機能注3) | 下垂体・副腎皮質系機能の抑制 |
14. 適用上の注意
14.1 薬剤交付時の注意
化粧下、ひげそり後等に使用することのないよう指導すること。
14.2 薬剤投与時の注意
眼科用として使用しないこと。
16. 薬物動態
16.1 血中濃度
0.3%[3H]プレドニゾロン吉草酸エステル酢酸エステル軟膏又はクリームをラット正常皮膚に塗布した結果、軟膏では塗布後8時間で、クリームでは塗布後4時間でそれぞれ血中濃度がピークに達し、以後漸減した。また軟膏をラット損傷皮膚に塗布した結果、塗布後1〜2時間で血中濃度がピークに達し、以後速やかに減少した1)。
16.4 代謝
0.3%[3H]プレドニゾロン吉草酸エステル酢酸エステル軟膏をラット損傷皮膚に塗布し、経皮吸収時の代謝を検討した結果、ラットにおける代謝経路はエステルの加水分解、6β位の水酸化及び20位カルボニルの還元であることが示唆された2)。
16.5 排泄
0.3%[3H]プレドニゾロン吉草酸エステル酢酸エステル軟膏又はクリームをラット正常皮膚に塗布した結果、軟膏では塗布後4日間で投与量の0.5%が尿中、5%が糞中に、クリームでは塗布後4日間で投与量の1%が尿中、8%が糞中にそれぞれ排泄された。また軟膏をラット損傷皮膚に塗布した結果、塗布後4日間で投与量の4%が尿中、32%が糞中に排泄された1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内二重盲検比較試験
17.1.2 国内長期投与試験
苔癬化型のアトピー皮膚炎、尋常性乾癬及び局面状類乾癬患者17例を対象に0.3%プレドニゾロン吉草酸エステル酢酸エステル軟膏又はクリームを1日2〜3回、2〜6.5ヵ月間塗布した結果、局所的あるいは全身的な副作用は認められなかった5)。
17.1.3 国内小児臨床試験
痒疹群、虫刺症、湿潤型及び苔癬化型湿疹・皮膚炎の乳児、幼児及び小児患者67例を対象に0.3%プレドニゾロン吉草酸エステル酢酸エステル軟膏を1日2〜3回、3日〜4週間塗布した結果、全身的影響は認められなかった。副作用は2/67例(3.0%)に認められ、いずれも毛のう炎であった6)。
17.3 その他
17.3.1 全身における影響
成人尋常性乾癬患者18例に0.3%プレドニゾロン吉草酸エステル酢酸エステル軟膏(10g/日又は30g/日)を5日間密封法にて塗布した二重盲検比較試験の結果、0.3%プレドニゾロン吉草酸エステル酢酸エステル軟膏による血漿コルチゾール値の低下は一過性であり、また末梢血好酸球数及び血糖値等には変化を認めなかった7)。
18. 薬効薬理
18.1 作用機序
一般にグルココルチコイドの作用機序として、グルココルチコイドが細胞質の受容体と結合後、ステロイド−受容体結合体が核に移行して、特定のタンパクを合成させ、その合成タンパクにより各種作用が発現するといわれている8)。
18.2 局所抗炎症作用
18.2.1 カラゲニン足浮腫抑制作用
軟膏・クリーム製剤による実験(ラット)で、浮腫抑制率はベタメタゾン吉草酸エステル製剤と同程度で、ヒドロコルチゾン酪酸エステル製剤より大きかった9)。
18.2.2 クロトン油耳浮腫抑制作用
軟膏製剤による実験(ラット)で、浮腫抑制率はベタメタゾン吉草酸エステル製剤あるいはヒドロコルチゾン酪酸エステル製剤より大きかった9)。
18.2.3 その他の局所抗炎症作用
肉芽腫増殖(ラット)、PCA(ラット)及び遅延型アレルギー性皮膚炎(モルモット)等の実験的炎症モデルに軟膏を塗布した結果、局所抗炎症作用が認められた9)。
18.3 血管収縮作用
健康成人男性において二重盲検比較試験を行った結果、0.3%プレドニゾロン吉草酸エステル酢酸エステル軟膏・クリームの血管収縮作用が認められた10)。
18.4 生物学的同等性試験
<プレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」>
18.4.1 急性炎症抑制作用
プレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」、リドメックスコーワ軟膏0.3%を塗布したラットを用いて、カラゲニン足浮腫試験を行い、浮腫率を比較した結果、コントロール群に比較し、両製剤とも有意な浮腫抑制作用が認められた。また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された11)。
また、プレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」、リドメックスコーワ軟膏0.3%を塗布したラットを用いて、ヒスタミン誘発背部皮膚血管透過性を測定した結果、コントロール群に比較し、両製剤とも有意な透過抑制作用が認められた。また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された11)。
また、プレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」、リドメックスコーワ軟膏0.3%を塗布したラットを用いて、ヒスタミン誘発背部皮膚血管透過性を測定した結果、コントロール群に比較し、両製剤とも有意な透過抑制作用が認められた。また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された11)。
18.4.2 慢性炎症抑制作用
背部皮下にコットンペレットを埋め込んだラットを用い、埋め込み部分にプレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」、リドメックスコーワ軟膏0.3%を連続7日間塗布した。発生した肉芽腫重量を比較した結果、コントロール群に比較し、両製剤とも有意な肉芽増殖抑制作用が認められた。また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された11)。
また、右後肢足にアジュバントを注射したラットを用い、投与箇所にプレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」、リドメックスコーワ軟膏0.3%を1日1回7日間塗布し、浮腫改善率を比較した結果、コントロール群に比較し、両製剤とも有意な浮腫抑制作用が認められ、また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された11)。
また、右後肢足にアジュバントを注射したラットを用い、投与箇所にプレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」、リドメックスコーワ軟膏0.3%を1日1回7日間塗布し、浮腫改善率を比較した結果、コントロール群に比較し、両製剤とも有意な浮腫抑制作用が認められ、また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された11)。
<プレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」>
18.4.3 急性炎症抑制作用
プレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」、リドメックスコーワクリーム0.3%を塗布したラットを用いて、カラゲニン足浮腫試験を行い、浮腫率を比較した結果、コントロール群に比較し、両製剤とも有意な浮腫抑制作用が認められた。また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された12)。
また、プレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」、リドメックスコーワクリーム0.3%を塗布したラットを用いて、ヒスタミン誘発背部皮膚血管透過性を測定した結果、コントロール群に比較し、両製剤とも有意な透過抑制作用が認められた。また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された12)。
また、プレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」、リドメックスコーワクリーム0.3%を塗布したラットを用いて、ヒスタミン誘発背部皮膚血管透過性を測定した結果、コントロール群に比較し、両製剤とも有意な透過抑制作用が認められた。また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された12)。
18.4.4 慢性炎症抑制作用
背部皮下にコットンペレットを埋め込んだラットを用い、埋め込み部分にプレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」、リドメックスコーワクリーム0.3%を連続7日間塗布した。発生した肉芽腫重量を比較した結果、コントロール群に比較し、両製剤とも有意な肉芽増殖抑制作用が認められた。また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された12)。
また、右後肢足にアジュバントを注射したラットを用い、投与箇所にプレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」、リドメックスコーワクリーム0.3%を1日1回7日間塗布し、浮腫改善率を比較した結果、コントロール群に比較し、両製剤とも有意な浮腫抑制作用が認められ、また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された12)。
また、右後肢足にアジュバントを注射したラットを用い、投与箇所にプレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」、リドメックスコーワクリーム0.3%を1日1回7日間塗布し、浮腫改善率を比較した結果、コントロール群に比較し、両製剤とも有意な浮腫抑制作用が認められ、また、両製剤間の効果に有意差は認められず、両製剤の生物学的同等性が確認された12)。
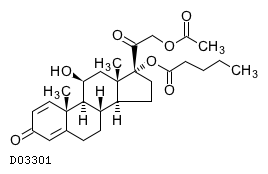
19. 有効成分に関する理化学的知見
19.1. プレドニゾロン吉草酸エステル酢酸エステル
22. 包装
<プレドニゾロン吉草酸エステル酢酸エステル軟膏0.3%「YD」>
10g(チューブ)×10本
10g(チューブ)×50本
500g(プラスチック容器)
<プレドニゾロン吉草酸エステル酢酸エステルクリーム0.3%「YD」>
10g(チューブ)×10本
10g(チューブ)×50本
500g(プラスチック容器)
23. 主要文献
- 松本修 他, 応用薬理, 20, 45-53, (1980)
- 甲重雄 他, 応用薬理, 20, 173-183, (1980)
- 福代良一 他, 新薬と臨床, 29, 1300-1315, (1980)
- 久木田淳 他, 臨床評価, 9, 501-522, (1981)
- 渡辺靖 他, 西日本皮膚科, 43, 468-473, (1981) »DOI
- 山本一哉 他, 新薬と臨床, 30, 302-308, (1981)
- 久木田淳 他, 西日本皮膚科, 43, 460-467, (1981) »DOI
- グッドマン・ギルマン薬理書 第12版, 1560-1561, (2013), (廣川書店)
- 和田靖史 他, 日本薬理学雑誌, 76, 333-345, (1980) »PubMed
- 石原勝, 薬理と治療, 8, 2989-2993, (1980)
- (株)陽進堂社内資料:生物学的同等性試験(軟膏0.3%)
- (株)陽進堂社内資料:生物学的同等性試験(クリーム0.3%)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社陽進堂
お客様相談室
富山県富山市婦中町萩島3697番地8号
電話:0120-647-734
製品情報問い合わせ先
株式会社陽進堂
お客様相談室
富山県富山市婦中町萩島3697番地8号
電話:0120-647-734
26. 製造販売業者等
26.1 製造販売元
株式会社陽進堂
富山県富山市婦中町萩島3697番地8号