医薬品情報
| 総称名 | カモスタットメシル酸塩 |
|---|---|
| 一般名 | カモスタットメシル酸塩 |
| 欧文一般名 | Camostat Mesilate |
| 製剤名 | カモスタットメシル酸塩錠 |
| 薬効分類名 | 経口蛋白分解酵素阻害剤 |
| 薬効分類番号 | 3999 |
| ATCコード | B02AB04 |
| KEGG DRUG |
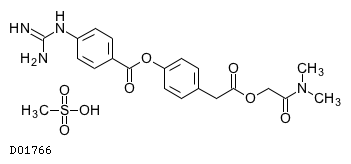
D01766
カモスタットメシル酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年5月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カモスタットメシル酸塩錠100mg「サワイ」 | CAMOSTAT MESILATE Tablets[SAWAI] | メディサ新薬 | 3999003F1319 | 10円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
<慢性膵炎における急性症状の緩解>
5.1 胃液吸引、絶食、絶飲等の食事制限を必要とする慢性膵炎の重症患者に本剤を投与しないこと。
<術後逆流性食道炎>
5.2 胃液の逆流による術後逆流性食道炎には、本剤の効果が期待できないので使用しないこと。
6. 用法及び用量
<慢性膵炎における急性症状の緩解>
通常1日量カモスタットメシル酸塩として600mgを3回に分けて経口投与する。症状により適宜増減する。
<術後逆流性食道炎>
通常1日量カモスタットメシル酸塩として300mgを3回に分けて食後に経口投与する。
8. 重要な基本的注意
<効能共通>
8.1 重篤な高カリウム血症があらわれることがあるので、血清電解質検査を行うこと。[11.1.4参照]
<術後逆流性食道炎>
8.2 症状の改善がみられない場合、長期にわたって漫然と投与しないこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 過敏症を有する患者
副作用が発現しやすくなる。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、大量投与を避けること。ヒトの投与量の40倍(400mg/kg/日)以上を投与した動物実験(ラット)で胎児体重の増加の抑制が報告されている1)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど、適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
血圧低下、呼吸困難、そう痒感等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.2 血小板減少(頻度不明)
11.1.3 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、Al-Pの著しい上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.4 高カリウム血症(頻度不明)
重篤な高カリウム血症があらわれることがある。[8.1参照]
注1):発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜0.5%未満 | 0.1%未満 | 頻度不明 | |
| 血液 | 白血球減少、赤血球減少 | 好酸球増多 | |
| 過敏症注2) | 発疹、そう痒等 | ||
| 消化器 | 嘔気、腹部不快感、腹部膨満感、下痢 | 食欲不振、嘔吐、口渇、胸やけ、腹痛、便秘 | |
| 肝臓 | AST・ALTの上昇等 | ||
| 腎臓 | BUN、クレアチニンの上昇 | ||
| その他 | 浮腫、低血糖 |
14. 適用上の注意
14.1 薬剤調製時の注意
本剤とオルメサルタン メドキソミル製剤等との一包化は避けること。一包化して高温多湿条件下にて保存した場合、本剤が変色することがある。
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人5例に200mgを空腹時に単回経口投与すると、活性代謝物である4-(4-グアニジノベンゾイルオキシ)フェニル酢酸の血漿中濃度は投与後40分で最高に達し、その濃度は84ng/mLで、血漿中半減期は約73分である2)。
16.1.2 生物学的同等性試験
カモスタットメシル酸塩錠100mg「サワイ」とフオイパン錠100mgを健康成人男子にそれぞれ2錠(カモスタットメシル酸塩として200mg)空腹時単回経口投与(クロスオーバー法)し、活性代謝物である4-(4-グアニジノベンゾイルオキシ)フェニル酢酸の血漿中濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-7hr(ng・hr/mL) | |
| カモスタットメシル酸塩錠100mg「サワイ」 | 70.9±20.5 | 1.0±0.2 | 0.7±0.2 | 111.8±38.8 |
| フオイパン錠100mg | 70.2±20.3 | 1.0±0.0 | 0.9±0.4 | 118.5±36.1 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
活性代謝物4-(4-グアニジノベンゾイルオキシ)フェニル酢酸と、これが更に代謝を受けたp-グアニジノ安息香酸は、共に血漿中では約20%がタンパク結合している4)。
16.4 代謝
カモスタットメシル酸塩は、先ずカルボン酸エステルが加水分解されて活性代謝物4-(4-グアニジノベンゾイルオキシ)フェニル酢酸になり、更に4-グアニジノ安息香酸にまで加水分解される5)。
16.5 排泄
健康成人5例に600mg注)を空腹時に単回経口投与すると、尿中代謝物はほとんどが4-グアニジノ安息香酸であり、少量の4-(4-グアニジノベンゾイルオキシ)フェニル酢酸が認められた。投与後5〜6時間でほとんど排泄され、投与後24時間での尿中への排泄率はそれぞれ20%、0.8%であった2)。
注)本剤の通常1回用量は100mg又は200mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<慢性膵炎における急性症状の緩解>
17.1.1 国内二重盲検比較試験
慢性膵炎を対象に二重盲検比較試験を行い、慢性膵炎の主症状である圧痛、尿アミラーゼ値、悪心・嘔吐、鼓腸の改善度において、対照群と比較して有意の差が認められ、有用性が報告されている6)。
17.1.2 国内臨床試験
<術後逆流性食道炎>
18. 薬効薬理
18.1 作用機序
カモスタットメシル酸塩は経口投与ですみやかに生体のキニン生成系、線溶系、凝固系及び補体系に作用し、その酵素活性をすみやかに阻害し異常亢進を抑制することにより、慢性膵炎の炎症症状と疼痛の緩解並びにアミラーゼ値の改善に効果が認められている。また、術後食道内に逆流する消化液中のトリプシンを阻害することにより、術後逆流性食道炎の改善に効果が認められている。
18.2 薬理作用
18.2.1 蛋白分解酵素阻害作用
18.2.2 キニン生成系に対する阻害作用
46℃の温水中に浸したラット後肢の灌流実験において25、100mg/kgを経口投与すると、キニン様物質の遊離をそれぞれ32〜41%、70〜87%抑制する26)。
18.2.3 凝固・線溶系に対する阻害作用
線溶亢進状態にあるウサギに50〜200mg/kgを経口投与すると、Clot lysis、FDP上昇及びトロンビン時間の延長を用量依存性に抑制し、出血を減少させる27)。
18.2.4 実験膵炎に対する作用
(1)逆行性に胆汁酸とトリプシンを膵管内に注入して作成した実験膵炎ラットに25〜100mg/kgを経口投与すると、用量依存性に死亡率を低下させる28)。
(2)十二指腸閉塞ループにより作成した実験膵炎ラット(5mg/kg)及びイヌ(10mg/kg)に十二指腸内投与すると、膵浮腫像の出現を抑制するとともに、血中蛋白分解酵素活性の上昇を抑制し、死亡率を低下させる29)。
(3)コリン欠乏食で飼育したマウスにエチオニンの投与により作成したエチオニン膵炎に20〜300mg/kgを1日2回経口投与すると、膵臓内の蛋白分解酵素活性の上昇を抑制し、死亡率を低下させる30)。
18.2.5 術後逆流性食道炎モデルに対する作用
19. 有効成分に関する理化学的知見
19.1. カモスタットメシル酸塩
22. 包装
PTP
100錠(10錠×10)
23. 主要文献
- 市川祐三他, 現代医療, 12 (臨), 127-152, (1980)
- 平工誠治他, 医薬品研究, 13, 756-765, (1982)
- 社内資料:生物学的同等性試験
- 第十八改正日本薬局方解説書, C-1355-1359, (2021), (廣川書店)
- 大木史郎他, 現代医療, 12 (臨), 71-82, (1980)
- 石井兼央他, 現代医療, 16, 844-854, (1984)
- 平山亮夫他, 現代医療, 12 (臨), 253-260, (1980)
- 石井兼央他, 現代医療, 12 (臨), 261-278, (1980)
- 平山亮夫他, 現代医療, 12 (臨), 245-252, (1980)
- 早川哲夫他, 現代医療, 12 (臨), 239-244, (1980)
- 堀口祐爾他, 現代医療, 12 (臨), 227-231, (1980)
- 久保田義弘他, 現代医療, 12 (臨), 211-214, (1980)
- 藤原淳他, 現代医療, 12 (1), 104-107, (1980)
- 安部宋顕他, 現代医療, 12 (臨), 233-238, (1980)
- 田中紀男他, 現代医療, 12 (臨), 223-226, (1980)
- 広野禎介, 現代医療, 12 (臨), 215-218, (1980)
- 木南義男他, 現代医療, 12 (1), 108-114, (1980)
- 佐藤寿雄他, 臨床医薬, 8 (8), 1877-1891, (1992)
- 佐藤寿雄他, 臨床医薬, 8 (8), 1893-1908, (1992)
- 杉山貢他, 現代医療, 25 (増II), 1835-1843, (1993)
- 神津照雄他, 現代医療, 24 (増IV), 3567-3574, (1992)
- 渡辺正敏他, 現代医療, 24 (増IV), 3575-3582, (1992)
- Tamura,Y.et al., Biochim.Biophys.Acta., 484, 417-422, (1977) »PubMed
- 加山直宏他, 現代医療, 12 (臨), 1-10, (1980)
- 加山直宏他, 現代医療, 12 (臨), 11-18, (1980)
- 小畠隆明他, 現代医療, 12 (臨), 19-25, (1980)
- 小畠隆明他, 現代医療, 12 (臨), 27-33, (1980)
- 桶川忠夫他, 現代医療, 12 (臨), 35-40, (1980)
- Takasugi,S.et al., Digestion, 24, 36-41, (1982) »PubMed
- 桶川忠夫他, 現代医療, 12 (臨), 41-49, (1980)
- 川ばた和一十他, 薬理と治療, 20, 3517-3525, (1992)
- 渡辺正敏他, 現代医療, 26 (増III), 2983-2988, (1994)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
メディサ新薬株式会社
大阪市淀川区宮原5丁目2-27
26.2 発売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30