医薬品情報
| 総称名 | アナストロゾール |
|---|---|
| 一般名 | アナストロゾール |
| 欧文一般名 | Anastrozole |
| 薬効分類名 | アロマターゼ阻害剤 閉経後乳癌治療剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L02BG03 |
| KEGG DRUG |
D00960
アナストロゾール
|
| KEGG DGROUP |
DG01596
アロマターゼ阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アナストロゾール錠1mg「サンド」 (後発品) | Anastrozole Tablets 1mg[SANDOZ] | サンド | 4291010F1155 | 25.6円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
閉経後乳癌
6. 用法及び用量
通常、成人にはアナストロゾールとして1mgを1日1回、経口投与する。
8. 重要な基本的注意
8.1 本剤の特性ならびに使用経験がないことを考慮して閉経前患者への使用は避けること。
8.2 本剤は内分泌療法剤であり、がんに対する薬物療法について十分な知識・経験を持つ医師のもとで、本剤による治療が適切と判断される患者についてのみ使用すること。
8.3 本剤の投与によって、骨粗鬆症、骨折が起こりやすくなるので、骨密度等の骨状態を定期的に観察することが望ましい。
8.4 肝機能障害、黄疸があらわれることがあるので、定期的な肝機能検査を行うなど、観察を十分に行うこと。[11.1.3参照]
8.5 本剤との関連性は明確ではないが、臨床試験において無力症や傾眠等が報告されているので、自動車の運転や機械の操作には注意すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 重度の腎機能障害患者
本剤の重度の腎障害患者での投与は臨床試験では除外されている。
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
本剤の重度の肝障害患者での投与は臨床試験では除外されている。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。本剤は、閉経後患者を対象とするものであることから、妊婦に対する投与は想定していないが、妊婦への投与の安全性については次の知見がある。動物実験(ラット)で胎児の発育遅延が認められている。また、動物実験(ラット及びウサギ)で胎児への移行が認められている。[2.1参照]
9.6 授乳婦
授乳を避けさせること。本剤は、閉経後患者を対象とするものであることから、授乳婦に対する投与は想定しておらず、本剤の授乳中女性における使用経験はない。[2.2参照]
9.8 高齢者
慎重に投与すること。本剤の臨床試験成績から、高齢者と非高齢者において血漿中濃度及び副作用の発現率並びにその程度に差は見られていない。しかし、一般に高齢者では生理機能が低下しており、副作用があらわれやすい。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.1.2 アナフィラキシー(頻度不明)、血管浮腫(頻度不明)、蕁麻疹(1.0%)
アナフィラキシー、血管浮腫、蕁麻疹等の過敏症状があらわれることがある。
11.1.3 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、Al-P、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.4参照]
11.1.4 間質性肺炎(1.0%)
咳嗽、呼吸困難、発熱等の臨床症状を十分に観察し、異常が認められた場合には、胸部X線、胸部CT等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.5 血栓塞栓症(頻度不明)
深部静脈血栓症、肺塞栓症等があらわれることがある。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 全身 | 頭痛、ほてり、倦怠感 | 疲労、無力症 | |
| 肝臓 | AST上昇、ALT上昇、Al-P上昇、γ-GTP上昇、ビリルビン上昇 | ||
| 消化器 | 嘔気、嘔吐 | 下痢、食欲不振 | |
| 精神神経系 | 感覚異常(錯感覚、味覚異常を含む)、傾眠、手根管症候群、抑うつ | ||
| 皮膚 | 脱毛、発疹、皮膚血管炎、IgA血管炎 | ||
| 筋・骨格系 | 関節痛、硬直、骨折、関節炎、骨粗鬆症、骨痛、弾発指、筋肉痛 | ||
| 生殖器 | 性器出血、腟乾燥 | ||
| 血液 | 白血球減少 | 好中球減少 | |
| その他 | 高コレステロール血症 | 高カルシウム血症 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 ラット2年間がん原性試験において高用量(25mg/kg/日)のみで雌の肝臓腫瘍及び雄の甲状腺腫瘍増加が認められた。この変化はヒトへの治療用量投与時の曝露の雄で約80倍以上、雌で約90倍以上の時にのみ増加することから、患者への本剤投与時の臨床的な安全性との関連性は低いと考えられる。マウス2年間がん原性試験では良性卵巣腫瘍の増加が認められた。この変化はアロマターゼ阻害によるマウスに特異的な変化であると考えられ患者への本剤投与時の臨床的な安全性との関連性は低いと考えられる。
15.2.2 ラット及びウサギを用いた生殖発生毒性試験において、本薬の薬理作用に起因すると考えられる着床数、妊娠率及び出生児数の低下、胎盤の肥大等が認められている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与及び反復投与
閉経後健康女性にアナストロゾール錠1mgを空腹時に単回経口投与したとき、速やかに吸収され、投与後2時間以内に最高血漿中濃度17.8ng/mLに達し、血中半減期は約56時間であった。また、反復投与(1日1回1mg)による血中濃度の推移は、投与後7〜10日目まで上昇し、その後ほぼ一定であった。定常状態における蓄積率は3〜4であった1)2)。
| Cmax(ng/mL) | Tmax(hr) | AUC0-∞(μg・hr/mL) | T1/2(hr) | |
| 単回 | 17.8±1.0 | 1.3±0.2 | 1.04±0.12a) | 56.3±4.5a) |
| 反復 | 47.6±3.8 | 3.4±0.3 | 4.13±0.63 | 55.9±4.3 |
16.1.2 生物学的同等性試験
アナストロゾール錠1mg「サンド」とアリミデックス錠1mgを、クロスオーバー法によりそれぞれ1錠(アナストロゾールとして1mg)閉経後の健康成人女性に絶食下単回経口投与して血漿中未変化体濃度を測定した。得られた未変化体の薬物動態パラメータ(AUCt、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された3)。
アナストロゾール錠1mg「サンド」投与後の血漿中濃度推移
| AUCt(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| アナストロゾール錠1mg「サンド」 | 738.772±156.907 | 19.2±3.4 | 1.40±0.51 | 40.88±11.69 |
| アリミデックス錠1mg | 726.348±149.900 | 18.4±3.1 | 1.36±0.41 | 40.80±11.81 |
なお、血漿中濃度並びにAUC、Cmax等の薬物動態パラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
ヒトにおけるアナストロゾールの血漿蛋白結合率は約40%であった(in vitro)4)。
16.4 代謝
閉経後健康女性にアナストロゾールの放射能標識体10mg注)を単回経口投与したとき、主要代謝物は、トリアゾール、グルクロン酸抱合体、アナストロゾール水酸化物のグルクロン酸抱合体であった(外国人のデータ)5)。
16.5 排泄
16.7 薬物相互作用
16.8 その他
16.8.1 自己酵素誘導
ラット及びイヌでは1mg/kg以上の用量で酵素誘導作用が認められているが、外国人閉経後乳癌患者にアナストロゾール1mg或いは10mg注)(計508例)を1日1回長期投与した臨床試験において、定常状態におけるアナストロゾールの血漿中濃度を評価した結果、酵素誘導はみられなかった5)。
注)本剤の承認用量及び用法は「本剤1mgを1日1回、経口投与する」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
第I相試験及び前期第II相試験では、0.5mg/日〜10mg/日注)までの用量で合計90例の閉経後乳癌患者において、アナストロゾールの有効性及び安全性が検討されている10)11)12)13)。また、閉経後健康女性(単回、反復各12例)を対象とした臨床薬理試験においてアナストロゾール0.5mg/日及び1mg/日における薬力学的作用(血中エストロゲン濃度低下作用)について検討された1)。
第I相試験では、1mg群の6例中1例に副作用が認められ、嘔気、頭痛及びめまいが各1件であった。
前期第II相試験では、1mg群の34例中19例(55.9%)に副作用が認められ、主な副作用は、LDH上昇5例(14.7%)、白血球減少4例(11.8%)及び吐き気、AST上昇、ALT上昇、血清コレステロール上昇、アルブミン低下、好酸球増多、ほてりが各2例(5.9%)であった。
閉経後健康女性を対象とした臨床薬理試験では、単回投与1mg群の6例中1例に副作用が認められ、頭重感であった。反復投与1mg群の6例中1例(16.7%)に副作用が認められ、発汗、のぼせ感及び四肢のむくみ感が各1件であった。
第I相試験では、1mg群の6例中1例に副作用が認められ、嘔気、頭痛及びめまいが各1件であった。
前期第II相試験では、1mg群の34例中19例(55.9%)に副作用が認められ、主な副作用は、LDH上昇5例(14.7%)、白血球減少4例(11.8%)及び吐き気、AST上昇、ALT上昇、血清コレステロール上昇、アルブミン低下、好酸球増多、ほてりが各2例(5.9%)であった。
閉経後健康女性を対象とした臨床薬理試験では、単回投与1mg群の6例中1例に副作用が認められ、頭重感であった。反復投与1mg群の6例中1例(16.7%)に副作用が認められ、発汗、のぼせ感及び四肢のむくみ感が各1件であった。
注)本剤の承認用量及び用法は「本剤1mgを1日1回、経口投与する」である。
17.1.2 ブリッジング試験
海外臨床データを国内へ外挿する妥当性を確認するために臨床薬理及び薬効に関するブリッジング試験が実施されている14)15)16)17)18)。
アナストロゾールの薬力学的作用及び薬物動態に人種間で差がないことを確認する目的で実施した臨床薬理に関するブリッジング試験においては、日本人と白人の閉経後健康女性(各24例)を比較し、アナストロゾールの薬力学的効果及び薬物動態は日本人と白人で同様であることが確認された。
また、日本人におけるアナストロゾールの有効性の確認を目的として、閉経後進行・再発乳癌患者(日本人31例)を対象に下記海外試験と同様のデザインで実施した薬効に関するブリッジング試験では、日本人におけるアナストロゾールの有効性及び安全性が白人と同程度であることが確認された。
海外で実施された閉経後進行・再発乳癌患者を対象とした二重盲検比較試験(対照薬:タモキシフェンクエン酸塩)を上記薬効に関するブリッジング試験と合わせて解析した結果、評価対象例699例(海外668例、日本31例)のUICC判定基準にもとづく抗腫瘍効果は奏効率でタモキシフェン群32.8%(114/348例)に対し、アナストロゾール群で33.3%(117/351例)であった。また、病勢の進行までの期間(Time to progression:TTP)の中央値は251日間(約8.3ヵ月)に対し252日間(約8.3ヵ月)であり、アナストロゾールはタモキシフェンと少なくとも同等の有用性が認められた(追跡期間の中央値:約18ヵ月)。
アナストロゾールの薬力学的作用及び薬物動態に人種間で差がないことを確認する目的で実施した臨床薬理に関するブリッジング試験においては、日本人と白人の閉経後健康女性(各24例)を比較し、アナストロゾールの薬力学的効果及び薬物動態は日本人と白人で同様であることが確認された。
また、日本人におけるアナストロゾールの有効性の確認を目的として、閉経後進行・再発乳癌患者(日本人31例)を対象に下記海外試験と同様のデザインで実施した薬効に関するブリッジング試験では、日本人におけるアナストロゾールの有効性及び安全性が白人と同程度であることが確認された。
海外で実施された閉経後進行・再発乳癌患者を対象とした二重盲検比較試験(対照薬:タモキシフェンクエン酸塩)を上記薬効に関するブリッジング試験と合わせて解析した結果、評価対象例699例(海外668例、日本31例)のUICC判定基準にもとづく抗腫瘍効果は奏効率でタモキシフェン群32.8%(114/348例)に対し、アナストロゾール群で33.3%(117/351例)であった。また、病勢の進行までの期間(Time to progression:TTP)の中央値は251日間(約8.3ヵ月)に対し252日間(約8.3ヵ月)であり、アナストロゾールはタモキシフェンと少なくとも同等の有用性が認められた(追跡期間の中央値:約18ヵ月)。
| 後期第II相試験注1) 実施国/地域 (試験番号) | 抗腫瘍効果奏効率注2) (奏効例/評価例) アナストロゾール群 | 抗腫瘍効果奏効率注2) (奏効例/評価例) タモキシフェン群 | 病勢の進行までの期間 (TTP)の中央値 (評価例)注3) アナストロゾール群 | 病勢の進行までの期間 (TTP)の中央値 (評価例)注3) タモキシフェン群 |
| 日本 (JP0027) | 45.5% (5/11) | 35.0% (7/20) | − | − |
| 海外 (IL0027) | 32.9% (112/340) | 32.6% (107/328) | 251日間 (340) | 252日間 (328) |
| 日本+海外 (JP0027+IL0027) | 33.3% (117/351) | 32.8% (114/348) | 251日間 (351) | 252日間 (348) |
臨床薬理に関するブリッジング試験において、アナストロゾールが投与された48例のうち、日本人24例中8例(33%)、白人24例中17例(71%)に副作用が認められた。主な副作用は、頭痛(日本人5例[21%]、白人8例[33%])、下痢(日本人3例[13%]、白人4例[17%])、不眠(日本人0例、白人3例[13%])及び腹痛(日本人3例[13%]、白人0例)であった。
薬効に関するブリッジング試験において、アナストロゾールが投与された347例(日本人11例、外国人336例)のうち、123例(35.4%)に副作用が認められた。主な副作用は、ほてり(血管拡張)64例(18.4%)、嘔気26例(7.5%)及び脱毛症8例(2.3%)であった。日本では、アナストロゾールが投与された11例中4例(36.4%)に副作用が認められ、ほてり(血管拡張)、嘔気、間質性肺炎及び性器出血を伴った子宮内膜増殖症が各1例であった。
薬効に関するブリッジング試験において、アナストロゾールが投与された347例(日本人11例、外国人336例)のうち、123例(35.4%)に副作用が認められた。主な副作用は、ほてり(血管拡張)64例(18.4%)、嘔気26例(7.5%)及び脱毛症8例(2.3%)であった。日本では、アナストロゾールが投与された11例中4例(36.4%)に副作用が認められ、ほてり(血管拡張)、嘔気、間質性肺炎及び性器出血を伴った子宮内膜増殖症が各1例であった。
17.1.3 海外第III相術後補助療法大規模比較試験
世界21ヵ国で実施した閉経後早期乳癌患者の術後補助療法大規模比較試験において19)20)21)、追跡期間の中央値約68ヵ月時点での再発・死亡・対側乳癌の発生率は、アナストロゾール群(アナストロゾール1mg/日+プラセボ)18.4%(575/3,125例)、タモキシフェン群(タモキシフェン20mg/日+プラセボ)20.9%(651/3,116例)であった。無病期間のハザード比は0.87(95%信頼区間0.78-0.97、p=0.01)であり、アナストロゾール群はタモキシフェン群と比較して乳癌再発リスクを13%低下させた。遠隔再発までの期間のハザード比は0.86(95%信頼区間0.74-0.99、p=0.04)であり、アナストロゾール群はタモキシフェン群と比較して遠隔転移の再発リスクを14%低下させた。また、ホルモン受容体陽性患者における対側乳癌のハザード比は0.47(95%信頼区間0.29-0.75、p=0.001)であり、アナストロゾール群はタモキシフェン群と比較して対側乳癌発生リスクを53%低下させた。なお、追跡期間の中央値約47ヵ月時点でのアナストロゾール・タモキシフェン併用群(アナストロゾール1mg/日+タモキシフェン20mg/日)とタモキシフェン群との比較においては、無病期間のハザード比1.04(95%信頼区間0.92-1.19、p=0.5)であり、アナストロゾールの併用による追加効果は認められなかった。
アナストロゾールが投与されたアナストロゾール・タモキシフェン併用群3,097例中1,979例(63.9%)に副作用が認められた。また、アナストロゾール群3,092例中1,734例(56.1%)に副作用が認められた(2001年6月29日データカットオフ)。
アナストロゾールが投与されたアナストロゾール・タモキシフェン併用群3,097例中1,979例(63.9%)に副作用が認められた。また、アナストロゾール群3,092例中1,734例(56.1%)に副作用が認められた(2001年6月29日データカットオフ)。
17.1.4 国際共同第III相試験
ホルモン受容体陽性閉経後乳癌患者への多施設共同無作為化二重盲検比較試験(日本人97例、日本人以外354例)において22)、術前療法としてアナストロゾール又はタモキシフェンを3ヵ月間投与した後の抗腫瘍効果(奏効率)は、アナストロゾール群39.5%(90/228例)、タモキシフェン群35.4%(79/223例)で群間に有意差は認めなかった。
アナストロゾール群228例に認められた主な有害事象は、悪心47例(20.6%)、脱毛症35例(15.4%)、ほてり19例(8.3%)、頭痛15例(6.6%)及び嘔吐12例(5.3%)であった。
アナストロゾール群228例に認められた主な有害事象は、悪心47例(20.6%)、脱毛症35例(15.4%)、ほてり19例(8.3%)、頭痛15例(6.6%)及び嘔吐12例(5.3%)であった。
18. 薬効薬理
18.1 作用機序
アナストロゾールはアロマターゼの活性を阻害することにより、アンドロゲンからのエストロゲン生成を阻害し、乳癌の増殖を抑制する10)。
18.2 アロマターゼ阻害作用
閉経後進行乳癌患者にアナストロゾール1日1回1mgを反復投与したとき、アロマターゼ活性は約96%阻害された(外国人のデータ)23)。
18.3 血漿中エストラジオール濃度低下作用
閉経後進行乳癌患者にアナストロゾール1日1回1mg及び10mgを反復投与したときの血漿中エストラジオール濃度は投与前値に対してそれぞれ約90%低下し、アナストロゾールの血漿中エストラジオール濃度低下作用は両用量でほぼ同程度であった10)。
18.4 抗腫瘍効果
18.5 作用の選択性
ラット、イヌ、サルを用いた試験で、アナストロゾールはアロマターゼを阻害する用量でステロイドホルモン生合成に関与する他のチトクロームP450酵素に対し阻害作用を示さなかった27)。
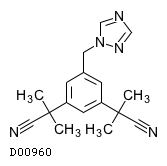
19. 有効成分に関する理化学的知見
19.1. アナストロゾール
22. 包装
30錠[10錠×3;PTP]
100錠[10錠×10;PTP]
23. 主要文献
- Nomura Y, et al., Clin Drug Invest., 20 (5), 357-369, (2000)
- 閉経後健常女性における血漿中濃度(アリミデックス錠:2000年12月12日承認、申請資料概要ヘ.3.(1))
- 社内資料:生物学的同等性試験(アナストロゾール錠1mg「サンド」)
- 血漿蛋白結合(アリミデックス錠:2000年12月12日承認、申請資料概要ヘ.2.(2).4))
- 第十八改正日本薬局方第一追補解説書, C23-C28, (2022), (廣川書店)
- ヒトにおける代謝及び排泄(アリミデックス錠:2000年12月12日承認、申請資料概要ヘ.3.(4))
- ヒトにおける代謝及び排泄(アリミデックス錠:2000年12月12日承認、審査報告書)
- Grimm S.W, et al., Drug Metab. Dispos., 25 (5), 598-602, (1997) »PubMed
- Dowsett M, et al., Eur. J. Cancer., 34 (S1), abs.100,S39-S40, (1998)
- 小山博記 他, 乳癌の臨床, 15 (5), 577-583, (2000)
- 小山博記 他, 乳癌の臨床, 15 (5), 567-576, (2000)
- 前期第II相試験(アリミデックス錠:2000年12月12日承認、申請資料概要ト.1.(3))
- 臨床薬理試験(アリミデックス錠:2000年12月12日承認、申請資料概要ト.1.(2))
- Dowsett M, et al., Cancer Chemother. Pharmacol., 46 (1), 35-39, (2000) »PubMed
- Watanabe T, et al., Proc. Am. Soc. Clin. Oncol., 19, abs396,103a, (2000)
- Bonneterre J, et al., J. Clin. Oncol., 18 (22), 3748-3757, (2000) »PubMed
- 臨床薬理に関するブリッジング試験(アリミデックス錠:2000年12月12日承認、申請資料概要ト.1.(5))
- 後期第II相試験(薬効に関するブリッジング試験)(アリミデックス錠:2000年12月12日承認、申請資料概要ト.1.(7))
- The ATAC(Arimidex, Tamoxifen Alone or in Combination)Trialists' Group, Cancer., 98 (9), 1802-1810, (2003) »PubMed
- The ATAC(Arimidex, Tamoxifen Alone or in Combination)Trialists' Group, Lancet., 365 (9453), 60-62, (2005) »PubMed
- The ATAC(Arimidex, Tamoxifen Alone or in Combination)Trialists' Group, Lancet., 359, 2131-2139, (2002) »PubMed
- Cataliotti L, et al., Cancer., 106 (10), 2095-2103, (2006) »PubMed
- Geisler J, et al., Br. J. Cancer., 74 (8), 1286-1291, (1996) »PubMed
- Dukes M., Oncology., 54 (Suppl.2), 6-10, (1997)
- ラットDMBA誘発乳癌の増殖に対する作用(アリミデックス錠:2000年12月12日承認、申請資料概要ホ.1.(1).2))
- Lu Q, et al., Breast Cancer Res. Treat., 57 (2), 183-192, (1999) »PubMed
- Dukes M, et al., J. Steroid Biochem. Molec. Biol., 58 (4), 439-445, (1996) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633
製品情報問い合わせ先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633