医薬品情報
| 総称名 | エパルレスタット |
|---|---|
| 一般名 | エパルレスタット |
| 欧文一般名 | Epalrestat |
| 薬効分類名 | アルドース還元酵素阻害剤 |
| 薬効分類番号 | 3999 |
| KEGG DRUG |
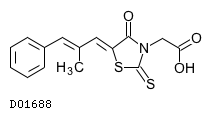
D01688
エパルレスタット
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第1版)

|
4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エパルレスタット錠50mg「サワイ」 (後発品) | EPALRESTAT Tablets[SAWAI] | 沢井製薬 | 3999013F1304 | 20.7円/錠 | 処方箋医薬品注) |
4. 効能または効果
糖尿病性末梢神経障害に伴う自覚症状(しびれ感、疼痛)、振動覚異常、心拍変動異常の改善
(糖化ヘモグロビンが高値を示す場合)
(糖化ヘモグロビンが高値を示す場合)
5. 効能または効果に関連する注意
5.1 糖尿病治療の基本である食事療法、運動療法、経口血糖降下剤、インスリン等の治療を行った上でなお、糖化ヘモグロビンが高値を示す患者に対して適用を考慮する。
5.2 本剤の投与の対象となる患者の糖化ヘモグロビンは、HbA1c(NGSP値)7.0%以上(JDS値6.6%以上)を目安とする。
5.3 不可逆的な器質的変化を伴う糖尿病性末梢神経障害の患者では効果が確立されていない。
6. 用法及び用量
通常、成人にはエパルレスタットとして1回50mgを1日3回毎食前に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
投与中は経過を十分に観察し、12週間投与して効果が認められない場合には他の適切な治療に切り換えること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている1)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど、適切な処置を行うこと。
11.1.1 血小板減少(頻度不明)
11.1.2 劇症肝炎、肝機能障害、黄疸、肝不全
劇症肝炎(頻度不明)、著しいAST・ALTの上昇等を伴う肝機能障害(0.1%未満)、黄疸(頻度不明)、肝不全(頻度不明)があらわれることがある。
注)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜0.5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | − | 発疹、そう痒、紅斑、水疱等 | − |
| 肝臓 | AST・ALT・γ-GTPの上昇等 | ビリルビン上昇 | − |
| 消化器 | 腹痛、嘔気 | 嘔吐、下痢、食欲不振、腹部膨満感、便秘 | 胸やけ |
| 腎臓 | − | BUN上昇、クレアチニン上昇 | 尿量減少、頻尿 |
| 血液 | − | 貧血、白血球減少 | − |
| その他 | − | 倦怠感、めまい、頭痛、こわばり、脱力感、四肢疼痛、胸部不快感、動悸、浮腫、ほてり | しびれ、脱毛、紫斑、CK上昇、発熱 |
12. 臨床検査結果に及ぼす影響
本剤の投与により尿は黄褐色又は赤色を呈するため、ビリルビン及びケトン体の尿定性試験に影響することがある。[15.1参照]
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与により、黄褐色又は赤色の着色尿があらわれることがある。本剤及び代謝物の影響による。[12.参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人10例に50mgを食前30分に単回経口投与すると、血漿中濃度は1時間後に最高に達し、その濃度は3.9μg/mLである。血漿中半減期は1.8時間で、血漿中濃度は4時間後に0.37μg/mLとなる2)。
| Tmax(hr) | Cmax(ng/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) |
| 1.05±0.16 | 3896±1132 | 6435±1018 | 1.844±0.387 |
16.1.2 生物学的同等性試験
エパルレスタット錠50mg「サワイ」とキネダック錠50mgを健康成人男子にそれぞれ1錠(エパルレスタットとして50mg)空腹時単回経口投与(クロスオーバー法)し、血漿中エパルレスタット濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC0-8hr(μg・hr/mL) | |
| エパルレスタット錠50mg「サワイ」 | 3.70±0.97 | 1.9±0.8 | 0.8±0.2 | 7.18±1.38 |
| キネダック錠50mg | 3.63±1.50 | 2.1±1.1 | 0.8±0.2 | 7.56±2.08 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
ヒト血清に対する蛋白結合率は90.1%である(in vitro、平衡透析法)4)。
16.5 排泄
尿中主要代謝物はベンゼン環が水酸化を受けた一水酸化体及び二水酸化体の硫酸抱合体である4)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
エパルレスタットはアルドース還元酵素を特異的に阻害し、神経内ソルビトールの蓄積を抑制することにより、糖尿病性末梢神経障害における自覚症状及び神経機能異常を改善する。
18.2 薬理作用
18.2.1 アルドース還元酵素阻害作用
(1)ラットの坐骨神経、水晶体、網膜、ウサギ水晶体及びヒト胎盤より抽出したアルドース還元酵素に対して強い阻害作用が認められている。50%阻害濃度は1.0〜3.9×10-8Mである(in vitro)15)16)17)。
(2)アルドース還元酵素以外の糖代謝系酵素に対しては10-5Mでほとんど阻害作用を示さない(in vitro)16)。
18.2.2 ソルビトール蓄積抑制作用
18.2.3 運動神経伝導速度改善作用
(1)ストレプトゾトシン糖尿病ラットの尾部神経の運動神経伝導速度の低下を抑制20)あるいは改善21)する。また、高フルクトース食を負荷したストレプトゾトシン糖尿病ラットの尾部神経の運動神経伝導速度を改善する22)。
(2)自然発症糖尿病ラットの尾部神経の運動神経伝導速度を改善する23)。
18.2.4 自律神経機能に対する作用
(1)ストレプトゾトシン糖尿病ラットの副交感神経機能の指標である心電図R-R間隔変動の異常を抑制する24)。
(2)ストレプトゾトシン糖尿病ラットの交感神経機能の指標である心臓のノルエピネフリンのturn-overの低下を改善する25)。
18.2.5 神経の形態学的変化に対する作用
(2)ストレプトゾトシン糖尿病ラットの軸索流の異常を改善する27)。
18.2.6 神経血流に対する作用
ストレプトゾトシン糖尿病ラットの坐骨神経血管の血流を有意に改善し、虚血状態をあらわす坐骨神経内の乳酸含量の上昇を有意に抑制する28)。
18.2.7 神経ミオイノシトール含量に対する作用
19. 有効成分に関する理化学的知見
19.1. エパルレスタット
22. 包装
PTP
100錠(10錠×10)
23. 主要文献
- 宮本茂敏他, 現代医療, 18 (増III), 40-50, (1986)
- 町井浩司他, 現代医療, 28, 1273-1280, (1996)
- 陶易王他, 診療と新薬, 42 (6), 622-626, (2005)
- 宮本茂敏他, 現代医療, 18 (増III), 82-97, (1986)
- 後藤由夫他, 医学のあゆみ, 152, 405-416, (1990)
- 後藤由夫他, 現代医療, 18 (増III), 449-466, (1986)
- 森川秋月他, 現代医療, 18 (増III), 467-470, (1986)
- 鈴木将夫他, 現代医療, 18 (増III), 437-442, (1986)
- 上田幸生他, 現代医療, 18 (増III), 471-475, (1986)
- 中井継彦他, 現代医療, 18 (増III), 476-479, (1986)
- 原信也他, 現代医療, 18 (増III), 480-486, (1986)
- 厨直美他, 現代医療, 18 (増III), 487-491, (1986)
- 桑田隆志他, 現代医療, 18 (増III), 492-496, (1986)
- 杉本英克他, 現代医療, 18 (増III), 497-502, (1986)
- Terashima,H.et al., J.Pharmacol.Exp.Ther., 229, 226-230, (1984) »PubMed
- 寺島宏他, 現代医療, 18 (増III), 1-10, (1986)
- 川村雅範他, 有機合成化学協会誌, 55 (7), 651-657, (1997) »DOI
- 中埜幸治他, 医学のあゆみ, 152, 137-142, (1990)
- 堀田饒他, 現代医療, 19 (8), 2587-2593, (1987)
- 吉川隆一他, Metabolism, 33, 212-214, (1984) »PubMed
- 吉川隆一他, Diabetologia, 24, 290-292, (1983) »PubMed
- 堀田饒他, Diabetologia, 28, 176-180, (1985) »PubMed
- 柿崎正栄他, 現代医療, 16, 1274-1276, (1984)
- 浅野次義他, 糖尿病, 26, 1105-1111, (1983) »DOI
- 吉田俊秀他, Diabetes, 36, 6-13, (1987) »PubMed
- 堀田饒他, 糖尿病, 29 (Suppl.1), 22-25, (1986)
- 鬼頭昭三他, Hiroshima J.Med.Sci., 35, 109-115, (1986) »PubMed
- 安田斎他, Diabetes, 38, 832-838, (1989) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30