医薬品情報
| 総称名 | レボフロキサシン |
|---|---|
| 一般名 | レボフロキサシン水和物 |
| 欧文一般名 | Levofloxacin Hydrate |
| 薬効分類名 | 広範囲抗菌点眼剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01AE05 |
| KEGG DRUG |
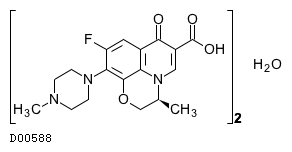
D00588
レボフロキサシン水和物
|
| KEGG DGROUP |
DG01549
ニューキノロン系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年3月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| レボフロキサシン点眼液1.5%「科研」 (後発品) | Levofloxacin Ophthalmic Solution「KAKEN」 | ダイト | 1319742Q2094 | 23.5円/mL | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分、オフロキサシン及びキノロン系抗菌剤に対し過敏症の既往歴のある患者
4. 効能または効果
<適応菌種>
<適応症>
5. 効能または効果に関連する注意
本剤におけるメチシリン耐性黄色ブドウ球菌(MRSA)に対する有効性は証明されていないので、MRSAによる感染症が明らかであり、臨床症状の改善が認められない場合、速やかに抗MRSA作用の強い薬剤を投与すること。
6. 用法及び用量
通常、1回1滴、1日3回点眼する。なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
低出生体重児、新生児、乳児、幼児又は8歳未満の小児に投与した臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
紅斑、発疹、呼吸困難、血圧低下、眼瞼浮腫等の症状が認められた場合には投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 眼 | 眼刺激 | 眼のそう痒感 | びまん性表層角膜炎等の角膜障害、結膜炎、眼痛、角膜沈着物、眼瞼炎 |
| 皮膚 | 蕁麻疹 | 発疹、そう痒 | |
| その他 | 味覚異常(苦味等) |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜のう内に点眼し、1〜5分間閉瞼して涙のう部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・遮光して保存すること。
16. 薬物動態
16.1 血中濃度
健康成人(8例)の両眼に1.5%レボフロキサシン点眼液を1日目に単回点眼し、2日目より反復(1回1滴、1日8回、7日間)点眼したとき、8日目(最終日)の最高血漿中濃度は24.1ng/mL、その到達時間は最終点眼後26分であった1)。
16.3 分布
白色ウサギの片眼に1.5%レボフロキサシン点眼液を50μL単回点眼したとき、角膜中濃度は投与後15分にCmax(32.5μg/g)を示した後、半減期86分で消失した。眼球結膜及び眼瞼結膜中濃度は投与後15分にCmax(共に14.7μg/g)を示し、投与後1時間までやや急速に減少した。房水中濃度は投与後30分にCmax(3.1μg/mL)を示した後、半減期71分で消失した2)。
16.8 その他
16.8.1 生物学的同等性試験
ウサギ眼組織内薬物移行動態
レボフロキサシン点眼液1.5%「科研」とクラビット点眼液1.5%について、ウサギの左眼にはレボフロキサシン点眼液1.5%「科研」を、右眼にはクラビット点眼液1.5%をそれぞれ50μL(レボフロキサシン水和物として0.75mg)点眼し、房水中のレボフロキサシン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、有意差は認められず、両剤の生物学的同等性が確認された3)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<結膜炎、角膜炎>
17.1.1 国内第III相試験
細菌性結膜炎及び細菌性角膜炎患者238例(有効性解析対象176例)を対象に、1.5%レボフロキサシン点眼液を1回1滴、1日3回(細菌性角膜炎患者は症状に応じて1日3〜8回の間で適宜増減)、14日間点眼した結果、有効率※は100%であった。また、疾患別臨床効果は表1、有効菌種別臨床効果は表2のとおりであった。
副作用は238例中7例(2.9%)に認められ、主な副作用は眼刺激3件(1.3%)であった4)。
副作用は238例中7例(2.9%)に認められ、主な副作用は眼刺激3件(1.3%)であった4)。
※日本眼感染症学会制定の評価判定基準および抗菌点眼薬臨床評価のガイドライン(案)等に準じて評価。
| 疾患名 | 有効率※(%)〔有効以上〕 |
| 結膜炎 | 100.0(170/170) |
| 角膜炎(角膜潰瘍を含む) | 100.0(6/6) |
| 菌種 | 有効率※(%)〔有効以上〕 |
| ブドウ球菌属 | 100.0(98/98) |
| レンサ球菌属 | 100.0(10/10) |
| 肺炎球菌 | 100.0(25/25) |
| 腸球菌属 | 100.0(4/4) |
| コリネバクテリウム属 | 100.0(79/79) |
| クレブシエラ属 | 100.0(2/2) |
| エンテロバクター属 | 100.0(2/2) |
| セラチア属 | 100.0(2/2) |
| プロテウス属 | 100.0(2/2) |
| インフルエンザ菌 | 100.0(17/17) |
| アシネトバクター属 | 100.0(1/1) |
| アクネ菌 | 100.0(13/13) |
<眼科周術期の無菌化療法>
17.1.2 国内一般臨床試験
眼手術予定患者を対象に、0.5%レボフロキサシン点眼液を1回1滴、1日5回注)、手術前2日間点眼した結果、無菌化率は70.0%(35/50例)であった。
副作用は認められなかった5)。
副作用は認められなかった5)。
注)本剤が承認されている濃度は1.5%、用法・用量は1回1滴、1日3回点眼、症状により適宜増減である。
18. 薬効薬理
18.1 作用機序
18.2 抗菌作用
レボフロキサシン水和物の抗菌スペクトラムは広範囲に及び、レボフロキサシン水和物はブドウ球菌属、肺炎球菌を含むレンサ球菌属、ミクロコッカス属、腸球菌属、コリネバクテリウム属等のグラム陽性菌及び緑膿菌を含むシュードモナス属、インフルエンザ菌、モラクセラ属、セラチア属、クレブシエラ属、プロテウス属、アシネトバクター属、エンテロバクター属等のグラム陰性菌並びに嫌気性菌であるアクネ菌等の眼感染症の起炎菌に対し、強い抗菌力を示す12)(in vitro)。
レボフロキサシン水和物は、ラセミ体であるオフロキサシンの一方の光学活性体(左旋体)であり、オフロキサシンの約2倍の抗菌活性を有する。
レボフロキサシン水和物は、ラセミ体であるオフロキサシンの一方の光学活性体(左旋体)であり、オフロキサシンの約2倍の抗菌活性を有する。
18.3 耐性菌に及ぼす用量の影響
In vitro眼組織中濃度シミュレーションモデルにおいて、1.5%レボフロキサシン点眼液1日3回点眼は0.5%レボフロキサシン点眼液1日3回点眼と比較して、メチシリン感受性黄色ブドウ球菌(HSA201-00027株、レボフロキサシンに対するMIC=0.5μg/mL)及び緑膿菌(HSA201-00094株、レボフロキサシンに対するMIC=1μg/mL)の耐性菌出現を抑制した。また、1.5%レボフロキサシン点眼液1日3回点眼及び0.5%レボフロキサシン点眼液1日3回点眼はいずれも、メチシリン感受性コアグラーゼ陰性ブドウ球菌(HSA201-00039株、レボフロキサシンに対するMIC=0.25μg/mL)の耐性菌出現を抑制した13)14)。
18.4 生物学的同等性試験
実験的緑膿菌角膜感染症に対する効果
レボフロキサシン点眼液1.5%「科研」とクラビット点眼液1.5%について、右眼に緑膿菌を接種したウサギに対し、1回50μL(レボフロキサシン水和物として0.75mg)を菌接種6時間後及び10時間後、翌日以降は1日あたり4時間ごと計3回の点眼を2日間実施し、感染症による角膜混濁のスコア判定を行ったところ、プラセボ(生理食塩液)と比較して両剤とも同様の有意な治療効果が認められた。また、統計解析を行った結果、両剤の治療効果に有意差は認められず、両剤の生物学的同等性が確認された3)。
19. 有効成分に関する理化学的知見
19.1. レボフロキサシン水和物
20. 取扱い上の注意
外箱開封後は、遮光して保存すること。
22. 包装
プラスチック点眼容器
5mL×10本
23. 主要文献
- 日本人健康成人男性を対象とした第I相試験(クラビット点眼液1.5%:2010年12月21日承認、審査報告書)
- ウサギを用いた眼組織分布試験(クラビット点眼液1.5%:2010年12月21日承認、審査報告書)
- 社内資料:生物学的同等性試験(レボフロキサシン点眼液1.5%「科研」)
- 大橋裕一他, あたらしい眼科, 29, 669-678, (2012)
- 臼井正彦, あたらしい眼科, 14, 953-956, (1997)
- Kato, J. et al., Cell, 63, 393-404, (1990) »PubMed
- Hoshino, K. et al., Antimicrob. Agents Chemother., 38, 2623-2627, (1994) »PubMed
- Akasaka, T. et al., Antimicrob. Agents Chemother., 45, 2263-2268, (2001) »PubMed
- Tanaka, M. et al., Antimicrob. Agents Chemother., 41, 2362-2366, (1997) »PubMed
- Onodera, Y. et al., J. Antimicrob. Chemother., 44, 533-536, (1999) »PubMed
- Onodera, Y. et al., Antimicrob. Agents Chemother., 46, 1800-1804, (2002) »PubMed
- 外眼部感染症からの新鮮臨床分離株に対する抗菌力(クラビット点眼液:2000年1月18日承認、申請資料概要ホ.1.(2))
- 耐性化抑制に関する検討(クラビット点眼液1.5%:2010年12月21日承認、審査報告書)
- 長野敬他, あたらしい眼科, 30, 1754-1760, (2013)
24. 文献請求先及び問い合わせ先
文献請求先
科研製薬株式会社
医薬品情報サービス室
〒113-8650
東京都文京区本駒込二丁目28番8号
電話:フリーダイヤル 0120-519-874
製品情報問い合わせ先
科研製薬株式会社
医薬品情報サービス室
〒113-8650
東京都文京区本駒込二丁目28番8号
電話:フリーダイヤル 0120-519-874
26. 製造販売業者等
26.1 製造販売元
ダイト株式会社
富山県富山市八日町326番地
26.2 発売元
科研製薬株式会社
東京都文京区本駒込二丁目28番8号