医薬品情報
| 総称名 | ビダラビン |
|---|---|
| 一般名 | ビダラビン |
| 欧文一般名 | Vidarabine |
| 製剤名 | ビダラビン |
| 薬効分類名 | 抗ウイルス剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AB03 |
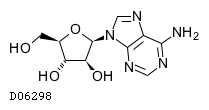
| KEGG DRUG |
D06298
ビダラビン
|
| KEGG DGROUP |
DG02840
抗ヘルペスウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年8月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビダラビン軟膏3%「F」 (後発品) | VIDARABINE ointment | 富士製薬工業 | 6250700M1219 | 74.1円/g |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
本剤は局所治療を目的とした薬剤であるため、発熱、汎発疹等の全身症状がみられる場合又は使用中にあらわれた場合には重症化することがあるので、他の全身的治療を考慮すること。
6. 用法及び用量
患部に適量を1日1〜4回、塗布または貼布する。
7. 用法及び用量に関連する注意
7.1 本剤の使用は、発病初期に近い程効果が期待できるので、原則として発症から5日以内に使用開始すること。
7.2 本剤を7日間使用し、改善の兆しがみられないか、あるいは悪化する場合には他の治療に切り替えること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。静脈投与による動物実験(ラット、ウサギ)で催奇形作用が報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
11. 副作用
11.2 その他の副作用
| 1%未満 | |
| 皮膚 | 接触皮膚炎様症状、刺激感、そう痒感等 |
14. 適用上の注意
14.1 薬剤交付時の注意
本剤の基剤として使用されている油脂性成分は、コンドーム等の避妊用ラテックスゴム製品の品質を劣化・破損する可能性があるため、これらとの接触を避けさせること。
14.2 薬剤使用時の注意
眼科用として、角膜、結膜には使用しないこと。
16. 薬物動態
16.1 血中濃度
健康成人男性(10例)にビダラビン軟膏剤3%10g(ビダラビンとして300mg)を24時間、密封塗布したところ、ビダラビンの血漿中濃度は検出限界以下であった3)。
16.5 排泄
健康成人男性(10例)にビダラビン軟膏剤3%10g(ビダラビンとして300mg)を24時間、密封塗布したところ、塗布開始後48時間までのビダラビン及び主代謝物であるAra-Hx(9-β-D-Arabinofuranosyl Hypoxanthine)の尿中濃度は検出限界以下であった3)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<帯状疱疹>
17.1.1 国内第II相臨床試験、第III相臨床試験及び一般臨床試験
<単純疱疹>
17.1.2 国内第III相臨床試験及び一般臨床試験
17.1.3 国内第III相臨床試験
性器ヘルペス症に対してビダラビン軟膏剤3%又はプラセボを1日3〜4回10日間注)塗布又は貼布した二重盲検比較試験においてウイルス学的効果の検討がなされ、ウイルスの陰性化率はプラセボ投与群に比し有意に優れていた。副作用は認められなかった7)。
注)投与期間中に治癒した場合はその時点で試験を終了し、有用性評価等の最終判定を実施した。
18. 薬効薬理
18.1 作用機序
ウイルスのDNA依存DNAポリメラーゼを強力に阻害することにより抗ウイルス作用が発現するものと推察されている12)。
18.2 抗ウイルス作用
18.2.1 ビダラビンは単純ヘルペスウイルス、サイトメガロウイルス、アデノウイルス、ワクチニアウイルス、水痘・帯状疱疹ウイルス等のDNAウイルスに対しては強い増殖抑制作用を有するが、インフルエンザウイルス等のRNAウイルスに対する増殖抑制作用は認められていない(in vitro)13)14)。
18.2.2 単純ヘルペスウイルス1型を側腹部皮内に接種したマウスにウイルス接種3時間後よりビダラビン3%含有軟膏を12時間ごとに塗布した実験において、ビダラビン投与群ではプラセボ投与群に比し死亡率が有意に低下した。また、ウイルス接種24時間後より塗布を開始した実験でもビダラビン非塗布の対照群に比し有意な生存期間の延長が認められた15)。
18.3 生物学的同等性試験
単純ヘルペスウイルスI型及びアシクロビル耐性ヘルペスウイルスII型の感染マウスにビダラビン軟膏3%「F」及びアラセナ-A軟膏3%を塗布し、治癒効果を比較した。その結果、両製剤間の治癒効果に有意な差は認められず、生物学的同等性が確認された18)。
19. 有効成分に関する理化学的知見
19.1. ビダラビン
20. 取扱い上の注意
高温を避けて保存すること。
22. 包装
チューブ
5g×5本、5g×10本
23. 主要文献
- Miser,J.S.et al., Am.J.Clin.Oncol., 15 (6), 490-493, (1992) »PubMed
- Agarwal,R.P., Cancer Treat.Symp., 2, 17-22, (1984)
- 伊藤裕喜 他, 臨床医薬, 6 (2), 277-284, (1990)
- 新村眞人 他, 臨床医薬, 5 (3), 491-499, (1989)
- 新村眞人 他, 臨床医薬, 5 (8), 1685-1702, (1989)
- 永島敬士 他, 臨床医薬, 6 (2), 285-294, (1990)
- 熊本悦明 他, 臨床医薬, 6 (4), 727-744, (1990)
- 池田重雄 他, 臨床医薬, 6 (1), 175-184, (1990)
- 安藤正明 他, 西日本皮膚科, 52 (2), 365-370, (1990) »DOI
- 上田 宏 他, 皮膚, 32 (2), 285-292, (1990) »DOI
- 上田 宏 他, 皮膚, 32 (2), 293-301, (1990) »DOI
- Muller,W.E.G.et al., Ann.N.Y.Acad.Sci., 284, 34-48, (1977) »PubMed
- Miller,F.A.et al., Antimicrob.Agents Chemother., 8, 136-147, (1968) »PubMed
- 山西弘一 他, 皮膚, 26 (4), 772-775, (1984) »DOI
- 作間俊治 他, 西日本皮膚科, 51 (2), 281-287, (1989) »DOI
- 皆川洋子, 西日本皮膚科, 60 (2), 184-187, (1998) »DOI
- 皆川洋子, 西日本皮膚科, 61 (6), 770-774, (1999) »DOI
- 社内資料:生物学的同等性試験
24. 文献請求先及び問い合わせ先
文献請求先
富士製薬工業株式会社
富山工場 学術情報課
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
製品情報問い合わせ先
富士製薬工業株式会社
富山工場 学術情報課
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
26. 製造販売業者等
26.1 製造販売元
富士製薬工業株式会社
富山県富山市水橋辻ヶ堂1515番地