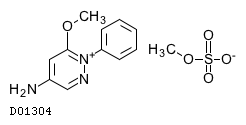
医薬品情報
| 総称名 | アメジニウムメチル硫酸塩 |
|---|---|
| 一般名 | アメジニウムメチル硫酸塩 |
| 欧文一般名 | Amezinium Metilsulfate |
| 製剤名 | アメジニウムメチル硫酸塩錠 |
| 薬効分類名 | 本態性・起立性・透析時低血圧治療剤 |
| 薬効分類番号 | 2190 |
| ATCコード | C01CA25 |
| KEGG DRUG |
D01304
アメジニウムメチル硫酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アメジニウムメチル硫酸塩錠10mg「フソー」 (後発品) | Amezinium Metilsulfate Tablets "FUSO" | 扶桑薬品工業 | 2190022F1199 | 6.4円/錠 |
2. 禁忌
次の患者には投与しないこと
2.1 高血圧症の患者[高血圧症を悪化させる。]
2.2 甲状腺機能亢進症の患者[甲状腺機能亢進症を悪化させる。]
2.3 褐色細胞腫又はパラガングリオーマのある患者[急激な昇圧発作を起こすおそれがある。]
2.4 閉塞隅角緑内障の患者[急激な眼圧上昇をきたすおそれがある。]
2.5 残尿を伴う前立腺肥大のある患者[尿閉をきたすおそれがある。]
4. 効能または効果
本態性低血圧、起立性低血圧、透析施行時の血圧低下の改善
5. 効能または効果に関連する注意
<透析施行時の血圧低下の改善>
透析中に血圧が低下したために透析の継続が困難となることが確認されている慢性腎不全患者のみを対象とすること。
6. 用法及び用量
<本態性低血圧、起立性低血圧>
通常、成人にはアメジニウムメチル硫酸塩として、1日20mgを1日2回に分割経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
<透析施行時の血圧低下の改善>
通常、成人にはアメジニウムメチル硫酸塩として、透析開始時に1回10mgを経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な心臓障害のある患者
本剤の交感神経機能亢進作用を介する心臓刺激作用により、心臓障害が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)において乳汁中への移行が報告されている。
9.7 小児等
乳児及び幼児を対象とした臨床試験は実施していない。
9.8 高齢者
投与に際しては少量から開始するなど用量に留意すること。生理機能(腎機能、肝機能)が低下していることが多い。
10. 相互作用
10.2 併用注意
| ドロキシドパ | 血圧の異常上昇をきたすことがある。 | ドロキシドパから変換したノルアドレナリンの末梢神経終末における再取り込みと不活性化が、本剤により抑制される。 |
| ノルアドレナリン | 血圧の異常上昇をきたすおそれがある。 | ノルアドレナリンの末梢神経終末における再取り込みと不活性化が、本剤により抑制される。 |
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、湿疹、じん麻疹 | ||
| 循環器 | 動悸、頻脈、血圧変動、不整脈(期外収縮、心房細動等)、ほてり感、のぼせた感じ | 胸部不快感、息苦しさ、浮腫、胸内苦悶感 | 四肢冷感 |
| 精神神経系 | めまい、立ちくらみ、頭痛、頭重、気分不良 | ふらつき、全身倦怠感、焦燥感、情緒不安定、不眠、眠気、全身のしびれ、耳鳴 | |
| 消化器 | 嘔気・嘔吐、腹痛 | 胸やけ、食欲不振、腹部膨満、下痢、便秘、口渇感 | |
| 肝臓 | AST、ALTの上昇等の肝機能異常 | ||
| その他 | 排尿障害 | 白血球減少、発熱、全身熱感、頸部痛、下肢痛、視力障害、歩行障害の悪化、構語障害の悪化 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
| tmax(hr) | Cmax(ng/mL) | t1/2β(hr) |
| 2.7±0.4 | 25.3±1.4 | 13.6±2.5 |
| 測定日 | tmax(hr) | Cmax(ng/mL) | t1/2(hr) |
| 非透析日 | 4.4±0.7 | 82.0±4.9 | 25.9±3.9 |
| 透析日※) | 3.6±0.7 | 70.7±5.7 | \ |
16.1.2 効果発現時間
投与後約2時間(健康成人)1)
16.1.3 生物学的同等性試験
アメジニウムメチル硫酸塩錠10mg「フソー」とリズミック錠10mgをクロスオーバー法によりそれぞれ2錠(アメジニウムメチル硫酸塩として20mg注))健康成人男子に絶食時単回経口投与して血漿中アメジニウムメチル硫酸塩濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-48hr(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| アメジニウムメチル硫酸塩錠10mg「フソー」 | 455.9(123.7) | 54.8(17.2) | 2.3(0.9) | 5.7(0.8) |
| リズミック錠10mg | 435.8(106.0) | 48.1(12.0) | 2.4(0.8) | 6.4(1.8) |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 吸収率
53%(外国人データ)4)
16.5 排泄
16.5.1 排泄経路
主として尿中
16.5.2 排泄率
投与後48時間までの尿中には、投与量の33〜40%が未変化体として、1〜2%が代謝物として排泄された1)(健康成人、空腹時10〜20mg 1回注)投与)。
注)本剤の承認された用法及び用量は、本態性低血圧、起立性低血圧は1日20mgを1日2回分割経口投与、透析施行時の血圧低下の改善は透析開始時に1回10mg経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
18.2 血圧上昇作用
19. 有効成分に関する理化学的知見
19.1. アメジニウムメチル硫酸塩
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて保存すること。
22. 包装
(PTP)100錠[10錠×10]
(PTP)500錠[10錠×50]
23. 主要文献
- 中島光好 ほか, 臨床医薬, 4, 495-507, (1988)
- 金丸光隆 ほか, 臨床医薬, 4, 1295-1310, (1988)
- 社内資料:生物学的同等性試験
- Kaumeier S., et al., Arzneim.-Forsch./Drug Res., 31, 1653-1657, (1981) »PubMed
- 筒井末春 ほか, 臨床医薬, 4, 1123-1144, (1988)
- 筒井末春 ほか, 臨床医薬, 6, 995-1013, (1990)
- 斎藤博 ほか, 臨床医薬, 6, 973-994, (1990)
- 畠野尚仁 ほか, 薬理と治療, 16, 1433-1441, (1988)
- 古川清 ほか, 薬理と治療, 16, 1443-1453, (1988)
- Lenke D., et al., Arzneim.-Forsch./Drug Res., 31, 1558-1565, (1981) »PubMed
- Traut M., et al., Arzneim.-Forsch./Drug Res., 31, 1566-1574, (1981) »PubMed
- 湊久夫 ほか, 薬理と治療, 16, 1409-1420, (1988)
- 能勢勇 ほか, 薬理と治療, 16, 1421-1431, (1988)
- Lehmann H.D., et al., Arzneim.-Forsch./Drug Res., 31, 1544-1557, (1981) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
扶桑薬品工業株式会社
研究開発センター 学術室 (9:00〜17:30/土日祝日を除く)
〒536-8523
大阪市城東区森之宮二丁目3番30号
電話:06-6964-2763
FAX:06-6964-2706
製品情報問い合わせ先
扶桑薬品工業株式会社
研究開発センター 学術室 (9:00〜17:30/土日祝日を除く)
〒536-8523
大阪市城東区森之宮二丁目3番30号
電話:06-6964-2763
FAX:06-6964-2706
26. 製造販売業者等
26.1 製造販売元
扶桑薬品工業株式会社
大阪市城東区森之宮二丁目3番11号