医薬品情報
| 総称名 | 硝酸イソソルビド |
|---|---|
| 一般名 | 硝酸イソソルビド |
| 欧文一般名 | Isosorbide Dinitrate |
| 製剤名 | 硝酸イソソルビドテープ |
| 薬効分類名 | 経皮吸収型・虚血性心疾患治療剤 |
| 薬効分類番号 | 2171 |
| ATCコード | C01DA08 |
| KEGG DRUG |
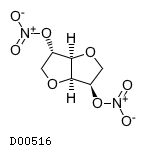
D00516
硝酸イソソルビド
|
| KEGG DGROUP |
DG01270
硝酸イソソルビド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| 硝酸イソソルビドテープ40mg「テイコク」 (後発品) | ISOSORBIDE DINITRATE Tapes 40mg「TEIKOKU」 | 帝國製薬 | 2171700S1168 | 32.2円/枚 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重篤な低血圧又は心原性ショックのある患者[血管拡張作用により更に血圧を低下させ、症状を悪化させるおそれがある。][9.1.1参照]
2.2 閉塞隅角緑内障の患者[眼圧を上昇させるおそれがある。]
2.3 頭部外傷又は脳出血のある患者[頭蓋内圧を上昇させるおそれがある。]
2.4 高度な貧血のある患者[血圧低下により貧血症状(めまい、立ちくらみ等)を悪化させるおそれがある。]
2.5 硝酸・亜硝酸エステル系薬剤に対し過敏症の既往歴のある患者
2.6 ホスホジエステラーゼ5阻害作用を有する薬剤(シルデナフィルクエン酸塩、バルデナフィル塩酸塩水和物、タダラフィル)又はグアニル酸シクラーゼ刺激作用を有する薬剤(リオシグアト)を投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
本剤は狭心症の発作寛解を目的とした治療には不適であるので、この目的のためには速効性の硝酸・亜硝酸エステル系薬剤を使用すること。
6. 用法及び用量
通常、成人に対し、1回1枚(硝酸イソソルビドとして40mg)を胸部、上腹部又は背部のいずれかに貼付する。貼付後24時間又は48時間ごとに貼りかえる。
なお、症状により適宜増減する。
なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤の投与に際しては、症状及び経過を十分に観察し、狭心症発作が増悪するなど効果が認められない場合には他の療法に切りかえること。
8.2 硝酸・亜硝酸エステル系薬剤を使用中の患者で、急に投与を中止したとき症状が悪化した症例が報告されているので、休薬を要する場合には他剤との併用下で徐々に投与量を減じること。
また、患者に医師の指示なしに使用を中止しないよう注意すること。
また、患者に医師の指示なしに使用を中止しないよう注意すること。
8.3 本剤の貼付により過度の血圧低下が起こった場合には、本剤を剥離し、下肢の挙上あるいは昇圧剤の投与等、適切な処置を行うこと。
8.4 起立性低血圧を起こすことがあるので注意すること。
8.5 本剤の投与開始時には、他の硝酸・亜硝酸エステル系薬剤と同様に血管拡張作用による頭痛等の副作用を起こすことがある。このような場合には鎮痛剤を投与するか、減量又は投与中止するなど適切な処置を行うこと。
また、これらの副作用のために注意力、集中力、反射運動能力等の低下が起こることがあるので、このような場合には、自動車の運転等の危険を伴う機械の操作に従事させないよう注意すること。
また、これらの副作用のために注意力、集中力、反射運動能力等の低下が起こることがあるので、このような場合には、自動車の運転等の危険を伴う機械の操作に従事させないよう注意すること。
8.6 本剤の貼付により皮膚症状を起こすことがある。このような場合には、貼付部位を変更しステロイド軟膏等を投与するか、投与中止するなど適切な処置を行うこと。[14.2.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 低血圧の患者(重篤な低血圧のある患者を除く)
血管拡張作用により更に血圧を低下させるおそれがある。[2.1参照]
9.1.2 原発性肺高血圧症の患者
心拍出量が低下しショックを起こすおそれがある。
9.1.3 肥大型閉塞性心筋症の患者
心室内圧較差の増強をもたらし、症状を悪化させるおそれがある。
9.3 肝機能障害患者
減量するなどして使用すること。高い血中濃度が持続するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
高い血中濃度が持続するおそれがある。本剤は、主として肝臓で代謝されるが、一般に肝機能が低下していることが多い。
10. 相互作用
10.1 併用禁忌
| ホスホジエステラーゼ5阻害作用を有する薬剤 シルデナフィルクエン酸塩 (バイアグラ、レバチオ) バルデナフィル塩酸塩水和物 (レビトラ) タダラフィル(シアリス、アドシルカ、ザルティア) [2.6参照] | 併用により、降圧作用を増強することがある。 本剤投与前にこれらの薬剤を服用していないことを十分確認すること。また、本剤投与中及び投与後においてこれらの薬剤を服用しないよう十分注意すること。 | 本剤はcGMPの産生を促進し、一方、ホスホジエステラーゼ5阻害作用を有する薬剤はcGMPの分解を抑制することから、両剤の併用によりcGMPの増大を介する本剤の降圧作用が増強する。 |
| グアニル酸シクラーゼ刺激作用を有する薬剤 リオシグアト (アデムパス) [2.6参照] | 併用により、降圧作用を増強することがある。 本剤投与前にこれらの薬剤を服用していないことを十分確認すること。また、本剤投与中及び投与後においてこれらの薬剤を服用しないよう十分注意すること。 | 本剤とグアニル酸シクラーゼ刺激作用を有する薬剤は、ともにcGMPの産生を促進することから、両剤の併用によりcGMPの増大を介する本剤の降圧作用が増強する。 |
10.2 併用注意
| アルコール摂取 | 血圧低下等が増強されるおそれがある。 | 血管拡張作用が増強される。 |
| 利尿剤 | 血圧低下等が増強されるおそれがある。 | 血圧低下作用を増強させる。 |
| 血管拡張剤 硝酸・亜硝酸エステル系薬剤 | 頭痛、血圧低下等の副作用が増強されるおそれがある。 | 血管拡張作用が増強される。 |
11. 副作用
11.2 その他の副作用
| 5%以上注1) | 0.1〜5%未満注1) | 0.1%未満注1) | 頻度不明 | |
| 循環器 | 血圧低下 | めまい・ふらつき、熱感、潮紅、動悸 | ||
| 精神神経系 | 頭痛 | 脱力感、不快感 | ||
| 過敏症 | 皮膚の刺激感 | 発疹 | ||
| 皮膚 | 一次刺激性の接触皮膚炎(刺激症状、発赤、そう痒等)注2)、アレルギー性接触皮膚炎 | 接触性皮膚炎の後の色素沈着(軽度) | ||
| 消化器 | 悪心 | 胃部不快感、食欲不振、嘔吐 |
14. 適用上の注意
14.1 薬剤交付時の注意
自動体外式除細動器(AED)の妨げにならないように貼付部位を考慮するなど、患者、その家族等に指導することが望ましい。
14.2 薬剤貼付時の注意
14.2.1 皮膚の損傷又は湿疹・皮膚炎等がみられる部位には貼付しないこと。
14.2.2 貼付部位に、発汗、湿潤、汚染等がみられるときは清潔なタオル等でよくふき取ってから本剤を貼付すること。特に夏期は、一般的に密封療法では皮膚症状が誘発されることが知られているので、十分に注意して投与すること。
14.2.3 皮膚刺激を避けるため、毎回貼付部位を変えること。[8.6参照]
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤使用中に本剤又は他の硝酸・亜硝酸エステル系薬剤に対し、耐薬性を生じ、作用が減弱することがある。
なお、類似化合物(ニトログリセリン)の経皮吸収型製剤での労作狭心症に対するコントロールされた外国の臨床試験成績によると、休薬時間を置くことにより、耐薬性が軽減できたとの報告がある1)。
なお、類似化合物(ニトログリセリン)の経皮吸収型製剤での労作狭心症に対するコントロールされた外国の臨床試験成績によると、休薬時間を置くことにより、耐薬性が軽減できたとの報告がある1)。
15.1.2 硝酸イソソルビド製剤の投与によって、メトヘモグロビン血症があらわれたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子20名を対象として、本剤1枚(硝酸イソソルビドとして40mg)を、上胸部に48時間貼付したときの薬物動態は以下のとおりであった2)。
| AUC0→56(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) |
| 80.45±35.03 | 2.67±1.40 | 11.25±7.21 |
平均血漿中硝酸イソソルビド濃度推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
17. 臨床成績
17.3 その他
17.3.1 皮膚刺激性
健康成人男子20名を対象として本剤を48時間貼付した後、皮膚所見を観察した結果、1例において剥離24及び48時間後に軽微な紅斑が認められた3)。
18. 薬効薬理
18.1 作用機序
硝酸イソソルビドはニトログリセリン同様、構造中より一酸化窒素(NO)を放出し、細胞内cGMP量を増加させることで血管平滑筋を弛緩させる。その結果、心臓に対する前後負荷が軽減され、うっ血性心不全の血行動態が改善される。また、比較的太い冠動脈と共に側副血行路も拡張するため、冠血流量は増大する。静脈血管に選択性が高いが、血圧は下降する。効果発現はニトログリセリンより遅く、持続は長い4)。
18.2 運動耐容能の増加作用
19. 有効成分に関する理化学的知見
19.1. 硝酸イソソルビド
20. 取扱い上の注意
開封後は袋の口を閉じて保存すること。
22. 包装
100枚(1枚×100)
350枚(7枚×50)
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
帝國製薬株式会社
医薬営業部 製品情報室
〒103-0024
東京都中央区日本橋小舟町6番6号
電話:0120-189-567
製品情報問い合わせ先
帝國製薬株式会社
医薬営業部 製品情報室
〒103-0024
東京都中央区日本橋小舟町6番6号
電話:0120-189-567
26. 製造販売業者等
26.1 製造販売元
帝國製薬株式会社
香川県東かがわ市三本松567番地