医薬品情報
| 総称名 | リーバクト |
|---|---|
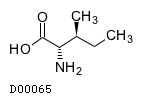
| 一般名 | L-イソロイシン L-ロイシン L-バリン |
| 欧文一般名 | L-Isoleucine L-Leucine L-Valine |
| 薬効分類名 | 分岐鎖アミノ酸製剤 |
| 薬効分類番号 | 3253 |
| KEGG DRUG |
D04958
イソロイシン・ロイシン・バリン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年5月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リーバクト配合経口ゼリー | LIVACT Combination Jelly | EAファーマ | 3253003Q1029 | 164.6円/個 |
2. 禁忌
次の患者には投与しないこと
先天性分岐鎖アミノ酸代謝異常のある患者[メープルシロップ尿症においては痙攣、呼吸障害等があらわれるおそれがある。]
4. 効能または効果
食事摂取量が十分にもかかわらず低アルブミン血症を呈する非代償性肝硬変患者の低アルブミン血症の改善
5. 効能または効果に関連する注意
5.1 本剤の適用対象となる患者は、血清アルブミン値が3.5g/dL以下の低アルブミン血症を呈し、腹水・浮腫又は肝性脳症を現有するかその既往のある非代償性肝硬変患者のうち、食事摂取量が十分にもかかわらず低アルブミン血症を呈する患者、又は、糖尿病や肝性脳症の合併等で総熱量や総蛋白(アミノ酸)量の制限が必要な患者である。糖尿病や肝性脳症の合併等がなく、かつ、十分な食事摂取が可能にもかかわらず食事摂取量が不足の場合には食事指導を行うこと。なお、肝性脳症の発現等が原因で食事摂取量不足の場合には熱量及び蛋白質(アミノ酸)を含む薬剤を投与すること。
5.2 以下の患者は肝硬変が高度に進行しているため本剤の効果が期待できないので投与しないこと。
・肝性脳症で昏睡度がIII度以上の患者
・総ビリルビン値が3mg/dL以上の患者
・肝臓での蛋白合成能が著しく低下した患者
6. 用法及び用量
通常、成人に1回1個を1日3回食後経口投与する。
7. 用法及び用量に関連する注意
7.1 本剤は分岐鎖アミノ酸のみからなる製剤で、本剤のみでは必要アミノ酸の全ては満たすことはできないので、本剤使用時には患者の状態に合わせた必要蛋白量(アミノ酸量)及び熱量(1日蛋白量40g以上、1日熱量1000kcal以上)を食事等により摂取すること。特に蛋白制限を行っている患者に用いる場合には、必要最小限の蛋白量及び熱量を確保しないと本剤の効果は期待できないだけでなく、本剤の長期投与により栄養状態の悪化を招くおそれがあるので注意すること。
7.2 本剤の投与によりBUN又は血中アンモニアの異常が認められる場合、本剤の過剰投与の可能性があるので注意すること。また、長期にわたる過剰投与は栄養状態の悪化のおそれもあるので注意すること。
7.3 本剤を2ヵ月以上投与しても低アルブミン血症の改善が認められない場合は、他の治療に切り替えるなど適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下していることが多く、本剤の投与により血中のアンモニアの上昇等の代謝障害があらわれやすい。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 消化器 | 腹部膨満感、下痢、腹部不快感、食欲不振、口渇 | 嘔気、便秘、腹痛、嘔吐、おくび、胸やけ等 |
| 腎臓 | BUN上昇、血中クレアチニン上昇等 | |
| 代謝 | 血中アンモニア値の上昇等 | |
| 肝臓 | AST上昇、ALT上昇、T-Bilの上昇等 | |
| 皮膚 | 発疹、そう痒等 | |
| その他 | 倦怠感、浮腫(顔、下肢等)、発赤、ほてり |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 本剤はカップ入りのゼリー剤であり、スプーン等で服用しやすい大きさにしてよく噛んで服用すること。
14.1.2 カップ開封後は速やかに服用し、残した場合には廃棄すること。
16. 薬物動態
16.1 血中濃度
リーバクト配合経口ゼリー1個または標準製剤(リーバクト配合顆粒)1包(L-イソロイシン952mg、L-ロイシン1904mg、L-バリン1144mgを含有)をクロスオーバー法により健康成人男性に空腹時単回経口投与し、各分岐鎖アミノ酸の血漿中濃度を測定した。投与前値からの濃度変化量から算出した薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された1)。
| Cmax(μg/mL) | AUC(μg・hr/mL) | Tmax(hr) | t1/2(hr) | ||
| リーバクト配合経口ゼリー | L-イソロイシン | 27.383±6.709 | 42.874±10.604 | 0.776±0.232 | 0.892±0.325 |
| L-ロイシン | 51.850±12.155 | 101.005±19.479 | 0.786±0.219 | 1.520±0.438 | |
| L-バリン | 41.484±8.974 | 91.895±18.526 | 0.849±0.246 | 1.870±0.466 | |
| リーバクト配合顆粒 | L-イソロイシン | 30.982±5.872 | 43.126±9.884 | 0.677±0.178 | 0.787±0.305 |
| L-ロイシン | 58.531±10.587 | 103.088±19.671 | 0.688±0.175 | 1.428±0.243 | |
| L-バリン | 46.796±8.332 | 92.495±19.948 | 0.724±0.173 | 1.823±0.492 | |
17. 臨床成績
17.1 有効性及び安全性に関する試験
(リーバクト配合顆粒の臨床成績)
17.1.1 国内第II相一般臨床試験
低アルブミン血症の非代償性肝硬変患者248例を対象とした6ヵ月間の一般臨床試験において、低アルブミン血症の改善(血清アルブミン値の上昇)、血清総蛋白、トランスフェリン、体重の各栄養指標の改善及び全身倦怠感、易疲労感の改善が2週から2ヵ月の間に認められ、さらに、5ヵ月以降では腹水の改善が認められ、6ヵ月まで継続した。自他覚症状、栄養状態、精神神経症状、Quality of Life、安全度を総合した本剤の有用率は51.2%(104例/203例)であった。副作用発現頻度は5.2%(13/248例)であり、主な副作用は便秘1.6%(4/248例)であった2)。その後、これらの患者の生命予後調査を実施した結果、試験終了後に栄養状態の改善効果がみられた症例及び本剤を長期に投与した症例の生命予後が良好であった3)。
17.1.2 国内第III相比較試験
低アルブミン血症を呈する非代償性肝硬変患者193例を対象に、血清アルブミン値の変動を主たる評価項目として、プラセボ剤との二重盲検比較試験(12週間)を実施した。その結果、本剤投与により血清アルブミン値は平均0.2g/dL上昇し、0.4g/dL以上の上昇を示した例は31.5%(17例/54例)であり、有意に優れた改善効果を示した。自他覚症状、栄養状態、精神神経症状、Quality of Lifeを総合した全般改善度は、本剤群45.8%(38例/83例)、プラセボ群17.3%(14例/81例)であり、さらに安全度を加味した有用率は本剤群49.4%(42例/85例)、プラセボ群18.1%(15例/83例)であった。副作用発現頻度は5.1%(5/98例)であり、主な副作用は腹満感及び下痢でそれぞれ2.0%(2/98例)であった4)。
17.1.3 国内一般臨床試験長期追跡調査
血清アルブミン値の推移と臨床症状、生命予後との関連性を検討する目的で、一般臨床試験の患者を対象に2年間の追跡調査を実施した。その結果、血清アルブミン値の推移は腹水、浮腫、Performance Statusの臨床症状と正の相関をしていることが明らかになった。生命予後との関連性では、1年間に血清アルブミン値が0.2g/dL上昇することにより、不変を基準とした時に比べて単位時間当たりの死亡危険率(ハザード比)は0.77となり、0.4g/dLの上昇により0.59となることが推定された5)。
17.1.4 生命予後に関する国内比較臨床試験
本剤が生命予後に及ぼす影響について明らかにすることを目的として、肝硬変の進行に伴って発現する重篤な合併症である「肝硬変の肝不全病態悪化(腹水、浮腫、肝性脳症、黄疸)、食道静脈瘤破裂(胃静脈瘤破裂)、肝癌発生および死亡」を生命予後につながるイベントとし、これによる中止・脱落までの時間を食事治療群と比較する無作為化比較臨床試験(試験期間2年以上)を実施した。その結果、解析対象症例622例(食事治療群308例、本剤投与群314例)において、本剤投与群で有意に上記の重篤な肝硬変合併症の発現が抑制されていた。また、本剤投与群の食事治療群に対するハザード比は0.67、その95%信頼区間は0.49〜0.93であった6)。副作用発現頻度は12.3%(39/317例)であり、主な副作用は腹満感2.8%(9/317例)、下痢2.2%(7/317例)及び便秘1.9%(6/317例)であった。
18. 薬効薬理
18.1 作用機序
非代償性肝硬変患者の血中アミノ酸インバランスの是正を介して、アルブミン合成促進をもたらすものと考えられる7)。
18.2 慢性肝障害による低蛋白栄養状態に対する栄養状態改善効果
低栄養状態(低アルブミン血症状態)の肝硬変モデルとして四塩化炭素慢性肝障害ラットを用いて本剤の効果を検討した。
18.2.1 本剤と同じ組成の分岐鎖アミノ酸を飼料に0、2.5、5.0、10.0%添加し、自由摂取させて検討したところ、ヒトの投与量に近い2.5%添加群が、無添加群及び他の添加群に比べて窒素出納、窒素出納効率、血漿総蛋白及び血漿アルブミン値上昇の各栄養指標で優れており、血漿Fischer比の是正も適切であった8)。
18.2.2 L-イソロイシン、L-ロイシン、L-バリンの組成比をI(2:1:1)、II(1:2:1.2)、III(1:1:2)と変化させた分岐鎖アミノ酸添加食を自由摂取させたところ、本剤と同じ組成のII群が、他の組成比の群に比べて窒素出納、血漿総蛋白及び血漿アルブミン値上昇の各栄養指標で優れており、血漿Fischer比の是正も適切であった8)。
18.2.3 本剤と同じ組成の分岐鎖アミノ酸又は同一窒素量で同一エネルギー量の必須アミノ酸を飼料へ添加し、自由摂取させて検討したところ、分岐鎖アミノ酸添加群が、必須アミノ酸添加群より高い栄養効果を示し、血小板数減少抑制と肝臓重量の減少抑制もみられた9)。
18.3 脳内モノアミン、脳内アミノ酸に及ぼす影響
肝性脳症モデルとして門脈下大静脈吻合ラットを用いて本剤の効果を検討した。本剤と同じ組成の分岐鎖アミノ酸投与により血漿及び脳内アミノ酸濃度、脳内モノアミン濃度が正常化したが、本剤と同一窒素量で同一エネルギー量の必須アミノ酸を投与した群ではむしろ増悪する傾向がみられた10)。
19. 有効成分に関する理化学的知見
19.1. L-イソロイシン
19.2. L-ロイシン
19.3. L-バリン
20. 取扱い上の注意
20.1 誤用に注意し、小児の手の届かない所に保管すること。
20.2 箱に表示している上下の向きに注意して保管すること。
22. 包装
84個[20g入りカップ]
23. 主要文献
- EAファーマ株式会社:社内資料(生物学的同等性試験)
- 武藤泰敏 他, JJPEN, 11 (9), 1119-1134, (1989)
- 武藤泰敏 他, JJPEN, 14 (5), 765-775, (1992)
- 武藤泰敏 他, JJPEN, 11 (9), 1137-1154, (1989)
- 武藤泰敏 他, JJPEN, 17 (12), 1135-1143, (1995)
- Y.Muto et al., Clinical Gastroenterology&Hepatology, 3 (7), 705-713, (2005)
- 武藤泰敏 他, 日本医事新報, (3101), 3-9, (1983)
- 大橋弘幸 他, 日本消化器病学会雑誌, 86 (8), 1645-1653, (1989) »DOI
- 大橋弘幸 他, 基礎と臨床, 23 (5), 1905-1914, (1989)
- 大橋弘幸 他, 基礎と臨床, 23 (5), 1915-1929, (1989)
24. 文献請求先及び問い合わせ先
文献請求先
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:0120-917-719
製品情報問い合わせ先
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:0120-917-719
26. 製造販売業者等
26.1 製造販売元
EAファーマ株式会社
東京都中央区入船二丁目1番1号