医薬品情報
| 総称名 | バラシクロビル |
|---|---|
| 一般名 | バラシクロビル塩酸塩 |
| 欧文一般名 | Valaciclovir Hydrochloride |
| 薬効分類名 | 抗ウイルス化学療法剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AB11 |
| KEGG DRUG |
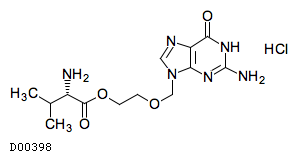
D00398
バラシクロビル塩酸塩
|
| KEGG DGROUP |
DG00647
バラシクロビル
DG02840
抗ヘルペスウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| バラシクロビル錠500mg「TCK」 (後発品) | VALACICLOVIR Tablets「TCK」 | 辰巳化学 | 6250019F1144 | 76.7円/錠 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
本剤の成分あるいはアシクロビルに対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
<性器ヘルペスの再発抑制>
6. 用法及び用量
[成人]
<単純疱疹>
通常、成人にはバラシクロビルとして1回500mgを1日2回経口投与する。
<造血幹細胞移植における単純ヘルペスウイルス感染症(単純疱疹)の発症抑制>
通常、成人にはバラシクロビルとして1回500mgを1日2回造血幹細胞移植施行7日前より施行後35日まで経口投与する。
<帯状疱疹>
通常、成人にはバラシクロビルとして1回1000mgを1日3回経口投与する。
<水痘>
通常、成人にはバラシクロビルとして1回1000mgを1日3回経口投与する。
<性器ヘルペスの再発抑制>
通常、成人にはバラシクロビルとして1回500mgを1日1回経口投与する。なお、HIV感染症の患者(CD4リンパ球数100/mm3以上)にはバラシクロビルとして1回500mgを1日2回経口投与する。
[小児]
<単純疱疹>
通常、体重40kg以上の小児にはバラシクロビルとして1回500mgを1日2回経口投与する。
<造血幹細胞移植における単純ヘルペスウイルス感染症(単純疱疹)の発症抑制>
通常、体重40kg以上の小児にはバラシクロビルとして1回500mgを1日2回造血幹細胞移植施行7日前より施行後35日まで経口投与する。
<帯状疱疹>
通常、体重40kg以上の小児にはバラシクロビルとして1回1000mgを1日3回経口投与する。
<水痘>
通常、体重40kg以上の小児にはバラシクロビルとして1回1000mgを1日3回経口投与する。
<性器ヘルペスの再発抑制>
通常、体重40kg以上の小児にはバラシクロビルとして1回500mgを1日1回経口投与する。なお、HIV感染症の患者(CD4リンパ球数100/mm3以上)にはバラシクロビルとして1回500mgを1日2回経口投与する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 本剤の投与は、発病初期に近いほど効果が期待できるので、早期に投与を開始することが望ましい。
7.2 腎障害を有する成人患者におけるクレアチニンクリアランスに応じた本剤の投与間隔及び投与量の目安は下表のとおりである。また、血液透析を受けている患者に対しては、患者の腎機能、体重又は臨床症状に応じ、クレアチニンクリアランス10mL/min未満の目安よりさらに減量(250mgを24時間毎 等)することを考慮すること。また、血液透析日には透析後に投与すること。なお、腎障害を有する小児患者における本剤の投与間隔及び投与量調節の目安は確立していない。[8.2,9.2.1,9.8,13.1,16.6.1,16.6.2参照]
| クレアチニンクリアランス(mL/min) | ||||
| ≧50 | 30〜49 | 10〜29 | <10 | |
| 単純疱疹 造血幹細胞移植における単純ヘルペスウイルス感染症(単純疱疹)の発症抑制 | 500mgを12時間毎 | 500mgを12時間毎 | 500mgを24時間毎 | 500mgを24時間毎 |
| 帯状疱疹 水痘 | 1000mgを8時間毎 | 1000mgを12時間毎 | 1000mgを24時間毎 | 500mgを24時間毎 |
| 性器ヘルペスの再発抑制 | 500mgを24時間毎 なお、HIV感染症の患者(CD4リンパ球数100/mm3以上)には、500mgを12時間毎 | 500mgを24時間毎 なお、HIV感染症の患者(CD4リンパ球数100/mm3以上)には、500mgを12時間毎 | 250mgを24時間毎 なお、HIV感染症の患者(CD4リンパ球数100/mm3以上)には、500mgを24時間毎 | 250mgを24時間毎 なお、HIV感染症の患者(CD4リンパ球数100/mm3以上)には、500mgを24時間毎 |
<単純疱疹>
7.3 本剤を5日間使用し、改善の兆しが見られないか、あるいは悪化する場合には、他の治療に切り替えること。ただし、初発型性器ヘルペスは重症化する場合があるため、本剤を10日間まで使用可能とする。
<帯状疱疹>
7.4 目安として、皮疹出現後5日以内に投与を開始することが望ましい。
7.5 本剤を7日間使用し、改善の兆しが見られないか、あるいは悪化する場合には、他の治療に切り替えること。
<水痘>
7.6 目安として、皮疹出現後2日以内に投与を開始することが望ましい。
7.7 成人においては本剤を5〜7日間、小児においては本剤を5日間使用し、改善の兆しが見られないか、あるいは悪化する場合には、他の治療に切り替えること。
<性器ヘルペスの再発抑制>
8. 重要な基本的注意
<効能共通>
8.1 各効能又は効果に対し設定された用法及び用量で投与した場合、本剤投与時のアシクロビル曝露は、アシクロビル経口製剤投与時よりも高いことから、副作用の発現に留意すること。
<水痘>
8.3 治療上の有益性と危険性を勘案して投与すること。本剤の使用経験は少ない。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 免疫機能の低下した患者
水痘の治療において、悪性腫瘍、自己免疫性疾患などの免疫機能の低下した患者に対する有効性及び安全性は確立していない。本剤の使用経験がない。
9.1.2 脱水症状をおこしやすいと考えられる患者(腎障害のある患者又は腎機能が低下している患者、高齢者、水痘患者等)
9.2 腎機能障害患者
9.2.1 腎障害のある患者、腎機能が低下している患者
9.3 肝機能障害患者
9.3.1 肝障害のある患者
肝障害のある患者を対象とした臨床試験は実施していない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
活性代謝物のアシクロビルにおいて、動物実験(ラット)の妊娠10日目に、母動物に腎障害のあらわれる大量(200mg/kg/day以上)を皮下投与した実験では、胎児に頭部及び尾の異常が認められたと報告されている1)。
活性代謝物のアシクロビルにおいて、動物実験(ラット)の妊娠10日目に、母動物に腎障害のあらわれる大量(200mg/kg/day以上)を皮下投与した実験では、胎児に頭部及び尾の異常が認められたと報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤投与後、活性代謝物のアシクロビルがヒト乳汁中へ移行することが報告されている。[16.3.1参照]
9.7 小児等
9.7.1 動物実験(ラット)でバラシクロビルを経口投与したときの活性代謝物であるアシクロビルの曝露量は、成熟動物に比べて幼若動物で大きいことが報告されている。
9.7.2 低出生体重児、新生児又は乳児を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
活性代謝物のアシクロビルは、OAT1、MATE1及びMATE2-Kの基質である。[16.7.1参照]
薬物代謝酵素用語
OAT1
薬物代謝酵素用語
MATE1
薬物代謝酵素用語
MATE2-K
10.2 併用注意
| プロベネシド | 本剤の活性代謝物のアシクロビルの排泄が抑制され、アシクロビルの平均血漿中濃度曲線下面積(AUC)が48%増加するとの報告がある2)。特に腎機能低下の可能性がある患者(高齢者等)には慎重に投与すること。 | プロベネシドは尿細管分泌に関わるOAT1及びMATE1を阻害するため、活性代謝物のアシクロビルの腎排泄が抑制されると考えられる。 |
| シメチジン | 本剤の活性代謝物のアシクロビルの排泄が抑制され、アシクロビルのAUCが27%増加するとの報告がある2)。特に腎機能低下の可能性がある患者(高齢者等)には慎重に投与すること。 | シメチジンは尿細管分泌に関わるOAT1、MATE1及びMATE2-Kを阻害するため、活性代謝物のアシクロビルの腎排泄が抑制されると考えられる。 |
| ミコフェノール酸 モフェチル | 本剤の活性代謝物のアシクロビルとの併用により、アシクロビル及びミコフェノール酸 モフェチル代謝物の排泄が抑制され、両方のAUCが増加するとの報告がある3)。特に腎機能低下の可能性がある患者(高齢者等)には慎重に投与すること。 | 活性代謝物のアシクロビルとミコフェノール酸 モフェチル代謝物が尿細管分泌で競合すると考えられる。 |
| テオフィリン | 本剤の活性代謝物のアシクロビルとの併用により、テオフィリンの中毒症状があらわれることがある4)。 | 機序は不明であるが、本剤の活性代謝物のアシクロビルがテオフィリンの代謝を阻害するためテオフィリンの血中濃度が上昇することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシーショック、アナフィラキシー(いずれも頻度不明)
アナフィラキシーショック、アナフィラキシー(呼吸困難、血管性浮腫等)があらわれることがある。
11.1.2 汎血球減少(0.73%)、無顆粒球症(0.24%)、血小板減少(0.36%)、播種性血管内凝固症候群(DIC)(頻度不明)、血小板減少性紫斑病(頻度不明)
11.1.4 精神神経症状(1.09%)
11.1.5 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.6 呼吸抑制、無呼吸(いずれも頻度不明)
11.1.7 間質性肺炎(頻度不明)
11.1.8 肝炎、肝機能障害、黄疸(いずれも頻度不明)
11.1.9 急性膵炎(頻度不明)
11.2 その他の副作用
| 0.5%以上 | 0.5%未満 | 頻度不明 | |
| 過敏症 | − | − | 発疹、蕁麻疹、そう痒、光線過敏症 |
| 肝臓 | 肝機能検査値の上昇 | − | − |
| 消化器 | 腹痛、下痢、腹部不快感、嘔気 | 嘔吐 | − |
| 精神神経系 | 頭痛 | めまい | 意識低下 |
| 腎臓・泌尿器 | 腎障害 | 排尿困難 | 尿閉 |
13. 過量投与
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するように指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.2 薬剤投与時の注意
14.2.1 本剤は主薬の苦みを防ぐため、コーティングを施しているので、錠剤をつぶすことなく服用させること。
14.2.2 本剤を飲みにくい場合には多めの水で1錠ずつ、服用させること。
15. その他の注意
15.1 臨床使用に基づく情報
海外において、本剤の高用量(8g/日)を用い、重度の免疫不全患者(特に進行性HIV感染症患者)におけるCMV感染症予防に対する臨床試験が実施されている。この試験において、本剤が長期間にわたり投与された患者で、腎不全、微小血管溶血性貧血及び血小板減少(ときに併発)の発現が認められている。また、これらの症状は本剤の投与を受けていない同じ基礎疾患、合併症等を有する患者においても発現が認められている。
15.2 非臨床試験に基づく情報
15.2.1 Ames試験及びラット骨髄細胞染色体異常試験では陰性であったが、マウス骨髄小核試験では、高用量(経口投与、500mg/kg、アシクロビルのヒト血漿中濃度の26〜51倍相当)において小核出現頻度の軽度増加を認めた。
15.2.2 マウスリンフォーマ細胞を用いた遺伝子突然変異試験では、代謝活性化系の存在下で1000μg/mL以上の濃度において弱い遺伝毒性(変異コロニー頻度の増加)を示した。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
6例の健康成人にバラシクロビル500mg又は1000mgを単回経口投与した場合、その活性代謝物であるアシクロビルに主に肝臓において速やかに代謝され、血漿中アシクロビルの薬物動態パラメータは下記のとおりであった5)。
| バラシクロビル投与量 | 例数 | 単回経口投与時のアシクロビルの薬物動態パラメータ | |||
| Cmax(μg/mL) | Tmax(hr) | AUC0-∞(μg・hr/mL) | t1/2(hr) | ||
| 500mg | 6 | 3.66±0.83 | 1.50±0.63 | 12.74±2.77 | 2.96±0.41 |
| 1000mg | 6 | 5.84±1.08 | 2.17±0.61 | 22.26±5.73 | 3.55±0.27 |
16.1.2 反復投与
バラシクロビル500mgを1日2回(12時間毎)又は1000mgを1日3回(8時間毎)6日間反復経口投与した場合、数回の投与で血漿中アシクロビル濃度は定常状態に達し、トラフ濃度の平均はそれぞれ0.22〜0.29μg/mL及び0.94〜1.18μg/mLであり蓄積性は認められなかった5)。
16.1.3 生物学的同等性試験
バラシクロビル錠500mg「TCK」とバルトレックス錠500を、クロスオーバー法によりそれぞれ1錠(バラシクロビルとして500mg)健康成人男子に絶食単回経口投与して血漿中活性代謝物(アシクロビル)濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された6)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→12hr(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | |
| バラシクロビル錠500mg「TCK」 | 10.13±2.47 | 2.91±0.75 | 1.83±0.62 | 2.8±0.3 |
| バルトレックス錠500 | 9.80±2.59 | 2.84±0.83 | 1.89±0.63 | 2.8±0.3 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.3 分布
16.4 代謝
ヒト肝において、バラシクロビルの加水分解活性は高かった12)。
16.5 排泄
6例の健康成人にバラシクロビル1000mgを単回経口投与した場合、主な排泄経路は尿中であり、24時間以内の尿中に未変化体、アシクロビル及び9-カルボキシメトキシメチルグアニン(既知のアシクロビルの代謝物)がそれぞれ投与量の0.4%、43.1%及び5.0%排泄された5)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
透析患者(クレアチニンクリアランス値 平均0.93mL/min)にバラシクロビル1000mgを単回経口投与した場合の薬物動態パラメータは以下のとおりであった13)。また、4時間の透析により血漿中のアシクロビルは約70%が除去された。[7.2,9.2.1,13.2参照]
| 被験者 | 例数 | 単回経口投与時のアシクロビルの薬物動態パラメータ | |||
| Cmax(μg/mL) | Tmax注1)(hr) | t1/2(hr) | AUC0-∞(μg・hr/mL) | ||
| 腎機能障害患者 | 18 | 10.60±4.22 | 2.00(1.00-4.00) | 22.2±5.0 | 249.43±105.09 |
16.6.2 高齢者
16.6.3 小児等
小児水痘患者(1〜9歳)にバラシクロビル25mg/kg(顆粒剤50mg/kg)注)を1日3回5日間反復経口投与した場合の初回投与時の血漿中アシクロビルの薬物動態パラメータは下記のとおりであった。投与5日目の血漿中アシクロビル濃度に反復投与による蓄積性は認められなかった15)。
注)水痘における本剤の承認用量は、通常、体重40kg以上の小児にはバラシクロビルとして1回1000mgを1日3回経口投与である。
| 投与量(mg/kg) | 年齢(歳) | 例数 | 初回投与時のアシクロビルの薬物動態パラメータ | |||
| Cmax(μg/mL) | Tmax注1)(hr) | AUC0-∞(μg・hr/mL) | t1/2(hr) | |||
| 25 | 1〜9 | 11注2) | 6.21±2.46 | 1.03(1.00-4.08) | 16.90±6.99 | 1.34±0.29 |
16.7 薬物相互作用
16.7.1 In vitro
16.7.2 吸収過程における相互作用(in situ)
ラット小腸にバラシクロビル0.01mMを含む緩衝液を灌流した時、バラシクロビルの小腸透過係数はペプチドトランスポーター(PEPT)1の基質として知られるβ-ラクタム系抗生物質(アモキシシリン、アンピシリン、セファドロキシル、セファラジン;各々5mM)の高濃度の共存下で有意に低下したことから、バラシクロビルの吸収過程にはPEPT1が関与していることが示された20)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<単純疱疹>
17.1.1 国内第II相試験
成人単純疱疹患者を対象としたバラシクロビルの用量設定試験(計56施設、152例)の結果は以下のとおりである21)。
バラシクロビルの有効率(1回500mg 1日2回5日間投与)は90.0%(36/40例)であった。
バラシクロビルとの関連性が疑われた副作用(臨床検査値異常を含む)の発現状況は以下のとおりである。
| 安全性解析対象症例数 | 発現件数 | 主な種類(件) |
| 131 | 27 | ALT上昇(5)、頭痛(2)、眠気(2)、白血球減少[血液](2)、好酸球増多(2)、尿蛋白(2) |
17.1.2 国内第III相試験
成人単純疱疹患者を対象としたバラシクロビルのアシクロビル対照二重盲検比較試験(計59施設、300例、アシクロビル投与群:1回200mg 1日5回5日間投与)の結果は以下のとおりである22)。
バラシクロビルの有効率(1回500mg 1日2回投与)は95.9%(141/147例)であった。
バラシクロビル又はアシクロビルとの関連性が疑われた副作用(臨床検査値異常を含む)の発現状況は以下のとおりである。
| 安全性解析対象症例数 | 発現症例数(件) | 主な種類(件) | |
| バラシクロビル投与群 | 149 | 33(55) | 眠気(7)、頭痛(6)、白血球増多[尿中](5)、軟便(3)、血小板増多(3) |
| アシクロビル投与群 | 148 | 39(50) | 白血球増多[尿中](4)、不快感[胃](3)、下痢(3)、嘔気(3)、カリウム上昇[血清](3)、頭痛(3) |
<造血幹細胞移植における単純ヘルペスウイルス感染症(単純疱疹)の発症抑制>
17.1.3 国内第III相試験
成人及び小児造血幹細胞移植患者を対象としたバラシクロビルの非対照非盲検試験(計11施設、40例)の結果(臨床効果)は以下のとおりである23)(錠剤及び顆粒剤の成績)。
成人にはバラシクロビルを1回500mg 1日2回、小児には1回25mg/kg 1日2回(1回最高用量は500mg)注)、造血幹細胞移植施行7日前より施行後35日までの計43日間投与することにより、投与期間中の単純疱疹の発症を認めなかった。本試験において、副作用はみられなかった。
注)造血幹細胞移植患者における本剤の承認用量は、通常、体重40kg以上の小児には1回500mgを1日2回経口投与である。
<帯状疱疹>
17.1.4 国内第II相試験
17.1.5 国内第III相試験
皮疹出現後72時間以内の成人帯状疱疹患者を対象としたバラシクロビルのアシクロビル対照二重盲検比較試験(計58施設、202例、アシクロビル投与群:1回800mg 1日5回7日間投与)の結果は以下のとおりである26)。
バラシクロビルの有効率(1回1000mg 1日3回投与)は87.3%(89/102例)であった。
バラシクロビル又はアシクロビルとの関連性が疑われた副作用(臨床検査値異常を含む)の発現状況は以下のとおりである。
| 安全性解析対象症例数 | 発現症例数(件) | 主な種類(件) | |
| バラシクロビル投与群 | 102 | 26(39) | ALT上昇(5)、BUN上昇(3)、血清クレアチニン上昇(3)、倦怠感(2)、腹痛(2)、不快感[胃](2)、下痢(2)、尿糖(2)、AST上昇(2)、急性腎障害(1) |
| アシクロビル投与群 | 98 | 22(32) | 不快感[胃](3)、倦怠感(2)、腹部膨満感(2)、ALT上昇(2)、尿蛋白(2)、血小板増多(2)、BUN上昇(1) |
17.1.6 海外臨床試験
無作為化二重盲検比較試験において、50歳以上の免疫機能が正常な成人帯状疱疹患者を対象に、バラシクロビル1000mg 1日3回7日間投与(384例)又は14日間投与(381例)、アシクロビル800mg 1日5回7日間投与(376例)した3群間で帯状疱疹に伴う疼痛の消失推移を比較した。その結果、バラシクロビル7日間投与群及び14日間投与群はアシクロビル投与群に比べPHN(帯状疱疹後神経痛、Post Herpetic Neuralgia)を含む帯状疱疹に伴う疼痛消失までの期間を有意に短縮した(p=0.001及びp=0.03、Cox比例ハザードモデル)。また、疼痛消失までの日数(中央値)はバラシクロビル7日間投与群で38日、バラシクロビル14日間投与群で44日、アシクロビル7日間投与群で51日であった。なお、バラシクロビル7日間投与群と14日間投与群の間には、有意な差が認められなかった27)。
<水痘>
17.1.7 国内臨床試験
バラシクロビルの非対照非盲検試験(計10施設、43例)の結果は以下のとおりである15)28)(顆粒剤の成績)。
小児水痘患者にバラシクロビルを1回25mg/kg 1日3回注)、5日間投与することにより、前胸部の皮疹数は、顕著な増加を認めることなく、投与2日目以後は減少を続ける推移を示した。なお、本試験の結果とアシクロビルを1回20mg/kg 1日4回、5日間投与した試験における前胸部の皮疹数の推移とを比較した結果は以下のとおりである。
注)本剤の承認用量は、通常、体重40kg以上の小児には1回1000mgを1日3回経口投与である。
| 投与後日数 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 例数 | 41 | 41 | 41 | 41 | 41 | 41 | 40 |
| 平均値 | 30.7 | 54.6 | 57.0 | 49.4 | 40.9 | 35.1 | 26.4 |
| 投与後日数 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 例数 | 51 | 22 | 28 | 38 | 27 | 25 | 19 |
| 平均値 | 45.5 | 38.1 | 48.1 | 51.5 | 36.7 | 25.3 | 18.2 |
バラシクロビルとの関連性が疑われた副作用(臨床検査値異常を含む)の発現状況は以下のとおりである。
| 安全性解析対象症例数 | 発現症例数(件) | 種類(件) |
| 43 | 2(3) | ALT増加(1)、AST増加(1)、便秘(1) |
<性器ヘルペスの再発抑制>
17.1.8 海外臨床試験
成人免疫正常患者及びHIVに重複感染し免疫不全状態にある成人患者を対象とした用量設定試験の結果は以下のとおりである29)30)31)。[5.2,7.8,7.9参照]
性器ヘルペスの未再発率、プラセボ群又はアシクロビル投与群と比較した再発リスク低下率は以下のとおりであった。
| 未再発率 | 再発リスク低下率 (95%信頼区間) | ||||
| 免疫正常患者 | 52週間投与 | 年間6回以上性器ヘルペスの再発を繰り返す患者 | バラシクロビル500mg 1日1回投与群(266例) | 40% | 71%注1) (63〜78) |
| プラセボ投与群(134例) | 5% | ||||
| HIV感染患者 | 48週間投与 | 1年以内に性器ヘルペスが再発した患者 | バラシクロビル500mg 1日2回投与群(355例) | 82% | 27%注2) (−6〜50) |
| アシクロビル1回400mg 1日2回投与群(349例) | 78% |
なお、年間6回以上性器ヘルペスの再発を繰り返す免疫正常患者に対して、バラシクロビル1000mg 1日1回投与注)(269例)又はバラシクロビル250mg 1日2回投与(274例)した場合の、52週間投与時の未再発率は、それぞれ48%、50%であり、プラセボ群と比較した再発リスク低下率(95%信頼区間)は、それぞれ78%(71〜83)、79%(73〜84)であった。
注)性器ヘルペスの再発抑制における本剤の承認用量は、通常、1回500mgを1日1回経口投与である。
バラシクロビルとの関連性が疑われた副作用(臨床検査値異常を含む)の発現状況は以下のとおりである。
| 安全性解析対象症例数 | 発現症例数(件) | 主な種類(発現率) | ||||
| 免疫正常患者 | 52週間投与 | 年間6回以上性器ヘルペスの再発を繰り返す患者 | バラシクロビル500mg 1日1回投与群 | 266 | 88(178) | 頭痛(11〜14%)、悪心(5〜8%)、下痢(2〜7%)等 |
| バラシクロビル1000mg 1日1回投与群注) | 269 | 96(173) | ||||
| バラシクロビル250mg 1日2回投与群注) | 274 | 87(173) | ||||
| HIV感染患者 | 48週間投与 | 1年以内に性器ヘルペスが再発した患者 | バラシクロビル500mg 1日2回投与群 | 355 | 94 | 悪心(7%)、下痢(6%)、頭痛(5%)等 |
17.1.9 海外臨床試験
成人免疫正常患者及びHIVに重複感染し免疫不全状態にある成人患者を対象としたプラセボ対照二重盲検比較試験の結果は以下のとおりである32)33)34)35)。[5.2,7.8,7.9参照]
性器ヘルペスの未再発率、プラセボ群と比較した再発リスク低下率は以下のとおりであった。
| 未再発率 | 再発リスク低下率 (95%信頼区間) | ||||
| 免疫正常患者 | 16週間投与 | 年間8回以上性器ヘルペスの再発を繰り返す患者 | バラシクロビル500mg 1日1回投与群(288例) | 69% | 85%注1) (79〜89) |
| プラセボ投与群 (94例) | 9.5% | ||||
| HIV感染患者 | 6ヵ月間投与 | 年間4回以上性器ヘルペスの再発を繰り返す患者 | バラシクロビル500mg 1日2回投与群(194例) | 81% | 80%注1) (70〜87) |
| プラセボ投与群 (99例) | 37% |
バラシクロビルとの関連性が疑われた副作用(臨床検査値異常を含む)の発現状況は以下のとおりである。
| 安全性解析対象症例数 | 発現症例数(件) | 主な種類(発現率) | ||||
| 免疫正常患者 | 16週間投与 | 年間8回以上性器ヘルペスの再発を繰り返す患者 | バラシクロビル500mg 1日1回投与群 | 288 | 66(112) | 頭痛(7%)、嘔気(6%)等 |
| HIV感染患者 | 6ヵ月間投与 | 年間4回以上性器ヘルペスの再発を繰り返す患者 | バラシクロビル500mg 1日2回投与群 | 194 | 23(-) | 頭痛(5%)、下痢(3%) |
17.2 製造販売後調査等
<帯状疱疹>
国内において実施された特定使用成績調査において、成人帯状疱疹患者にバラシクロビルを投与(平均2944mg/日×7.2日)した316例の帯状疱疹に伴う疼痛の消失推移を検討した。その結果、疼痛消失までの日数(中央値)は35日であり、PHN移行率(皮疹発現90日後の疼痛残存率)は24.7%(78/316例)であった36)。
17.3 その他
18. 薬効薬理
18.1 作用機序
バラシクロビルはアシクロビルのL-バリルエステルであり、経口投与後、主に肝初回通過効果によりアシクロビルに変換されて抗ウイルス作用を発現する。アシクロビルは、単純ヘルペスウイルスあるいは水痘・帯状疱疹ウイルスが感染した細胞内に入ると、ウイルス性チミジンキナーゼにより一リン酸化された後、細胞性キナーゼによりリン酸化され、アシクロビル三リン酸(ACV-TP)となる。ACV-TPは正常基質であるdGTPと競合してウイルスDNAポリメラーゼによりウイルスDNAの3’末端に取り込まれると、ウイルスDNA鎖の伸長を停止させ、ウイルスDNAの複製を阻害する38)39)40)41)42)。
アシクロビルリン酸化の第一段階である一リン酸化は感染細胞内に存在するウイルス性チミジンキナーゼによるため、ウイルス非感染細胞に対する障害性は低いものと考えられる。
アシクロビルリン酸化の第一段階である一リン酸化は感染細胞内に存在するウイルス性チミジンキナーゼによるため、ウイルス非感染細胞に対する障害性は低いものと考えられる。
18.2 抗ウイルス作用
18.2.1 単純ヘルペスウイルスに対する作用
18.2.2 水痘・帯状疱疹ウイルスに対する作用
19. 有効成分に関する理化学的知見
19.1. バラシクロビル塩酸塩
22. 包装
42錠(6錠(PTP)×7)
23. 主要文献
- Stahlmann R,et al., Infection., 15, 261-262, (1987) »PubMed
- De Bony F,et al., Antimicrob Agents Chemother., 46, 458-463, (2002) »PubMed
- Bullingham RES,et al., Clin Pharmacokinet., 34, 429-455, (1998)
- Maeda Y,et al., Biol Pharm Bull., 19, 1591-1595, (1996) »PubMed
- 東 純一ほか, 臨床医薬, 14, 2683-2700, (1998)
- 社内資料:生物学的同等性試験
- Obenshain MK,et al., Pharm Res., 11 (Suppl.10), S435, (1994)
- 食事の影響(バルトレックス錠:2000年7月3日承認、申請資料概要へ.3.1.3)
- Soul-Lawton J,et al., Antimicrob Agents Chemother., 39, 2759-2764, (1995) »PubMed
- Perry CM,et al., Drugs., 52, 754-772, (1996) »PubMed
- Sheffield JS,et al., Am J Obstet Gynecol., 186, 100-102, (2002) »PubMed
- Burnette TC,et al., J Biol Chem., 270, 15827-15831, (1995) »PubMed
- Hara K,et al., Drug Metab Pharmacokinet., 23, 306-312, (2008) »PubMed
- Wang LH,et al., Antimicrob Agents Chemother., 40, 80-85, (1996) »PubMed
- 浅野喜造ほか, 臨床医薬, 23, 183-200, (2007)
- Cheng Y,et al., Drug Metab Dispos., 40, 617-624, (2012) »PubMed
- Takeda M,et al., J Pharmacol Exp Ther., 300, 918-924, (2002) »PubMed
- Nies AT,et al., Expert Opin Drug Metab Toxicol., 8, 1565-1577, (2012) »PubMed
- Tanihara Y,et al., Biochem Pharmacol., 74, 359-371, (2007) »PubMed
- Sinko PJ,et al., Biopharm Drug Dispos., 19, 209-217, (1998) »PubMed
- 新村眞人ほか, 臨床医薬, 18, 1131-1154, (2002)
- 川島 眞ほか, 臨床医薬, 18, 1155-1175, (2002)
- 陶山和明ほか, 臨床医薬, 30, 583-591, (2014)
- 新村眞人ほか, 臨床医薬, 14, 2833-2866, (1998)
- 国内第II相試験(バルトレックス錠:2000年7月3日承認、申請資料概要ト.1.4)
- 新村眞人ほか, 臨床医薬, 14, 2867-2902, (1998)
- Beutner KR,et al., Antimicrob Agents Chemother., 39, 1546-1553, (1995) »PubMed
- 国内臨床試験(バルトレックス顆粒:2007年4月18日承認、申請資料概要2.7.3.3)
- Reitano M,et al., J Infect Dis., 178, 603-610, (1998) »PubMed
- Conant MA,et al., Int J STD AIDS., 13, 12-21, (2002) »PubMed
- 海外臨床試験[1](バルトレックス錠:2006年9月13日承認、審査報告書)
- Patel R,et al., Genitourin Med., 73, 105-109, (1997) »PubMed
- DeJesus E,et al., J Infect Dis., 188, 1009-1016, (2003) »PubMed
- Warren,et al., Clinical Infectious Diseases., 39, S258-266, (2004)
- 海外臨床試験[2](バルトレックス錠:2006年9月13日承認、審査報告書)
- 村川和重ほか, 臨床医薬, 24 (4), 321-335, (2008)
- Corey L,et al., N Engl J Med., 350, 11-20, (2004) »PubMed
- Biron KK,et al., Antimicrob Agents Chemother., 18, 443-447, (1980) »PubMed
- Furman PA,et al., Antimicrob Agents Chemother., 20, 518-524, (1981) »PubMed
- St Clair MH,et al., Antimicrob Agents Chemother., 18, 741-745, (1980) »PubMed
- Furman PA,et al., J Virol., 32, 72-77, (1979) »PubMed
- Miller WH,et al., J Biol Chem., 255, 7204-7207, (1980) »PubMed
- Al-Hasani AM,et al., J Antimicrob Chemother., 18 (Suppl.B), 113-119, (1986)
- McLaren C,et al., Am J Med., 73 (1A), 376-379, (1982) »PubMed
- Machida H, Antimicrob Agents Chemother., 29, 524-526, (1986) »PubMed
- 武藤茂生ほか, 小児科臨床, 36, 2785-2790, (1983)
- 水痘・帯状疱疹ウイルスに対する作用(バルトレックス錠:2000年7月3日承認、申請資料概要ホ.1.1.2)
24. 文献請求先及び問い合わせ先
文献請求先
辰巳化学株式会社
薬事・学術課
〒921-8164
金沢市久安3丁目406番地
電話:076-247-2132
FAX:076-247-5740
製品情報問い合わせ先
辰巳化学株式会社
薬事・学術課
〒921-8164
金沢市久安3丁目406番地
電話:076-247-2132
FAX:076-247-5740
26. 製造販売業者等
26.1 製造販売元
辰巳化学株式会社
金沢市久安3丁目406番地