医薬品情報
| 総称名 | チニダゾール |
|---|---|
| 一般名 | チニダゾール |
| 欧文一般名 | Tinidazole |
| 製剤名 | チニダゾール錠 |
| 薬効分類名 | 抗トリコモナス剤 |
| 薬効分類番号 | 6419 |
| ATCコード | G01AF21 J01XD02 P01AB02 |
| KEGG DRUG |
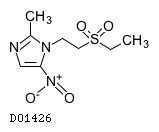
D01426
チニダゾール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| チニダゾール錠200mg「F」 (後発品) | TINIDAZOLE tablets | 富士製薬工業 | 6419001F1048 | 46.9円/錠 | 処方箋医薬品注) |
| チニダゾール錠500mg「F」 (後発品) | TINIDAZOLE tablets | 富士製薬工業 | 6419001F2044 | 125円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 血液疾患のある患者[血液疾患を悪化させるおそれがある。]
2.3 脳、脊髄に器質的疾患のある患者[類似化合物の長期投与により、脳波等に異常を認めたとの報告がある。]
2.4 妊婦(3ヵ月以内)又は妊娠している可能性のある患者[9.5.1参照]
4. 効能または効果
トリコモナス症(腟トリコモナスによる感染症)
6. 用法及び用量
チニダゾール錠200mg「F」
<チニダゾール錠200mg「F」>
チニダゾールとして、通常成人1クールとして1回200mg、1日2回、7日間経口投与する。又はチニダゾールとして、通常成人2,000mgを1回経口投与しても良い。
<製剤共通>
投薬終了後、腟トリコモナスを検出した場合は、投薬終了時より少なくとも1週間ぐらいの間隔を置いて再投与する。
チニダゾール錠500mg「F」
<チニダゾール錠500mg「F」>
チニダゾールとして、通常成人2,000mgを1回経口投与する。
<製剤共通>
投薬終了後、腟トリコモナスを検出した場合は、投薬終了時より少なくとも1週間ぐらいの間隔を置いて再投与する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.5.1 妊婦(3ヵ月以内)又は妊娠している可能性のある女性
投与しないこと。経口投与により胎盤関門を通過して胎児へ移行することが知られている。[2.4参照]
9.5.2 妊婦(妊娠3ヵ月以内の女性を除く)
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
授乳しないことが望ましい。乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
用量又は投与間隔に留意するなど慎重に投与すること。本剤は、主として腎臓から排泄されるが、高齢者では腎機能が低下していることが多いため高い血中濃度が持続するおそれがある。
10. 相互作用
10.2 併用注意
| アルコール | 腹部の疝痛、嘔吐、潮紅があらわれることがあるので、投与期間中及び投与後3日間はアルコールの摂取を避けること。 | 機序は不明である。 |
11. 副作用
11.2 その他の副作用
| 頻度不明 | |
| 過敏症 | 発疹 |
| 消化器 | 食欲不振、悪心・嘔吐、胃部不快感、舌苔、腹痛、下痢 |
| 血液 | 白血球減少 |
| 泌尿・生殖器 | 治療実施中にCandida albicansが出現 |
| その他 | 頭痛・頭重、口渇、けん怠感、尿着色 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与(200mg)
チニダゾールを健康成人7例に200mg 1回経口投与したときの最高血中濃度は3〜7μg/ml(1.5〜4.5時間後)で、以後漸減して24時間後に検出限界値(1μg/ml)以下となった。血中濃度半減期は平均5.4時間であった6)。
16.1.2 連続投与
チニダゾールを健康成人3例に1回200mg 1日2回7日間連続経口投与したとき、投与開始後2〜7日の血中濃度は5〜12μg/mlで、蓄積傾向は認められていない7)。
16.1.3 単回投与(2,000mg)
チニダゾールを健康成人6例に2,000mg 1回経口投与したときの血中濃度は最高値50〜70μg/ml(2〜3時間後)を示し、以後漸減して24時間後で最高値の1/2〜1/3となり、72時間後にはほぼ検出限界値(1μg/ml)以下となっている8)。
16.1.4 生物学的同等性試験
(1)チニダゾール錠200mg「F」
チニダゾール錠200mg「F」とファシジン錠200mgを、クロスオーバー法によりそれぞれ1錠(チニダゾールとして200mg)健康成人男子に単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された9)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→inf(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | |
| チニダゾール錠200mg「F」 | 98.44±11.88 | 4.84±0.58 | 1.82±0.95 | 15.15±2.04 |
| ファシジン錠200mg | 92.24±9.28 | 4.66±0.58 | 1.82±0.88 | 14.41±1.68 |
※血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(2)チニダゾール錠500mg「F」
チニダゾール錠500mg「F」とファシジン錠500mgを、クロスオーバー法によりそれぞれ1錠(チニダゾールとして500mg)健康成人男子に単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された9)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→inf(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | |
| チニダゾール錠500mg「F」 | 232.22±31.28 | 12.18±1.93 | 1.20±0.53 | 15.09±2.37 |
| ファシジン錠500mg | 234.21±16.94 | 11.42±1.98 | 1.43±1.19 | 15.48±1.73 |
※血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
チニダゾールを健康成人又はトリコモナス腟炎の患者に2,000mg 1回経口投与した試験では、投与後48時間以上にわたり、Trichomonas vaginalisの殺虫濃度以上のチニダゾールが腟内分泌液中に認められた10)。
16.5 排泄
18. 薬効薬理
18.1 作用機序
明確な機序は不明である。
18.2 抗原虫作用及び抗菌作用
19. 有効成分に関する理化学的知見
19.1. チニダゾール
22. 包装
<チニダゾール錠200mg「F」>
60錠[6錠(PTP)×10]
<チニダゾール錠500mg「F」>
60錠[6錠(PTP)×10]
23. 主要文献
- Gupta. R. L. et al., Mutation Res., 370 (3-4), 195-201, (1996)
- Lopez Nigro MM. et al., Toxicol Lett., 180 (1), 46-52, (2008)
- Rustia, M. et al., J.Natl.Cancer Inst., 48 (3), 721-729, (1972) »PubMed
- Roe, F. J. C. et al., Surgery., 93 (1), 158-164, (1983)
- Rustia, M. et al., J. Natl.Cancer Inst., 63 (3), 863-868, (1979) »PubMed
- 木村義尚ほか, 応用薬理, 8 (5), 573-587, (1974)
- 松田静治ほか, 臨床婦人科産科, 32 (2), 141-147, (1978)
- 正木雄三郎ほか, 基礎と臨床, 10 (2), 534-540, (1976)
- 社内資料:生物学的同等性試験に関する資料
- 張南薫ほか, 産科と婦人科, 44 (2), 225-229, (1977)
- 浅見敬三ほか, 寄生虫学雑誌, 21 (5), 349-354, (1972)
- 尾崎文雄ほか, 寄生虫学雑誌, 21 (5), 355-361, (1972)
- 尾崎文雄ほか, 寄生虫学雑誌, 24 (1), 16-22, (1975)
- 二宮敬宇ほか, Jpn.J.Antibiot., 29 (3), 325-331, (1976) »PubMed
- Klastersky, J. et al., Antimicrob. Agents & Chemother., 12 (5), 563-570, (1977)
24. 文献請求先及び問い合わせ先
文献請求先
富士製薬工業株式会社
富山工場 学術情報課
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
製品情報問い合わせ先
富士製薬工業株式会社
富山工場 学術情報課
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
26. 製造販売業者等
26.1 製造販売元
富士製薬工業株式会社
富山県富山市水橋辻ヶ堂1515番地