医薬品情報
| 総称名 | ヒドロクロロチアジド |
|---|---|
| 一般名 | ヒドロクロロチアジド |
| 欧文一般名 | Hydrochlorothiazide |
| 製剤名 | ヒドロクロロチアジド錠 |
| 薬効分類名 | 降圧利尿剤 |
| 薬効分類番号 | 2132 2149 |
| ATCコード | C03AA03 |
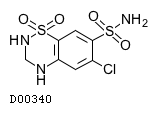
| KEGG DRUG |
D00340
ヒドロクロロチアジド
|
| KEGG DGROUP |
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年5月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ヒドロクロロチアジド錠12.5mg「トーワ」 (後発品) | HYDROCHLOROTHIAZIDE TABLETS 12.5mg"TOWA" | 東和薬品 | 2132004F2037 | 5.9円/錠 | 処方箋医薬品注) |
| ヒドロクロロチアジド錠25mg「トーワ」 (後発品) | HYDROCHLOROTHIAZIDE TABLETS 25mg"TOWA" | 東和薬品 | 2132004F1103 | 5.9円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
6. 用法及び用量
通常、成人にはヒドロクロロチアジドとして1回25〜100mgを1日1〜2回経口投与する。
なお、年齢、症状により適宜増減する。
ただし、高血圧症に用いる場合には少量から投与を開始して徐々に増量すること。また、悪性高血圧に用いる場合には、通常、他の降圧剤と併用すること。
なお、年齢、症状により適宜増減する。
ただし、高血圧症に用いる場合には少量から投与を開始して徐々に増量すること。また、悪性高血圧に用いる場合には、通常、他の降圧剤と併用すること。
8. 重要な基本的注意
8.1 本剤の利尿効果は急激にあらわれることがあるので、電解質失調、脱水に十分注意し、少量から投与を開始して、徐々に増量すること。
8.2 連用する場合、電解質失調があらわれることがあるので定期的に検査を行うこと。
8.3 夜間の休息が特に必要な患者には、夜間の排尿を避けるため、午前中に投与することが望ましい。
8.4 降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.5 重篤な血液障害があらわれることがあるので、定期的に検査を実施するなど観察を十分に行うこと。[11.1.1参照]
8.6 急性近視、閉塞隅角緑内障、脈絡膜滲出があらわれることがあるので、急激な視力の低下や眼痛等の異常が認められた場合には、直ちに眼科医の診察を受けるよう、患者に指導すること。[11.1.8参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な冠動脈硬化症又は脳動脈硬化症のある患者
急激な利尿があらわれた場合、急速な血漿量減少、血液濃縮を来し、血栓塞栓症を誘発するおそれがある。
9.1.2 本人又は両親、兄弟に痛風、糖尿病のある患者
高尿酸血症、高血糖症を来し、痛風、糖尿病の悪化や顕性化のおそれがある。
9.1.3 下痢、嘔吐のある患者
電解質失調があらわれることがある。
9.1.4 高カルシウム血症、副甲状腺機能亢進症のある患者
血清カルシウムを上昇させるおそれがある。
9.1.5 減塩療法時の患者
低ナトリウム血症を起こすおそれがある。[11.1.6参照]
9.1.6 交感神経切除後の患者
本剤の降圧作用が増強される。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 進行した肝硬変症のある患者
肝性昏睡を誘発することがある。
9.3.2 肝疾患・肝機能障害のある患者
肝性昏睡を起こすおそれがある。
9.5 妊婦
妊娠後期には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
チアジド系薬剤では新生児又は乳児に高ビリルビン血症、血小板減少症等を起こすことがある。また、利尿効果に基づく血漿量減少、血液濃縮、子宮・胎盤血流量減少があらわれることがある。
チアジド系薬剤では新生児又は乳児に高ビリルビン血症、血小板減少症等を起こすことがある。また、利尿効果に基づく血漿量減少、血液濃縮、子宮・胎盤血流量減少があらわれることがある。
9.6 授乳婦
授乳しないことが望ましい。ヒト母乳中への移行が報告されている。
9.7 小児等
乳児は電解質バランスがくずれやすい。
9.8 高齢者
以下の点に注意し、少量から投与を開始するなど慎重に投与すること。
・急激な利尿は血漿量の減少を来し、脱水、低血圧等による立ちくらみ、めまい、失神等を起こすことがある。
・特に心疾患等で浮腫のある高齢者では急激な利尿は急速な血漿量の減少と血液濃縮を来し、脳梗塞等の血栓塞栓症を誘発するおそれがある。
・一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。
・低ナトリウム血症、低カリウム血症があらわれやすい。
10. 相互作用
10.1 併用禁忌
| デスモプレシン酢酸塩水和物 ミニリンメルト (男性における夜間多尿による夜間頻尿) [2.5参照] | 低ナトリウム血症が発現するおそれがある。 | いずれも低ナトリウム血症が発現するおそれがある。 |
10.2 併用注意
| バルビツール酸誘導体 | 起立性低血圧が増強されることがある。 | これらの薬剤の中枢抑制作用と利尿剤の降圧作用による。 |
| あへんアルカロイド系麻薬 | 起立性低血圧が増強されることがある。 | あへんアルカロイドの大量投与で血圧下降があらわれることが報告されている。 |
| アルコール | 起立性低血圧が増強されることがある。 | 血管拡張作用を有するアルコールとの併用により降圧作用が増強される可能性がある。 |
| 昇圧アミン ノルアドレナリン アドレナリン | 昇圧アミンの作用を減弱することがある。手術前の患者に使用する場合、本剤の一時休薬等の処置を講ずること。 | チアジド系利尿剤は昇圧アミンに対する血管壁の反応性を低下させることが報告されている。 |
| ツボクラリン及びその類似作用物質 ツボクラリン塩化物塩酸塩水和物 パンクロニウム臭化物 | ツボクラリン及びその類似作用物質の麻痺作用を増強することがある。 手術前の患者に使用する場合、本剤の一時休薬等の処置を講ずること。 | 本剤による血清カリウム値の低下により、これらの薬剤の神経・筋遮断作用を増強すると考えられている。 |
| 降圧作用を有する他の薬剤 ACE阻害剤 β-遮断剤 ニトログリセリン 等 | 降圧作用を増強するおそれがある。 降圧剤の用量調節等に注意すること。 | 作用機序の異なる降圧作用により互いに協力的に作用する。 |
| ジギタリス剤 ジゴキシン ジギトキシン | ジギタリスの心臓に対する作用を増強し、不整脈等を起こすことがある。血清カリウム値に十分注意すること。 | 本剤による血清カリウム値の低下により多量のジギタリスが心筋Na-K ATPaseに結合し、心収縮力増強と不整脈が起こる。マグネシウム低下も同様の作用を示す。 |
| 乳酸ナトリウム | チアジド系薬剤による代謝性アルカローシス、低カリウム血症を増強することがある。 | 本剤によるカリウム排泄作用により低カリウム血症や代謝性アルカローシスが引き起こされることがある。アルカリ化剤である乳酸ナトリウムの併用はこの状態をさらに増強させる。 |
| 炭酸リチウム | 振戦、消化器愁訴等、リチウム中毒を増強することがある。血清リチウム濃度に注意すること。 | 本剤は腎におけるリチウムの再吸収を促進し、リチウムの血中濃度を上昇させる。 |
| 糖質副腎皮質ホルモン剤 ACTH | 低カリウム血症が発現することがある。 | 両薬剤ともカリウム排泄作用を持つ。 |
| グリチルリチン製剤 | 血清カリウム値の低下があらわれやすくなる。 | グリチルリチン製剤は低カリウム血症を主徴とした偽アルドステロン症を引き起こすことがある。従って両剤の併用により低カリウム血症を増強する可能性がある。 |
| 糖尿病用剤 SU剤 インスリン | 糖尿病用剤の作用を著しく減弱することがある。 | 機序は明確ではないが、本剤によるカリウム喪失により膵臓のβ細胞のインスリン放出が低下すると考えられている。 |
| コレスチラミン | チアジド系薬剤の作用が減弱することがある。 | コレスチラミンの吸着作用によりチアジド系薬剤の吸収が阻害されることがある。 |
| 非ステロイド性消炎鎮痛剤 インドメタシン | チアジド系薬剤の作用が減弱することがある。 | 非ステロイド系消炎鎮痛剤のプロスタグランジン合成酵素阻害作用により、腎内プロスタグランジンが減少し、水・ナトリウムの体内貯留が生じて本剤の作用と拮抗する。 |
| スルフィンピラゾン | チアジド系薬剤はスルフィンピラゾンの尿酸排泄作用に拮抗することがある。 | チアジド系利尿剤は、腎での尿酸分泌の阻害、尿酸再吸収の増大作用を有すると考えられ、スルフィンピラゾンの尿酸排泄作用に拮抗することがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 再生不良性貧血、溶血性貧血(いずれも頻度不明)[8.5参照]
11.1.2 壊死性血管炎(頻度不明)
11.1.3 間質性肺炎、肺水腫、急性呼吸窮迫症候群(いずれも頻度不明)
11.1.4 全身性紅斑性狼瘡の悪化(頻度不明)
11.1.5 アナフィラキシー(頻度不明)
11.1.6 低ナトリウム血症(頻度不明)
11.1.7 低カリウム血症(頻度不明)
倦怠感、脱力感、不整脈等を伴う低カリウム血症があらわれることがある。[2.3参照]
11.1.8 急性近視、閉塞隅角緑内障、脈絡膜滲出(いずれも頻度不明)
急性近視(霧視、視力低下等を含む)、閉塞隅角緑内障、脈絡膜滲出があらわれることがある。[8.6参照]
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 呼吸困難、発疹、じん麻疹、顔面潮紅、光線過敏症 | ||
| 血液 | 白血球減少、血小板減少、紫斑 | ||
| 肝臓 | 黄疸 | ||
| 代謝異常 | 低マグネシウム血症、低クロール性アルカローシス、血清カルシウムの上昇等の電解質失調、血清脂質増加、高尿酸血症、高血糖症 | ||
| 消化器 | 食欲不振、悪心・嘔吐、腹部不快感 | 下痢・口渇 | 腹部の仙痛、膵炎、唾液腺炎、便秘 |
| 精神神経系 | 眩暈 | 頭痛 | 知覚異常 |
| 眼 | 視力異常(霧視等)、黄視症 | ||
| 循環器 | 起立性低血圧 | 不整脈 | |
| 皮膚 | 皮膚エリテマトーデス | ||
| その他 | 倦怠感 | 鼻閉 | インポテンス、高カルシウム血症を伴う副甲状腺障害、筋痙攣 |
12. 臨床検査結果に及ぼす影響
甲状腺障害のない患者の血清PBIを低下させることがある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人に14C-ヒドロクロロチアジド5mgを経口投与したとき、血漿中放射能濃度は投与後60〜120分で最高に達し、半減期は二相性を示した。ヒドロクロロチアジド75mgを健康成人に経口投与したとき、α相及びβ相の半減期はそれぞれ約1.7時間及び約13時間であった(外国人データ)。7)
16.1.2 生物学的同等性試験
<ヒドロクロロチアジド錠12.5mg「トーワ」>
ヒドロクロロチアジド錠12.5mg「トーワ」2錠とダイクロトライド錠25mg 1錠(ヒドロクロロチアジドとして25mg)を、クロスオーバー法により健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。8)
| 製剤投与量 (ヒドロクロロチアジドとして) | 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | ||
| ヒドロクロロチアジド錠12.5mg「トーワ」 | 2錠 (25mg) | 1116±202 | 216.4±56.1 | 2.13±0.88 | 10.46±1.25 |
| ダイクロトライド錠25mg | 1錠 (25mg) | 1135±183 | 229.3±73.9 | 2.13±0.71 | 10.37±1.24 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<ヒドロクロロチアジド錠25mg「トーワ」>
ヒドロクロロチアジド錠25mg「トーワ」とダイクロトライド錠25mgをクロスオーバー法によりそれぞれ2錠(ヒドロクロロチアジドとして50mg)家兎(n=10)に絶食単回経口投与し、血漿中未変化体濃度について比較検討した結果、両製剤間の生物学的利用率には有意差は認められなかった。9)
16.2 吸収
健康成人に14C-ヒドロクロロチアジド5mgを経口投与したとき、投与量の60〜80%は消化管から吸収され、特に小腸上部での吸収が顕著であった(外国人データ)。7)
16.5 排泄
ヒドロクロロチアジド75mgを健康成人に経口投与したとき、ヒドロクロロチアジドはほとんど代謝されることなく尿中へ排泄された。そのほとんどは12時間までに排泄され、4日間の尿中平均累積排泄率は投与量の70%であった(外国人データ)。7)
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
<高血圧症>
69.4%(59/85例)の有効率を示した。
<心性、腎性、肝性等の浮腫>
75%(27/36例)の有効率を示した。
18. 薬効薬理
18.1 作用機序
腎遠位尿細管におけるNa+とCl−の再吸収を抑制し、水の排泄を促進させる。炭酸脱水酵素阻害作用も有する。降圧作用は、初期には循環血流量の低下により、長期的には末梢血管の拡張によると考えられている。10)
18.2 降圧作用
ヒドロクロロチアジドは高血圧自然発症ラット及び高血圧症患者において血圧を有意に低下させるが、正常血圧には影響を及ぼさないことが認められている。ヒドロクロロチアジドの降圧作用機序の詳細は明らかではないが、高血圧症患者での試験で投与初期においては循環血液量と細胞外液量の減少による二次的な心拍出量低下に伴って血圧が下降し、長期投与時においては心拍出量は正常に復し末梢血管抵抗は減少することが認められている。これは細胞外液量の減少と心拍出量低下によって自己調節機構が働くためと考えられている。また一方、摘出モルモット大動脈を用いた試験結果(in vitro)から血管壁への直接作用も考えられている。11)12)13)14)15)
19. 有効成分に関する理化学的知見
19.1. ヒドロクロロチアジド
20. 取扱い上の注意
外箱開封後は、遮光して保存すること。
22. 包装
<ヒドロクロロチアジド錠12.5mg「トーワ」>
100錠[10錠×10:PTP]
500錠[10錠×50:PTP]
500錠[バラ、乾燥剤入り]
<ヒドロクロロチアジド錠25mg「トーワ」>
100錠[10錠×10:PTP]
1000錠[10錠×100:PTP]
1000錠[バラ、乾燥剤入り]
23. 主要文献
- Rai A,et al., Am J Respir Crit Care Med., 193, A1890, (2016)
- Jansson PS,et al., J Emerg Med., 55, 836-840, (2018) »PubMed
- Vadas P.Am J Emerg Med., 38, 1299.e1-2, (2020)
- Kane SP,et al., Perfusion., 33, 320-322, (2018) »PubMed
- Pottegard,A.et al., J.Intern.Med., 282 (4), 322-331, (2017) »PubMed
- Pedersen,S.A.et al., J.Am.Acad.Dermatol., 78 (4), 673-681, (2018) »PubMed
- Beerman,B.et al., Clin.Pharmacol.Ther., 19 (5 Part1), 531-537, (1976)
- 松木俊二ほか, 新薬と臨牀, 61 (3), 617-624, (2012)
- 社内資料:生物学的同等性試験(錠25mg)
- 第十七改正日本薬局方解説書, C-4141-4145, (2016)
- Kohler,C.et al., Eur.J.Pharmacol., 42, 161-169, (1977) »PubMed
- 飯村攻ほか, 綜合臨牀, 9 (10), 1861-1869, (1960)
- Juchems,R.et al., Med.Klin., 62 (15), 600-604, (1967) »PubMed
- Shah,S.et al., Amer.Heart J., 95 (5), 611-618, (1978) »PubMed
- Davila,D.et al., Pharmacology., 22, 108-112, (1981) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
製品情報問い合わせ先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
26. 製造販売業者等
26.1 製造販売元
東和薬品株式会社
大阪府門真市新橋町2番11号