医薬品情報
| 総称名 | サルブタモール |
|---|---|
| 一般名 | サルブタモール硫酸塩 |
| 欧文一般名 | Salbutamol Sulfate |
| 製剤名 | サルブタモール硫酸塩錠 |
| 薬効分類名 | 気管支拡張剤 |
| 薬効分類番号 | 2254 |
| ATCコード | R03AC02 R03CC02 |
| KEGG DRUG |
D00683
サルブタモール硫酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年8月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| サルブタモール錠2mg「日医工」 (後発品) | Salbutamol Tablets | 日医工 | 2254001F1102 | 5.7円/錠 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常成人1回2錠を1日3回経口投与し、症状の激しい場合には1回4錠を1日3回経口投与する。
なお、年令・症状により適宜増減する。
なお、年令・症状により適宜増減する。
小児の標準投与量は成人用量の1/4〜1/2量であり、通常5才以上15才未満は1回1〜2錠を1日3回、5才未満は1回1〜1.5錠を1日3回経口投与する。
8. 重要な基本的注意
8.1 用法及び用量どおり正しく使用しても効果が認められない場合は、本剤が適当でないと考えられるので、投与を中止すること。なお、小児に投与する場合には、使用法を正しく指導し、経過の観察を十分に行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 甲状腺機能亢進症の患者
甲状腺ホルモンの分泌促進により症状を悪化させるおそれがある。
9.1.2 高血圧の患者
α及びβ1作用により血圧を上昇させるおそれがある。
9.1.3 心疾患を有する患者
β1作用により症状を悪化させるおそれがある。
9.1.4 糖尿病の患者
グリコーゲン分解作用により症状を悪化させるおそれがある。
9.1.5 低酸素血症の患者
血清カリウム値をモニターすることが望ましい。低酸素血症は血清カリウム値の低下が心リズムに及ぼす作用を増強することがある。[11.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(マウス)で催奇形作用が報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に、生理機能が低下している。
10. 相互作用
10.2 併用注意
| カテコールアミン アドレナリン イソプレナリン塩酸塩等 | 不整脈、場合によっては心停止を起こすおそれがある。 | アドレナリン、イソプレナリン塩酸塩等のカテコールアミン併用により、アドレナリン作動性神経刺激の増大が起きる。 そのため不整脈を起こすことがある。 |
| キサンチン誘導体 ステロイド剤 利尿剤 [11.1参照] | 低カリウム血症による不整脈を起こすおそれがある。 血清カリウム値のモニターを行うこと。 | キサンチン誘導体はアドレナリン作動性神経刺激を増大させるため、血清カリウム値の低下を増強することがある。 ステロイド剤及び利尿剤は尿細管でのカリウム排泄促進作用があるため、血清カリウム値の低下が増強することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 重篤な血清カリウム値低下(頻度不明)
11.1.2 ショック、アナフィラキシー(いずれも頻度不明)
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | そう痒感、血管性浮腫 | 発疹、血圧低下、蕁麻疹 | |
| 循環器 | 心悸亢進、脈拍増加 | 不整脈、血圧変動 | |
| 精神神経系 | 頭痛、振戦、睡眠障害 | めまい、眠気、興奮、下肢疼痛 | 落ち着きのなさ |
| 消化器 | 食欲不振、悪心・嘔吐、下痢 | ||
| その他 | 口渇、湿疹 | 口内炎、発汗 | 潮紅、浮腫、筋痙攣 |
13. 過量投与
13.1 症状
13.2 処置
本剤の投与の中止を考慮し、心血管系症状(脈拍増加、心悸亢進等)がみられる患者では心臓選択性β遮断剤の投与等の適切な処置を検討すること。ただしβ遮断剤の使用にあたっては、気管支攣縮の既往のある患者では十分に注意すること。[8.2参照]
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回経口投与
16.3 分布
ラットに3H標識サルブタモール25mg/kgを単回経口投与した結果、投与後1〜2時間で血中及び各組織内濃度は最高値に達し、肝臓、脂肪、筋肉で高く、次いで腎臓、肺、心臓、脾臓の順であり、脳にはほとんど移行しなかった4)。
16.4 代謝
ラット、ウサギ経口投与時の排泄物中の主代謝産物はグルクロン酸抱合体であり、ラットにおける胆汁排泄研究では肝臓中でつくられていることが示されている4)。
16.5 排泄
18. 薬効薬理
18.1 作用機序
サルブタモールは短時間作用性β2刺激剤であり、アデニル酸シクラーゼを活性化し細胞内の環状アデノシン一リン酸を増加させることで、気管支平滑筋を弛緩させる。
18.2 β2受容体選択性
モルモットにサルブタモールを経口投与した実験において、サルブタモールはβ2受容体刺激による気管支拡張作用が強く、一方β1受容体刺激による心刺激作用は弱いことが明らかにされており、β2受容体に選択的に作用する性質を有する6)。
18.3 気管支拡張作用
18.3.1 モルモットにサルブタモールを経口投与し、1時間後に1%ヒスタミン0.5mLを噴霧して気管支収縮を誘発したところ、サルブタモール0.3〜10.0mg/kg投与群において喘息指数注)の軽減及び窒息性気管支収縮に対する抑制効果が認められた7)。
注)喘息指数
ヒスタミン又はメタコリン噴霧後5分間、1分毎に発現する症状を採点(例;変化なし:0、チアノーゼ・軽度の呼吸不整:1 等)し、5回の和で示す。
18.3.2 無麻酔モルモットにアセチルコリン溶液を噴霧して誘発させた気管支収縮に対し、サルブタモールの1mg/kg経口投与群では30分〜4時間、5mg/kg経口投与群では4〜6時間にわたり抑制効果を示した6)。
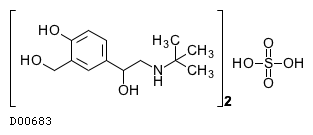
19. 有効成分に関する理化学的知見
19.1. サルブタモール硫酸塩
20. 取扱い上の注意
アルミピロー包装開封後は、遮光して保存すること。
22. 包装
100錠[10錠×10;PTP]
23. 主要文献
- Szabo KT.,et al., Teratology., 12, 336-337, (1975)
- 厚生省薬務局:医薬品副作用情報, (35), (1979)
- 日本医事新報, (2863), 109, (1979)
- Martin LE.,et al., Eur.J.Pharmacol., 14, 183-199, (1971) »PubMed
- Kennedy MCS.,et al., Br.J.Dis.Chest., 63, 165-174, (1969)
- Cullum VA.,et al., Br.J.Pharmacol., 35, 141-151, (1969) »PubMed
- 小林晋作 他, 医薬品研究, 2, 120-127, (1971)
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工株式会社
富山市総曲輪1丁目6番21