医薬品情報
| 総称名 | トピナ |
|---|---|
| 一般名 | トピラマート |
| 欧文一般名 | Topiramate |
| 製剤名 | トピラマート細粒 |
| 薬効分類名 | 抗てんかん剤 |
| 薬効分類番号 | 1139 |
| ATCコード | N03AX11 |
| KEGG DRUG |
D00537
トピラマート
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トピナ細粒10% | Topina Fine Granules | 協和キリン | 1139008C1020 | 110.2円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作(二次性全般化発作を含む)に対する抗てんかん薬との併用療法
6. 用法及び用量
成人
通常、成人にはトピラマートとして1回量50mgを1日1回又は1日2回の経口投与で開始する。以後、1週間以上の間隔をあけて漸増し、維持量として1日量200〜400mgを2回に分割経口投与する。
なお、症状により適宜増減するが、1日最高投与量は600mgまでとする。
なお、症状により適宜増減するが、1日最高投与量は600mgまでとする。
小児
通常、2歳以上の小児にはトピラマートとして1日量1mg/kgの経口投与で開始し、2週間以上の間隔をあけて1日量2mg/kgに増量する。以後、2週間以上の間隔をあけて1日量として2mg/kg以下ずつ漸増し、維持量として1日量6mg/kgを経口投与する。症状により適宜増減するが、1日最高投与量は9mg/kg又は600mgのいずれか少ない投与量までとする。なお、いずれも1日2回に分割して経口投与すること。
7. 用法及び用量に関連する注意
7.1 海外では、成人てんかん患者を対象とした試験において1日量50mgで開始し、1週間ごとに50mgずつ増量するなど、開始用量及び増量幅を低減することで、投与初期の有害事象発現率が低下したとの報告があることから、本剤の投与開始にあたっては、患者の状態に応じて、成人には1日1回50mgから開始すること又は増量幅を1日100mgではなく1日50mgに低減することについても考慮すること。[17.1.6、17.1.7参照]
7.2 本剤は他の抗てんかん薬と併用して使用すること。
8. 重要な基本的注意
8.1 代謝性アシドーシスがあらわれることがあるので、本剤投与中、特に長期投与時には、重炭酸イオン濃度測定等の検査を患者の状態に応じた適切な間隔で実施することが望ましい。[9.1.2、9.7.2、9.7.3、11.1.3参照]
8.2 発汗減少があらわれることがあり、特に夏季に体温が上昇することがあるので、本剤投与中は体温の上昇に留意し、このような場合には高温環境下をできるだけ避けること。なお、あらかじめ水分を補給することにより症状が緩和される可能性がある。[9.7.2、11.1.4参照]
8.3 体重減少を来すことがあるので、本剤投与中、特に長期投与時には、定期的に体重計測を実施するなど患者の状態を慎重に観察すること。[9.7.3参照]
8.6 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 閉塞隅角緑内障の患者
9.1.2 アシドーシスの素因を有する患者又はアシドーシスを来しやすい治療を受けている患者
9.1.3 自殺企図の既往及び自殺念慮を有するうつ病の患者
自殺企図や自殺念慮が悪化するおそれがある。[15.1参照]
9.1.4 結石を生じやすい患者
9.1.5 虚弱者
投与を中止する場合には、徐々に減量するなど特に注意すること。[8.4参照]
9.2 腎機能障害患者
9.2.2 血液透析施行中の腎機能障害患者
透析実施日は本剤の補充投与を考慮すること。本剤は血液透析により除去される。[16.6.2参照]
9.3 肝機能障害患者
本剤のクリアランスが低下することがある。[16.6.3参照]
9.4 生殖能を有する者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性(母体のてんかん発作頻発を防ぎ、胎児を低酸素状態から守る)が危険性を上回ると判断される場合にのみ投与すること。妊娠中に本剤を使用する場合、又は本剤を使用中に妊娠した場合は、本剤投与により出生した児に生じるリスクについて患者に十分説明すること。以下のことが報告されている。
9.5.1 妊娠中に本剤を投与された患者が奇形(口唇裂、口蓋裂、男児の尿道下裂)を有する児を出産したとの報告があり、動物実験(ラット、ウサギ)で胎児の欠指、口蓋裂、血管系の異常及び骨格異常等が報告されている。また、ヒトで胎盤を通過することが認められている。[9.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒトで乳汁中への移行が報告されている。
9.7 小児等
9.7.1 低出生体重児、新生児、乳児、2歳未満の幼児を対象とした国内臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
本剤の代謝に関与する主なチトクロームP450分子種はCYP3A4である。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| 肝代謝酵素(CYP3A4)誘導作用を有する薬剤 フェニトイン カルバマゼピン等 [16.7.1、16.7.2参照] | 併用中の左記薬剤を減量又は中止する場合には本剤の血中濃度が上昇することがある。 | 左記薬剤により肝代謝酵素(CYP3A4)が誘導され、併用により本剤の血中濃度は非併用時に比べ低下する。 |
| フェニトイン [16.7.1参照] | 左記薬剤の血中濃度が上昇することがある。 | 本剤が左記薬剤の代謝を阻害することがある。 |
| 中枢抑制薬 バルビツール酸誘導体等 | 相互に作用が増強されることがある。 | 本剤及び左記薬剤の中枢神経抑制作用による。 |
| 炭酸脱水酵素阻害剤 アセタゾラミド等 | 腎・尿路結石を形成するおそれがある。 | 本剤は弱い炭酸脱水酵素阻害作用を有する。 |
| リスペリドン [16.7.3参照] | 左記薬剤の血中濃度が低下することがある。 | 左記薬剤のクリアランスが上昇することがある。 |
| メトホルミン [16.7.4参照] | 左記薬剤の血中濃度が上昇し、血糖降下作用が増強するおそれがある。 | 左記薬剤のクリアランスが低下することがある。 |
| ピオグリタゾン [16.7.5参照] | 左記薬剤のAUCが低下し、血糖降下作用が減弱するおそれがある。 | 左記薬剤のクリアランスが上昇することがある。 |
| アミトリプチリン [16.7.6参照] | 左記薬剤の血中濃度が上昇することがあるので、必要に応じて用量を調節すること。 | 機序は不明である。 |
| リチウム [16.7.7参照] | 左記薬剤の血中濃度が上昇又は低下することがある。 | 機序は不明である。 |
| ジゴキシン [16.7.8参照] | ジゴキシンのAUCが低下することがある。 | 機序は不明である。 |
| ヒドロクロロチアジド [16.7.9参照] | 本剤の血中濃度が上昇することがあるので、必要に応じて本剤の用量を調節すること。 | 左記薬剤により本剤の腎排泄が低下し、血中濃度が上昇すると考えられる。 |
| 経口避妊薬 エチニルエストラジオール等 [16.7.10参照] | 左記薬剤の血中濃度が低下し、効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | 本剤により誘導された代謝酵素(CYP3A4)が左記薬剤の代謝を促進することがある。 |
| セイヨウオトギリソウ(St.John's Wort,セント・ジョーンズ・ワート)含有食品 | 本剤の血中濃度が低下するおそれがある。 | 左記含有食品により誘導された代謝酵素(CYP3A4)が本剤の代謝を促進することがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 続発性閉塞隅角緑内障及びそれに伴う急性近視(頻度不明)
11.1.2 腎・尿路結石(2.3%)
11.1.3 代謝性アシドーシス(1.8%)
11.1.4 乏汗症及びそれに伴う高熱(0.3%)
11.2 その他の副作用
| 10%以上 | 5〜10%未満 | 0.1〜5%未満 | 頻度不明 | |
| 精神神経系 | 傾眠(30.3%)、めまい、摂食異常 | しびれ感、頭痛、思考力低下 | 会話障害、不安、易刺激性、抑うつ、歩行異常、不眠、記憶力低下、妄想、幻覚、振戦、味覚異常、動作緩慢、眼振、けいれん・てんかん増悪、筋緊張、自殺企図、気分不良、平衡障害、感覚異常、躁状態、思考異常、協調運動異常、多動、昏迷、認知障害 | 錯乱、離人症、興奮 |
| 消化器 | 腹痛、悪心、便秘、下痢、嘔吐、腹部不快感、口内炎、胃腸炎、歯肉腫脹 | 鼓腸放屁、嚥下障害、唾液分泌過多、便失禁 | ||
| 代謝及び栄養 | 血中重炭酸塩減少、電解質(カリウム、カルシウム、リン、クロール、ナトリウム)異常 | トリグリセリド上昇、血中アンモニア値上昇、血中コレステロール増加、総蛋白減少 | 低血糖 | |
| 眼 | 複視、視覚異常、眼痛、視力低下、羞明、眼精疲労、涙液減少 | |||
| 肝臓 | 肝機能異常〔AST,ALT,γ-GTP,Al-P,LDHの上昇〕 | ウロビリノーゲン陽性、胆石症 | ||
| 血液 | 白血球分画異常、白血球減少、貧血、血小板減少、白血球増加 | プロトロンビン量増加、鼻出血 | ||
| 腎臓・泌尿器 | 尿沈渣陽性、血尿、尿蛋白陽性、頻尿、尿中リン増加、尿失禁 | |||
| 循環器 | 胸痛、心電図異常、起立性低血圧、動悸 | 徐脈、血圧上昇 | ||
| 呼吸器 | 呼吸困難、咳嗽、鼻炎 | |||
| 皮膚 | 発汗減少 | 発疹、脱毛、皮膚炎、多汗、多毛 | 脂漏 | |
| 感覚器 | 耳鳴、聴力低下 | |||
| 筋骨格 | 筋肉痛、関節痛、四肢重感、筋痙攣 | |||
| 内分泌 | 月経異常 | 乳房痛 | ||
| その他 | 体重減少(21.3%) | 倦怠感 | 発熱、CK上昇、脱力、浮腫、口渇、熱感、四肢冷感、体重増加 | 悪寒、性欲減退、体臭 |
13. 過量投与
13.1 症状
痙攣、傾眠、精神障害、昏迷、激越、めまい、抑うつ、会話障害、代謝性アシドーシス、協調運動異常、霧視、複視、低血圧、腹痛等があらわれることがある。
13.2 処置
必要に応じて血液透析を行う。なお、in vitroでは、活性炭が本剤を吸着することが示されている。
15. その他の注意
15.1 臨床使用に基づく情報
海外で実施された本剤を含む複数の抗てんかん薬における、てんかん、精神疾患等を対象とした199のプラセボ対照臨床試験の検討結果において、自殺念慮及び自殺企図の発現のリスクが、抗てんかん薬の服用群でプラセボ群と比較して約2倍高く(抗てんかん薬服用群:0.43%、プラセボ群:0.24%)、抗てんかん薬の服用群では、プラセボ群と比べ1,000人あたり1.9人多いと計算された(95%信頼区間:0.6-3.9)。また、てんかん患者のサブグループでは、プラセボ群と比べ1,000人あたり2.4人多いと計算されている。[9.1.3参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)成人
健康成人にトピラマート25〜400mgを絶食下単回経口投与したときの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。
健康成人に単回投与したときの血漿中濃度推移
| 用量(mg) | tmax(h) | Cmax(μg/mL) | AUC0-∞(μg・h/mL) | t1/2(h) |
| 25 | 2.4±1.6 | 0.25±0.03 | 1.7±2.2a) | −b) |
| 50 | 1.4±0.9 | 0.84±0.25 | 40.9±7.7 | 46.7±10.9 |
| 100 | 2.0±1.4 | 2.12±0.39 | 76.2±15.1 | 30.9±6.2 |
| 200 | 0.8±0.3 | 5.10±0.47 | 159.1±17.5 | 25.3±2.2 |
| 300 | 2.3±1.4 | 6.20±2.04 | 222.0±65.0 | 28.9±7.4 |
| 400 | 3.0±1.1 | 8.27±1.27 | 315.2±47.0 | 28.5±4.3 |
16.1.2 反復投与
(1)成人
健康成人6例にトピラマート1回50mgを1日2回13日間(計25回投与)反復経口投与したときの血漿中濃度は5日目以降ほぼ定常状態に達し、単回投与後の12時間値と最終回投与後の12時間値の比(蓄積率)は5.20であった。
(2)小児
2〜15歳の症候性又は潜因性局在関連性てんかん患児に、トピナ細粒を1日2回開始用量1mg/kg/日から1週ごとに2mg/kg/日ずつ、9mg/kg/日まで漸増投与した。1及び5mg/kg/日を投与したときの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。肝代謝酵素誘導作用を有する抗てんかん薬(カルバマゼピン、フェニトイン、プリミドン、フェノバルビタール)と併用(誘導例)した場合に比べ、非併用(非誘導例)では、Cmaxで約1.6倍、AUC0-12で約2.0倍(いずれも5mg/kg/日投与時)であった3)。
症候性又は潜因性局在関連性てんかん患児に反復投与したときの血漿中濃度推移
| 群 | 用量(mg/kg/日) | tmax(h) | Cmax(μg/mL) | AUC0-12a)(μg・h/mL) | t1/2(h) |
| 誘導(2〜15歳) (n=22) | 1 | 2.0±2.0 | 1.05±0.38 | 9.3±4.1 | 9.8±4.0b) |
| 誘導(2〜15歳) (n=16) | 5 | 1.8±0.9 | 5.31±1.69 | 44.3±18.0 | 9.1±3.7c) |
| 非誘導(12〜15歳) (n=5) | 1 | 2.4±1.5 | 1.95±0.27 | 19.9±3.3 | 17.3±4.4d) |
| 非誘導(12〜15歳) (n=3) | 5 | 2.6±1.1 | 8.51±2.14 | 86.6±26.9 | 23.4e) |
16.1.3 生物学的同等性
健康成人にトピナ細粒又はトピナ錠(それぞれトピラマートとして50mg)をそれぞれ絶食下にて水とともに単回経口投与した生物学的同等性試験では、Cmax及びAUC0-tのトピナ錠に対するトピナ細粒の比の90%信頼区間はそれぞれ86.1〜103.5%及び96.0〜100.9%であり、両製剤の同等性が確認された4)。
健康成人にトピナ細粒とトピナ錠を単回投与したときの血漿中濃度推移
16.2 吸収
16.2.1 バイオアベイラビリティ
外国人健康成人にトピラマート100mg錠及びトピラマート100mg水溶液を単回経口投与したとき、トピラマート水溶液との比較から算出したトピラマート100mg錠の相対的バイオアベイラビリティは、約80%であった5)。
16.2.2 食事の影響
健康成人にトピラマート100mg錠を空腹時及び食後に単回経口投与したとき、tmaxは空腹時投与で1.5時間、食後投与で3.6時間であり、食後投与のtmaxは空腹時投与と比べ有意に遅延した。Cmax、AUC0-∞及びt1/2に有意な差は認められなかった6)。
16.3 分布
16.3.1 体組織への分布
雄性ラットに14C-トピラマート40mg/kgを単回経口投与したとき、大部分の組織では投与後30分に最も高い放射能濃度を示した。投与後30分では胃>膀胱>肝臓>腎臓>副腎>血液の順に放射能濃度が高かった7)。
16.3.2 血液−脳関門通過性
雄性ラットに14C-トピラマート40mg/kgを単回経口投与したとき、投与後4時間までの脳内(大脳・小脳)放射能濃度は、血漿中放射能濃度の0.4〜0.5倍であった7)。
16.3.3 血液−胎盤関門通過性
妊娠ラットに14C-トピラマート40mg/kgを単回経口投与したとき、胎盤及び胎児への放射能の移行が認められ、胎盤及び胎児全身の放射能濃度は、母体血漿中放射能濃度とほぼ同程度であった7)。
16.3.4 母乳中への移行性
授乳期のラットに14C-トピラマート40mg/kgを単回経口投与したとき、乳汁中放射能濃度は、血漿中放射能濃度の0.07〜0.73倍であった7)。
16.3.5 血漿蛋白結合率
in vitroでのヒト血漿蛋白結合率は以下のとおりであった。
| 添加濃度(μg/mL) | 0.5 | 10 | 200 |
| 血漿蛋白結合率(%) | 41 | 24 | 15 |
限外ろ過法による
16.4 代謝
ヒトCYP発現系ミクロソームを用いた試験から、本剤の代謝には、主にCYP3A4が関与し、CYP1A1、CYP2C8、CYP2C9及びCYP2C19も一部関与していると考えられた(in vitro)。[10.参照]
16.5 排泄
外国人健康成人に14C-トピラマート100mgを単回経口投与後、10日目までに主に尿中に未変化体として(投与量の約60%)排泄される。血漿中、尿中及び糞中には6種の代謝物(水酸化体、加水分解体及びグルクロン酸抱合体)が認められたが、いずれも投与量の2.5%未満である。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 血液透析患者
外国人血液透析患者にトピラマート100mgを単回経口投与後、400mL/minの速度で血液透析を3時間実施したとき、3時間後の血漿中トピラマート濃度は約半分に低下した。トピラマートの透析時間中のCL/Fは約7.2L/h(120mL/min)であり、これは健康成人におけるCL/F1.2〜1.8L/h(20〜30mL/min)よりも大きく、血液透析によりトピラマートは血漿から急速に除去される。[9.2.2参照]
16.6.3 肝機能障害患者
中等度から重度(Child−Pughスコア5〜9)の外国人肝機能障害患者では、外国人健康成人と比較してAUC0-∞は29%増加し、CL/Fは26%低下した。[9.3参照]
16.6.4 高齢者
外国人健康高齢者(65〜81歳)にトピラマート100mgを単回経口投与したとき、外国人健康成人に比べCmax及びAUC0-∞はそれぞれ23%及び25%増加し、t1/2が約13%延長した。[9.8.1参照]
16.7 薬物相互作用
16.7.1 フェニトイン
フェニトイン単剤(130〜300mgを1日2回若しくは360〜480mgを1日1回)で治療を受けている外国人部分てんかん患者12例にトピラマート(100、200、400mgを1日2回)注)を反復投与したとき、トピラマートの血漿中濃度はトピラマート単独投与時(400mgを1日2回)注)に比べ48%低下した。一方、12例の患者のうち6例で、トピラマートの併用によりフェニトインのAUCが25%程度上昇した。[10.2参照]
16.7.2 カルバマゼピン
カルバマゼピン単剤(300〜800mgを1日3回)で治療を受けている外国人部分てんかん患者12例にトピラマート(100、200、400mgを1日2回)注)を反復投与したとき、トピラマートの血漿中濃度はトピラマート単独投与時(400mgを1日2回)注)に比べ40%低下した。一方、トピラマートはカルバマゼピンの体内動態に影響を及ぼさなかった。[10.2参照]
16.7.3 リスペリドン
外国人健康成人12例にリスペリドン(2mg)を単回投与したとき、リスペリドンのCmax及びAUC0-∞は、トピラマート(50〜100mgを1日2回)の併用により、それぞれ29%及び23%低下した。[10.2参照]
16.7.4 メトホルミン
外国人健康成人25例にメトホルミン(500mgを1日2回)を反復投与したとき、メトホルミンのCmax及びAUC0-12は、トピラマート(100mgを1日2回)の併用により、それぞれ18%及び25%増加した。[10.2参照]
16.7.5 ピオグリタゾン
外国人健康成人26例にピオグリタゾン(30mg/日)を反復投与したとき、ピオグリタゾンのAUC0-24は、トピラマート(16〜96mgを1日2回)の併用により15%低下した。一方、ピオグリタゾンはトピラマートの体内動態に影響を及ぼさなかった。[10.2参照]
16.7.6 アミトリプチリン
外国人健康成人18例にアミトリプチリン(25mg/日)を反復投与したとき、アミトリプチリンのCmax及びAUC0-24は、トピラマート(25〜100mgを1日2回)の併用により、それぞれ12%及び13%増加した。[10.2参照]
16.7.7 リチウム
外国人健康成人12例にリチウム(300mgを1日3回)を反復投与したとき、リチウムのAUC0-8は、トピラマート(50〜100mgを1日2回)の併用により12%低下した。一方、リチウムで治療を受けている外国人双極性障害患者32例のリチウムのAUC0-12は、低用量のトピラマート(200mg/日)の併用では影響を受けなかったが、高用量のトピラマート(600mg/日)の併用により26%増加した。[10.2参照]
16.7.8 ジゴキシン
外国人健康成人男性12例にジゴキシン(0.6mg)を単回投与したとき、ジゴキシンのCmax及びAUC0-∞は、トピラマート(100mgを1日2回)の併用により、それぞれ16%及び12%低下した。[10.2参照]
16.7.9 ヒドロクロロチアジド
外国人健康成人24例にヒドロクロロチアジド(25mg/日)を反復投与したとき、ヒドロクロロチアジドの体内動態は、トピラマート(64〜96mgを1日2回)の併用により影響を受けなかった。一方、トピラマート(64〜96mgを1日2回)を反復投与したとき、トピラマートのCmax及びAUC0-12は、ヒドロクロロチアジド(25mg/日)の併用により、それぞれ27%及び29%増加した。[10.2参照]
16.7.10 経口避妊薬
バルプロ酸単剤(375〜1250mgを1日2回)で治療を受けている外国人てんかん女性患者12例にノルエチステロン(1mg/日)及びエチニルエストラジオール(0.035mg/日)を反復投与したとき、ノルエチステロンの体内動態は、トピラマート(100、200、400mgを1日2回)注)の併用により影響を受けなかったが、エチニルエストラジオールのAUC0-24は、トピラマートの併用により18〜30%減少した。[10.2参照]
注)本剤の承認用量は1日600mgまでである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(成人)
既存の抗てんかん薬で十分な発作抑制効果が得られない部分てんかん患者127例(プラセボ群65例、トピラマート群62例)を対象とした二重盲検比較試験(他の抗てんかん薬との併用療法)において、トピラマート群(400mg/日)はプラセボ群と比較し、発作発現頻度の有意な減少が認められた8)。
| 発作発現頻度減少率a) | プラセボ群(65例b)) | トピラマート群(61例b)) | 優越性検定c) |
| 中央値 | 13.7% | 33.4% | 0.006 |
| 最小値〜最大値 | −102.2〜82.3% | −178.3〜96.6% |
副作用発現頻度は80.6%(50/62例)であった。主な副作用は、傾眠30.6%(19/62例)、浮動性めまい及び感覚減退 各17.7%(11/62例)、体重減少16.1%(10/62例)、無食欲および大食症候群14.5%(9/62例)、頭痛12.9%(8/62例)、倦怠感及び易刺激性 各11.3%(7/62例)であった。
17.1.2 国内第II相試験(成人)
既存の抗てんかん薬で十分な発作抑制効果が得られないてんかん患者を対象として、非盲検試験3試験(他の抗てんかん薬との併用療法)を実施した。各試験の部分てんかん患者における最終全般改善度の改善割合(「中等度改善」以上)は以下のとおりであった。
| 試験 | 用量(mg/日) | 投与例数 | 最終全般改善度改善割合c) |
| 前期第II相試験 | 100〜400 | 39 | 41.2%(14/34例) |
| 前期第II相試験その2 | 200〜600 | 18a) | 50.0%(6/12例) |
| 後期第II相試験9) | 100〜600 | 122b) | 41.1%(39/95例) |
各試験の副作用発現頻度は以下のとおりであった。
・前期第II相試験の副作用発現頻度は34.2%(13/38例)であった。主な副作用は、傾眠10.5%(4/38例)、倦怠感、体重減少、運動緩慢、感覚減退及び精神的機能障害 各5.3%(2/38例)であった。
・前期第II相試験その2の副作用発現頻度は38.9%(7/18例)であった。主な副作用は、体重減少11.1%(2/18例)であった。
・後期第II相試験の副作用発現頻度は57.4%(70/122例)であった。主な副作用は、傾眠18.9%(23/122例)、倦怠感及び体重減少 各7.4%(9/122例)、浮動性めまい6.6%(8/122例)及び無食欲および大食症候群5.7%(7/122例)であった。
17.1.3 国内第II/III相試験における発作型別レスポンダー率(成人)
第II相試験及び第III相試験成績を統合した結果、部分発作を有するてんかん患者210例における発作型別レスポンダー率(発作発現頻度が50%以上減少した症例の割合)は以下のとおりであった。
| 発作型a) | レスポンダー率 |
| 単純部分発作 | 33.8%(27/80例) |
| 複雑部分発作 | 32.0%(58/181例) |
| 二次性全般化強直間代発作 | 27.8%(10/36例) |
17.1.4 国内第II相長期投与試験(成人)
第II相試験終了後、継続投与が必要と認められたてんかん患者58例注)を対象として、長期投与試験(最高用量600mg/日、最長569週)を実施した。評価例数は1年目が51例、2年目が42例、3年目が27例、4年目が24例、5年目が19例であり、5年目の最終全般改善度が「中等度改善」以上であった症例の改善割合は84.2%(16/19例)であった。
副作用発現頻度は72.4%(42/58例)であった。主な副作用は、傾眠17.2%(10/58例)、体重減少13.8%(8/58例)及び浮動性めまい12.1%(7/58例)であった。
副作用発現頻度は72.4%(42/58例)であった。主な副作用は、傾眠17.2%(10/58例)、体重減少13.8%(8/58例)及び浮動性めまい12.1%(7/58例)であった。
注)全般てんかん3例含む
17.1.5 国内第III相長期投与試験(成人)
第III相試験(延長投与を含む)における本剤の長期投与(最高用量600mg/日、最長233週)の有効性評価症例(124例)では、「投与開始〜6ヵ月目」は124例、「6ヵ月目〜1年目」は102例、「1年目〜2年目」は36例であり、「1年目〜2年目」の発作発現頻度減少率の中央値は47.15%であった。
副作用発現頻度は97.6%(122/125例)であった。主な副作用は、体重減少46.4%(58/125例)、傾眠44.8%(56/125例)、浮動性めまい25.6%(32/125例)、感覚減退及び無食欲および大食症候群 各17.6%(22/125例)、頭痛15.2%(19/125例)、倦怠感14.4%(18/125例)、血中重炭酸塩減少12.8%(16/125例)、γ-グルタミルトランスフェラーゼ増加12.0%(15/125例)、複視及び腹痛 各11.2%(14/125例)、易刺激性10.4%(13/125例)であった。
副作用発現頻度は97.6%(122/125例)であった。主な副作用は、体重減少46.4%(58/125例)、傾眠44.8%(56/125例)、浮動性めまい25.6%(32/125例)、感覚減退及び無食欲および大食症候群 各17.6%(22/125例)、頭痛15.2%(19/125例)、倦怠感14.4%(18/125例)、血中重炭酸塩減少12.8%(16/125例)、γ-グルタミルトランスフェラーゼ増加12.0%(15/125例)、複視及び腹痛 各11.2%(14/125例)、易刺激性10.4%(13/125例)であった。
17.1.6 海外第III相試験(成人)
海外で部分てんかん患者188例を対象として、通常の漸増法(開始用量100mg/日、1週ごとに200、400mg/日と増量)と緩徐な漸増法(開始用量50mg/日、1週ごとに50mg/日ずつ増量)とで目標用量を400mg/日とした二重盲検比較試験(他の抗てんかん薬との併用療法)が実施された。その結果、最終来院時点における発作発現頻度減少率の中央値は、通常の漸増法33.3%(92例)及び緩徐な漸増法42.0%(93例)であった。
副作用発現頻度は通常の漸増法95.7%(89/93例)及び緩徐な漸増法88.4%(84/95例)であった。主な副作用は、通常の漸増法、緩徐な漸増法でそれぞれ、注意集中困難19.4%(18/93例)、13.7%(13/95例)、記憶障害17.2%(16/93例)、5.3%(5/95例)、傾眠16.1%(15/93例)、21.1%(20/95例)、浮動性めまい14.0%(13/93例)、17.9%(17/95例)、頭痛14.0%(13/93例)、9.5%(9/95例)、錯感覚12.9%(12/95例)、7.4%(7/95例)であった。
トピラマートの治療を変更(中止、中断又は減量)した有害事象発現頻度は、通常の漸増法37.6%(35/93例)及び緩徐な漸増法25.3%(24/95例)であり、変更までの投与期間を考慮したとき、緩徐な漸増法で有意に低かった(p=0.048)。[7.1参照]
副作用発現頻度は通常の漸増法95.7%(89/93例)及び緩徐な漸増法88.4%(84/95例)であった。主な副作用は、通常の漸増法、緩徐な漸増法でそれぞれ、注意集中困難19.4%(18/93例)、13.7%(13/95例)、記憶障害17.2%(16/93例)、5.3%(5/95例)、傾眠16.1%(15/93例)、21.1%(20/95例)、浮動性めまい14.0%(13/93例)、17.9%(17/95例)、頭痛14.0%(13/93例)、9.5%(9/95例)、錯感覚12.9%(12/95例)、7.4%(7/95例)であった。
トピラマートの治療を変更(中止、中断又は減量)した有害事象発現頻度は、通常の漸増法37.6%(35/93例)及び緩徐な漸増法25.3%(24/95例)であり、変更までの投与期間を考慮したとき、緩徐な漸増法で有意に低かった(p=0.048)。[7.1参照]
17.1.7 海外第III相試験(成人)
海外で既存の抗てんかん薬で十分な発作抑制効果が得られない部分てんかん患者263例を対象に、緩徐な漸増法(開始用量50mg/日、1週ごとに50mg/日ずつ増量)とより緩徐な漸増法(開始用量25mg/日、1週ごとに25mg/日ずつ増量)とで目標用量を200mg/日としたプラセボ対照二重盲検比較試験(他の抗てんかん薬との併用療法)が実施された。その結果、トピラマート群(168例)の発作発現頻度減少率の中央値はプラセボ群(91例)よりも有意に高く(p<0.001)、緩徐な漸増法(83例)とより緩徐な漸増法(85例)では有意差は認められなかった(p=0.065)。
副作用発現頻度は緩徐な漸増法64.0%(55/86例)、より緩徐な漸増法58.8%(50/85例)であった。主な副作用は、緩徐な漸増法、より緩徐な漸増法でそれぞれ、頭痛11.6%(10/86例)、11.8%(10/85例)、錯感覚10.5%(9/86例)、5.9%(5/85例)、傾眠14.0%(12/86例)、15.3%(13/85例)、無食欲および大食症候群10.5%(9/86例)、8.2%(7/85例)であった。[7.1参照]
副作用発現頻度は緩徐な漸増法64.0%(55/86例)、より緩徐な漸増法58.8%(50/85例)であった。主な副作用は、緩徐な漸増法、より緩徐な漸増法でそれぞれ、頭痛11.6%(10/86例)、11.8%(10/85例)、錯感覚10.5%(9/86例)、5.9%(5/85例)、傾眠14.0%(12/86例)、15.3%(13/85例)、無食欲および大食症候群10.5%(9/86例)、8.2%(7/85例)であった。[7.1参照]
17.1.8 国内第III相試験(小児)
既存の抗てんかん薬で十分な発作抑制効果が得られない2歳から15歳のてんかん患児59例を対象とした非盲検試験(他の抗てんかん薬との併用療法、トピラマート1〜6mg/kg/日)において、有効性評価期間(漸増期間8週間及び用量維持期間8週間)における観察期間からの4週あたりの部分発作発現頻度減少率の中央値[95%信頼区間]は34.0[16.3,50.3]%であり、部分発作発現頻度の減少が認められた10)。
副作用発現頻度は50.8%(30/59例)であった。主な副作用は、血中重炭酸塩減少20.3%(12/59例)、傾眠15.3%(9/59例)、乏汗症10.2%(6/59例)、食欲減退5.1%(3/59例)、尿中リン増加及び抗痙攣剤濃度増加 各3.4%(2/59例)であった。
副作用発現頻度は50.8%(30/59例)であった。主な副作用は、血中重炭酸塩減少20.3%(12/59例)、傾眠15.3%(9/59例)、乏汗症10.2%(6/59例)、食欲減退5.1%(3/59例)、尿中リン増加及び抗痙攣剤濃度増加 各3.4%(2/59例)であった。
17.1.9 国内第III相長期投与試験(小児)
第III相試験終了後、継続投与が必要と認められたてんかん患児48例を対象として、長期投与試験(最高用量9mg/kg/日又は600mg/日のいずれか低い投与量まで、最長36週)を実施した。各評価期間の部分発作発現頻度減少率の中央値は、12週後で46.2%、24週後で49.5%、36週後で55.6%であった11)。
副作用発現頻度は64.6%(31/48例)であった。主な副作用は、血中重炭酸塩減少29.2%(14/48例)、傾眠22.9%(11/48例)、乏汗症12.5%(6/48例)、発汗障害8.3%(4/48例)、尿中リン増加及び食欲減退 各4.2%(2/48例)であった。
副作用発現頻度は64.6%(31/48例)であった。主な副作用は、血中重炭酸塩減少29.2%(14/48例)、傾眠22.9%(11/48例)、乏汗症12.5%(6/48例)、発汗障害8.3%(4/48例)、尿中リン増加及び食欲減退 各4.2%(2/48例)であった。
17.3 その他
海外でてんかんを有する小児患者63例を対象として、本剤(28例、6〜15歳)とレベチラセタム(35例、4〜15歳)の単剤療法が成長(身長、体重)、発達、骨密度に及ぼす影響を評価する実薬対照非盲検試験が実施された。MMRM(mixed-model repeated measures)注)を用いた解析の結果、腰椎骨密度、頭を除く全身(TBLH)の骨密度、及び体重のZスコアのベースラインからの変化量に関して本剤群とレベチラセタム群との間で統計学的に有意差が認められた。[9.7.3参照]
| 評価項目 | Zスコアのベースラインからの変化量の群間差(本剤−レベチラセタム) 最小二乗平均[95%信頼区間] |
| 腰椎骨密度a) | -0.296[-0.4910,-0.1020] |
| TBLH骨密度a) | -0.394[-0.5807,-0.2081] |
| 体重 | -0.20[-0.312,-0.088] |
注)投与群、治験施設、年齢群、来院、投与群と来院の交互作用、ベースライン値、ベースライン値と来院の交互作用を共変量とし、分散共分散行列を無構造としたMMRM解析
18. 薬効薬理
18.1 作用機序
本剤により、持続性脱分極パルスによって起こる頻回発火の抑制、L型カルシウム電流の抑制、カイニン酸誘発内向き電流の抑制、GABAA受容体を介したGABAによるクロライドイオン流入の促進及びヒト炭酸脱水酵素(II型及びIV型)の阻害が認められた。これらの事実から、本剤の抗てんかん作用は電位依存性ナトリウムチャネル抑制作用、電位依存性L型カルシウムチャネル抑制作用、AMPA(α-Amino-3-hydroxy-5-methylisoxazole-4-propionic acid)/カイニン酸型グルタミン酸受容体機能抑制作用、GABA存在下におけるGABAA受容体機能増強作用及び炭酸脱水酵素阻害作用に基づくと推定されている12)13)14)15)16)。
18.2 薬理作用
19. 有効成分に関する理化学的知見
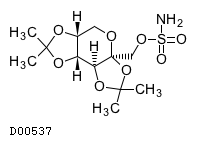
19.1. トピラマート
22. 包装
[バラ、乾燥剤入り]100g
23. 主要文献
- Bjork MH, et al., JAMA Neurol., 79, 672-681, (2022) »PubMed
- Dreier JW, et al., JAMA Neurol., 80, 568-577, (2023) »PubMed
- 大塚頌子ほか, てんかん研究, 32, 13-24, (2014) »DOI
- 社内資料:細粒剤と錠剤の生物学的同等性試験(2014年1月17日承認、CTD2.7.6.2)
- 社内資料:バイオアベイラビリティ(健康成人・外国人)(トピナ錠、2007年7月31日承認、CTD2.5.2.3)
- 社内資料:食事の影響試験(トピナ錠、2007年7月31日承認、CTD2.5.2.4)
- 大岩弘幸ほか, 薬理と治療, 36, 493-499, (2008)
- 松田一己ほか, 新薬と臨床, 56, 1385-1403, (2007)
- 大沼悌一ほか, 新薬と臨床, 56, 1659-1681, (2007)
- 大塚頌子, てんかん研究, 31, 19-29, (2013) »DOI
- 社内資料:部分発作を有する小児てんかん患者の長期投与試験(2014年1月17日承認、CTD2.7.6.7)
- DeLorenzo RJ,et al., Epilepsia., 41 (Suppl.1), S40-S44, (2000)
- Zhang X,et al., Epilepsia., 41 (Suppl.1), S52-S60, (2000)
- Gibbs JW 3rd,et al., Epilepsia., 41 (Suppl.1), S10-S16, (2000)
- White HS,et al., Epilepsy Res., 28, 167-179, (1997) »PubMed
- Dodgson SJ,et al., Epilepsia., 41 (Suppl.1), S35-S39, (2000)
- Shank RP,et al., Epilepsia., 35, 450-460, (1994) »PubMed
- Wauquier A,et al., Epilepsy Res., 24, 73-77, (1996) »PubMed
- Kanda T,et al., Life Sci., 59, 1607-1616, (1996) »PubMed
- Nakamura J,et al., Eur J Pharmacol., 254, 83-89, (1994) »PubMed
- Edmonds HL Jr,et al., Life Sci., 59, PL127-PL131, (1996)
- Koh S,et al., Ann Neurol., 50, 366-372, (2001) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
協和キリン株式会社
くすり相談窓口 受付時間 9:00〜17:30(土・日・祝日及び弊社休日を除く)
〒100-0004
東京都千代田区大手町1-9-2
電話:0120-850-150
製品情報問い合わせ先
協和キリン株式会社
くすり相談窓口 受付時間 9:00〜17:30(土・日・祝日及び弊社休日を除く)
〒100-0004
東京都千代田区大手町1-9-2
電話:0120-850-150
26. 製造販売業者等
26.1 製造販売元
協和キリン株式会社
東京都千代田区大手町1-9-2