医薬品情報
| 総称名 | リマプロストアルファデクス |
|---|---|
| 一般名 | リマプロスト アルファデクス |
| 欧文一般名 | Limaprost Alfadex |
| 製剤名 | リマプロスト アルファデクス錠 |
| 薬効分類名 | 経口プロスタグランジンE1誘導体製剤 |
| 薬効分類番号 | 2190 |
| ATCコード | B01AC28 |
| KEGG DRUG |
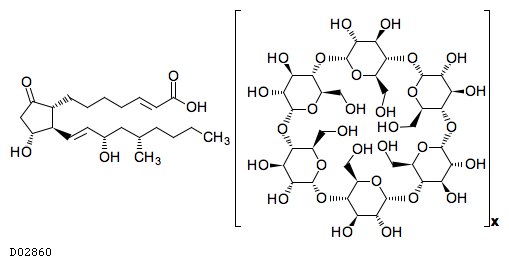
D02860
リマプロストアルファデクス
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リマプロストアルファデクス錠5μg「SN」 (後発品) | Limaprost Alfadex Tablets"SN" | シオノケミカル | 3399003F1120 | 18.3円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
○閉塞性血栓血管炎に伴う潰瘍、疼痛および冷感などの虚血性諸症状の改善
○後天性の腰部脊柱管狭窄症(SLR試験正常で、両側性の間欠跛行を呈する患者)に伴う自覚症状(下肢疼痛、下肢しびれ)および歩行能力の改善
5. 効能または効果に関連する注意
<後天性の腰部脊柱管狭窄症(SLR試験正常で、両側性の間欠跛行を呈する患者)に伴う自覚症状(下肢疼痛、下肢しびれ)および歩行能力の改善>
手術適応となるような重症例での有効性は確立していない。
6. 用法及び用量
<閉塞性血栓血管炎に伴う潰瘍、疼痛および冷感などの虚血性諸症状の改善>
通常成人に、リマプロストとして1日30μgを3回に分けて経口投与する。
<後天性の腰部脊柱管狭窄症(SLR試験正常で、両側性の間欠跛行を呈する患者)に伴う自覚症状(下肢疼痛、下肢しびれ)および歩行能力の改善>
通常成人に、リマプロストとして1日15μgを3回に分けて経口投与する。
8. 重要な基本的注意
<後天性の腰部脊柱管狭窄症(SLR試験正常で、両側性の間欠跛行を呈する患者)に伴う自覚症状(下肢疼痛、下肢しびれ)および歩行能力の改善>
症状の経過観察を行い、漫然と継続投与しないこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 出血傾向のある患者
出血を助長するおそれがある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(授乳ラット経口投与)で乳汁中への移行が報告されている2)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| 抗血小板剤 アスピリン チクロピジン シロスタゾール 血栓溶解剤 ウロキナーゼ 抗凝血剤 ヘパリン ワルファリン | これらの薬剤と併用することにより出血傾向の増強をきたすおそれがある。 観察を十分に行い、用量を調節するなど注意すること。 | 本剤は血小板凝集能を抑制するため、類似の作用を持つ薬剤を併用することにより作用を増強することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど、適切な処置を行うこと。
11.1.1 肝機能障害、黄疸
AST、ALTの著しい上昇等を伴う肝機能障害、黄疸(いずれも頻度不明)があらわれることがある。
11.2 その他の副作用
| 0.1〜1%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒感等 | 蕁麻疹 | 光線過敏症 |
| 出血傾向 | 出血 | ||
| 血液 | 貧血、血小板減少 | ||
| 消化器 | 下痢、悪心、腹部不快感、腹痛、食欲不振、胸やけ | 嘔吐、腹部膨満感、口渇、口内炎 | 舌しびれ |
| 肝臓 | AST・ALTの上昇等の肝機能異常 | ||
| 循環器 | 心悸亢進 | 頻脈、低血圧、四肢のチアノーゼ、血圧上昇 | |
| 精神神経系 | 頭痛、めまい | しびれ感、眠気、不眠 | |
| その他 | 潮紅、ほてり | 全身倦怠感、胸痛、胸部不快感、四肢痛、浮腫、乳腺腫脹、身ぶるい、下肢多毛、味覚異常 |
13. 過量投与
13.1 症状
健康成人に大量投与(30〜40μg/回)したとき一過性の血圧下降を認めたとの報告がある3)。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
リマプロストアルファデクス錠5μg「SN」とオパルモン錠5μgを、クロスオーバー法によりそれぞれ6錠(リマプロストとして30μg注1))健康成人男子に絶食単回経口投与して血漿中リマプロスト濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された4)。
注1)本剤の承認された用法及び用量は、閉塞性血栓血管炎に伴う潰瘍、疼痛および冷感などの虚血性諸症状の改善にはリマプロストとして1日30μgを3回に分けて、後天性の腰部脊柱管狭窄症(SLR試験正常で、両側性の間欠跛行を呈する患者)に伴う自覚症状(下肢疼痛、下肢しびれ)および歩行能力の改善にはリマプロストとして1日15μgを3回に分けて経口投与である。
| n | 判定パラメータ | 参考パラメータ | |||
| AUC0−3(pg・hr/mL) | Cmax(pg/mL) | Tmax(hr) | T1/2(hr) | ||
| リマプロストアルファデクス錠5μg「SN」(6錠) | 40 | 7.4±3.3 | 8.8±5.1 | 0.5±0.3 | 1.1±0.7 |
| オパルモン錠5μg(6錠) | 40 | 7.0±4.1 | 8.7±5.7 | 0.5±0.2 | 1.0±0.4 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
〔11β-3H〕リマプロスト アルファデクスをラットに経口投与したとき、90〜95%が吸収される2)。
16.3 分布
ヒト血漿(0.023mM濃度)に対する蛋白結合率は95.8%である(in vitro、限外ろ過法)5)。
16.4 代謝
16.5 排泄
〔11β-3H〕リマプロスト アルファデクスをラットに経口投与したとき、投与量の75〜80%が胆汁中に排泄されるが、腸肝循環して投与72時間後までに尿中に約30%、糞中に約70%排泄される2)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
リマプロストは強力な血管拡張作用、血流増加作用及び血小板凝集抑制作用を有し、臨床的には閉塞性血栓血管炎に伴う潰瘍、疼痛および冷感などの虚血性諸症状に対する効果および後天性の腰部脊柱管狭窄症(SLR試験正常で、両側性の間欠跛行を呈する患者)に伴う自覚症状(下肢疼痛、下肢しびれ)および歩行能力に対する効果が認められている。
18.2 薬理作用
18.2.1 末梢循環障害改善作用
大腿動脈にラウリン酸を投与して作成した末梢(後肢)循環障害モデルおよびアドレナリンとエルゴタミンを皮下投与して作成した末梢(尾)循環障害モデルにおいて、虚血性病変の進行を抑制する(ラット)9)。
18.2.2 血流増加・皮膚温上昇作用
(1)大腿動脈血流量および後肢皮膚血流量を増加し、後肢皮膚温を上昇させるが、この血流増加作用は腰部交感神経切除によって影響されない(イヌ)10)。
(2)閉塞性血栓血管炎患者に経口投与すると、末梢側(足背、足底)の皮膚温が上昇する11)。
18.2.3 血小板に対する作用
(1)血小板粘着抑制作用
・血栓性疾患患者に経口投与すると、血小板粘着能が低下する12)。
・血小板の粘着を抑制し、その50%抑制濃度はリマプロストとして0.186ng/mLである(モルモット、in vitro)。経口投与においても、血小板粘着を抑制する(モルモット、ex vivo)13)。
(2)血小板凝集抑制作用
18.2.4 抗血栓作用
電気刺激により腸間膜動脈に血栓を形成する実験において、用量依存的に血栓形成の閾値電圧を上昇させる(モルモット)15)。
18.2.5 神経組織血流量増加作用
(1)第6腰椎の硬膜上にバルーンを挿入して馬尾神経を圧迫したモデルにおいて、馬尾神経組織血流量を改善する(イヌ)16)。
(2)第4および第6腰椎脊柱管内にシリコンラバーを挿入して馬尾神経を圧迫したモデルにおいて、馬尾神経組織血流量を改善する(ラット)17)。
(3)右後肢の坐骨神経を2ヵ所結紮した坐骨神経結紮モデルにおいて、結紮中間部の坐骨神経組織血流量を改善する(ラット)18)。
18.2.6 神経機能改善作用
(1)第7腰椎の硬膜上にバルーンを挿入して馬尾神経を圧迫したモデルにおいて、神経伝導速度の低下を抑制する(イヌ)19)。
(2)右後肢の坐骨神経を4ヵ所結紮した坐骨神経結紮モデルにおいて、結紮側大腿部筋肉の熱刺激誘発筋放電持続時間の延長を抑制する(ラット)20)。
18.2.7 痛覚過敏改善作用
右後肢の坐骨神経を2ヵ所結紮した坐骨神経結紮モデルにおいて、結紮側の痛覚過敏を改善する(ラット)18)。
18.2.8 歩行障害改善作用
第4および第6腰椎脊柱管内にシリコンラバーを挿入して馬尾神経を圧迫したモデルにおいて、歩行距離の低下を改善する(ラット)17)。
19. 有効成分に関する理化学的知見
19.1. リマプロスト アルファデクス
20. 取扱い上の注意
吸湿性を有するため、アルミピロー開封後は湿気を避けてPTP包装のまま保存すること。
22. 包装
210錠[21錠(PTP)×10、乾燥剤入り]
1050錠[21錠(PTP)×50、乾燥剤入り]
23. 主要文献
- 穐本 晃ほか, 現代医療, 20, 817-820, (1988)
- 宮本茂敏ほか, 現代医療, 18 (増II), 56-69, (1986)
- 山本智英ほか, 薬理と治療, 9, 1463-1476, (1981)
- 社内資料:生物学的同等性試験
- 宮本茂敏ほか, 現代医療, 18 (増II), 80-103, (1986)
- チトクロームP450に対する本薬の阻害作用(オパルモン錠、プロレナール錠:2005年2月2日承認、申請資料概要へ.1.(1))
- 草場 昭ほか, 医学のあゆみ, 138, 217-226, (1986)
- 栗原 章ほか, 臨床医薬, 12, 511-529, (1996)
- 北川敏一ほか, 現代医療, 18 (増II), 1-11, (1986)
- 北川敏一ほか, 現代医療, 18 (増II), 12-20, (1986)
- 木谷泰治ほか, 現代医療, 20, 810-816, (1988)
- 前田義春ほか, 血液と脈管, 13, 142-145, (1982) »DOI
- 坪井俊紀ほか, Arch.Intern.Pharmacodyn.Ther., 247, 89-102, (1980) »PubMed
- 坪井俊紀ほか, Thrombosis Res., 20, 573-580, (1980) »PubMed
- 藤谷武一ほか, Jpn.J.Pharmacol., 40, 31-35, (1986) »PubMed
- 伊藤邦臣ほか, 基礎と臨床, 29, 2577-2585, (1995)
- 竹信敬史ほか, 基礎と臨床, 30, 221-227, (1996)
- 椹木博之ほか, 基礎と臨床, 30, 237-244, (1996)
- 鹿山 悟ほか, 基礎と臨床, 30, 229-236, (1996)
- 藤谷武一ほか, 基礎と臨床, 30, 245-250, (1996)
24. 文献請求先及び問い合わせ先
文献請求先
シオノケミカル株式会社
学術情報本部
〒104-0028
東京都中央区八重洲2丁目10番10号
電話:03-5202-0213
FAX:03-5202-0230
製品情報問い合わせ先
シオノケミカル株式会社
学術情報本部
〒104-0028
東京都中央区八重洲2丁目10番10号
電話:03-5202-0213
FAX:03-5202-0230
26. 製造販売業者等
26.1 製造販売元
シオノケミカル株式会社
東京都中央区八重洲2丁目10番10号