医薬品情報
| 総称名 | アンブロキソール塩酸塩 |
|---|---|
| 一般名 | アンブロキソール塩酸塩 |
| 欧文一般名 | Ambroxol Hydrochloride |
| 製剤名 | アンブロキソール塩酸塩徐放性口腔内崩壊錠 |
| 薬効分類名 | 徐放性気道潤滑去痰剤 |
| 薬効分類番号 | 2239 |
| ATCコード | R05CB06 |
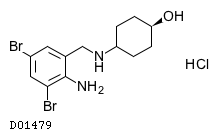
| KEGG DRUG |
D01479
アンブロキソール塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第1版 K6)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アンブロキソール塩酸塩徐放OD錠45mg「ZE」 (後発品) | AMBROXOL HYDROCHLORIDE | 全星薬品工業 | 2239001G1020 | 16.1円/錠 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人には1回1錠(アンブロキソール塩酸塩として45mg)を1日1回経口投与する。
7. 用法及び用量に関連する注意
早朝覚醒時に喀痰喀出困難を訴える患者には、夕食後投与が有用である。[17.1.1参照]
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で母乳中へ移行することが報告されている。
9.8 高齢者
減量が必要な場合には、他の剤形(徐放性製剤を除く)を使用すること。一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
発疹、顔面浮腫、呼吸困難、血圧低下等があらわれることがある。
11.1.2 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
注)発現頻度は錠、液、シロップ及び徐放カプセルの承認時までの臨床試験及び使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 消化器 | 胃不快感 | 胃痛、腹部膨満感、腹痛、下痢、嘔気、嘔吐、便秘、食思不振、消化不良(胃部膨満感、胸やけ等) | |
| 過敏症 | 発疹、蕁麻疹、蕁麻疹様紅斑、そう痒 | 血管浮腫(顔面浮腫、眼瞼浮腫、口唇浮腫等) | |
| 肝臓 | 肝機能障害(AST上昇、ALT上昇等) | ||
| その他 | 口内しびれ感、上肢のしびれ感 | めまい |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
健康成人男性にアンブロキソール塩酸塩として45mgを含有するアンブロキソール塩酸塩徐放錠45mg 1錠とアンブロキソール塩酸塩徐放カプセル45mg 1カプセルを、無作為割付け、2剤2期クロスオーバー法により絶食(n=18)又は食後(n=20)単回経口投与した。血漿中アンブロキソール未変化体濃度を測定し、薬物動態パラメータ(AUCt及びCmax)について統計解析を行った結果、対数値の平均値の差の90%信頼区間は、いずれの摂食条件でもすべて生物学的同等性の判定基準log(0.80)〜log(1.25)の範囲内であることから両剤の生物学的同等性が確認された1)。
| AUCt#(ng・h/mL) | Cmax#(ng/mL) | Tmax※(h) | t1/2#(h) | ||
| 絶食 | 徐放錠(n=18) | 579.462±166.839 | 28.985±7.027 | 6.0 | 12.149±3.368 |
| 徐放カプセル(n=18) | 645.866±234.574 | 27.641±6.854 | 4.0 | 11.531±3.051 | |
| 食後 | 徐放錠(n=20) | 689.543±237.718 | 35.256±10.069 | 6.0 | 12.178±2.835 |
| 徐放カプセル(n=20) | 697.838±219.157 | 30.955±9.140 | 6.0 | 13.384±5.355 | |
16.1.2 生物学的同等性試験
アンブロキソール塩酸塩徐放OD錠45mg「ZE」1錠とムコソルバンLカプセル45mg 1カプセル(アンブロキソール塩酸塩として45mg)を、クロスオーバー法により健康成人男子に前者は絶食後水あり及び水なし、さらに食後水なし、後者はいずれも水あり単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、いずれもlog(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された2)。
(1)絶食・水あり投与(アンブロキソール塩酸塩徐放OD錠45mg「ZE」、ムコソルバンLカプセル45mgともに水で服用)
| 判定パラメータ | 参考パラメータ | |||
| AUC(0→48)(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | t1/2(h) | |
| アンブロキソール塩酸塩徐放OD錠45mg「ZE」 | 984.2±306.0 | 65.5±23.1 | 4.2±0.9 | 10.2±2.1 |
| ムコソルバンLカプセル45mg | 1088.7±325.9 | 62.3±21.4 | 4.3±1.0 | 12.6±4.7 |
血漿中アンブロキソール濃度推移
(2)絶食・水なし投与(アンブロキソール塩酸塩徐放OD錠45mg「ZE」は水なしで服用、ムコソルバンLカプセル45mgは水で服用)
| 判定パラメータ | 参考パラメータ | |||
| AUC(0→48)(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | t1/2(h) | |
| アンブロキソール塩酸塩徐放OD錠45mg「ZE」 | 949.7±192.2 | 53.4±13.4 | 5.2±2.1 | 11.2±3.3 |
| ムコソルバンLカプセル45mg | 956.3±225.9 | 50.5±14.5 | 5.4±2.1 | 11.5±3.9 |
血漿中アンブロキソール濃度推移
(3)食後・水なし投与(アンブロキソール塩酸塩徐放OD錠45mg「ZE」は水なしで服用、ムコソルバンLカプセル45mgは水で服用)
| 判定パラメータ | 参考パラメータ | |||
| AUC(0→48)(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | t1/2(h) | |
| アンブロキソール塩酸塩徐放OD錠45mg「ZE」 | 971.2±329.4 | 60.7±19.3 | 6.7±1.7 | 9.5±1.7 |
| ムコソルバンLカプセル45mg | 1038.2±229.0 | 58.4±15.9 | 7.1±1.6 | 11.8±6.3 |
血漿中アンブロキソール濃度推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験(早朝覚醒時に喀痰喀出困難を訴える患者)
早朝覚醒時に喀痰喀出困難を訴える患者を対象に行った二重盲検試験で、アンブロキソール塩酸塩徐放カプセル45mgの夕食後1回投与の有効性が認められた3)。[7.参照]
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. アンブロキソール塩酸塩
20. 取扱い上の注意
PTP包装はアルミピロー開封後、バラ包装はボトル開封後、湿気を避けて保存すること。
22. 包装
100錠[10錠(PTP)×10、乾燥剤入り]
300錠[瓶、バラ、乾燥剤入り]
500錠[10錠(PTP)×50、乾燥剤入り]
23. 主要文献
- 慶松元興ほか, 新薬と臨牀, 63 (12), 1964-1980, (2014)
- 社内資料:生物学的同等性試験
- 長岡 滋ほか, Therapeutic Research., 14 (2), 617-646, (1993)
- 長岡 滋ほか, 薬理と治療, 9 (5), 1845-1854, (1981)
- 千田勝一ほか, 薬理と治療, 9 (2), 483-486, (1981)
- 前多治雄ほか, 薬理と治療, 9 (2), 487-490, (1981)
- Curti PC, Pneumonologie., 147 (1), 62-74, (1972) »PubMed
- Curti PC, et al., Arzneim-Forsch., 28 (5a), 922-925, (1978) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
株式会社三和化学研究所
コンタクトセンター
〒461-8631
名古屋市東区東外堀町35番地
電話:0120-19-8130
FAX:052-950-1305
製品情報問い合わせ先
株式会社三和化学研究所
コンタクトセンター
〒461-8631
名古屋市東区東外堀町35番地
電話:0120-19-8130
FAX:052-950-1305
26. 製造販売業者等
26.1 製造販売元
全星薬品工業株式会社
大阪市阿倍野区旭町1-2-7
26.2 販売元
株式会社三和化学研究所
〒461-8631
名古屋市東区東外堀町35番地