医薬品情報
| 総称名 | シメチジン |
|---|---|
| 一般名 | シメチジン |
| 欧文一般名 | Cimetidine |
| 製剤名 | シメチジン注射液 |
| 薬効分類名 | H2受容体拮抗剤 |
| 薬効分類番号 | 2325 |
| ATCコード | A02BA01 |
| KEGG DRUG |
D00295
シメチジン
|
| KEGG DGROUP |
DG01481
ヒスタミンH2受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| シメチジン注200mg「NP」 | Cimetidine Injection | ニプロ | 2325400A1239 | 79円/管 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
シメチジンに対し過敏症の既往歴のある患者
4. 効能または効果
○上部消化管出血(消化性潰瘍、急性ストレス潰瘍、出血性胃炎による)
○侵襲ストレス(手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・重症熱傷等)による上部消化管出血の抑制
○麻酔前投薬
5. 効能または効果に関連する注意
<侵襲ストレス(手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・重症熱傷等)による上部消化管出血の抑制>
手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・重症熱傷等によりストレス潰瘍が発症する可能性が考えられる場合に限り使用すること。なお、重症熱傷はBurn Index 10以上の熱傷を目安とすること。
6. 用法及び用量
<上部消化管出血(消化性潰瘍、急性ストレス潰瘍、出血性胃炎による)、侵襲ストレス(手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・重症熱傷等)による上部消化管出血の抑制>
通常成人にはシメチジンとして1回200mgを日局生理食塩液又は日局ブドウ糖注射液にて20mLに希釈し、1日4回(6時間間隔)緩徐に静脈内注射する。又は輸液に混合して点滴静注する。なお、年齢、症状により適宜増減する。一般的に上部消化管出血では1週間以内に効果の発現をみるが、内服可能となった後は経口投与に切りかえる。侵襲ストレス(手術後に集中管理を必要とする大手術、集中治療を必要とする脳血管障害・頭部外傷・多臓器不全・重症熱傷等)による上部消化管出血の抑制では、術後集中管理又は集中治療を必要とする期間(手術侵襲ストレスは3日間程度、その他の侵襲ストレスは7日間程度)の投与とする。
<麻酔前投薬>
通常成人にはシメチジンとして1回200mgを麻酔導入1時間前に筋肉内注射する。
7. 用法及び用量に関連する注意
7.1 腎機能障害患者では、血中濃度が持続するので、次の表を参考にして投与量を減ずるか投与間隔をあけて使用すること。[9.2、16.6.1参照]
| クレアチニンクリアランス | シメチジン投与量 |
| 0〜4mL/min | 1回200mg 1日1回(24時間間隔) |
| 5〜29mL/min | 1回200mg 1日2回(12時間間隔) |
| 30〜49mL/min | 1回200mg 1日3回(8時間間隔) |
| 50mL/min以上 | 1回200mg 1日4回(6時間間隔) |
7.3 手術侵襲ストレスによる上部消化管出血の抑制に対しては、手術終了後より投与を開始すること。
7.4 心血管疾患のある患者、全身状態の悪い患者、術後の患者には、点滴静注すること。
8. 重要な基本的注意
治療にあたっては経過を十分に観察し、病状に応じ治療上必要最小限の使用(手術侵襲ストレスは3日間程度、その他は7日間程度)にとどめ、本剤で効果がみられない場合には他の療法に切り替えること。なお、血液像、肝機能、腎機能等に注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中に移行することが報告されている。[16.3.1参照]
9.7 小児等
9.7.1 小児等を対象とした臨床試験は実施していない。
9.7.2 低出生体重児、新生児に使用する場合には十分注意すること。外国において、ベンジルアルコールの静脈内大量投与(99〜234mg/kg)により、中毒症状(あえぎ呼吸、アシドーシス、痙攣等)が低出生体重児に発現したとの報告がある。本剤は添加剤としてベンジルアルコールを含有している。
9.8 高齢者
減量するか投与間隔を延長するなど慎重に投与すること。高齢者では腎機能が低下していることが多いため、血中濃度が持続するおそれがある。[9.2参照]
10. 相互作用
相互作用序文
本剤は、肝薬物代謝酵素P-450を阻害する。特にCYP3A4とCYP2D6に対して強い阻害効果を有することが報告されている1)(外国人データ)。
薬物代謝酵素用語
CYP
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2D6
10.2 併用注意
| 肝薬物代謝酵素P-450の活性低下により代謝、排泄が遅延する薬剤 主な薬剤: クマリン系抗凝血剤 ワルファリン ベンゾジアゼピン系薬剤 ジアゼパム トリアゾラム ミダゾラム 等 抗てんかん剤 フェニトイン カルバマゼピン 等 抗うつ剤 三環系抗うつ剤 イミプラミン 等 パロキセチン β-遮断剤 プロプラノロール メトプロロール ラベタロール 等 カルシウム拮抗剤 ニフェジピン 等 抗不整脈剤 リドカイン 等 キサンチン系薬剤 テオフィリン アミノフィリン 等 | これらの医薬品の血中濃度を高めることが報告されているので、これらの医薬品を減量するなど慎重に投与すること。 | 本剤が肝薬物代謝酵素P-450(CYP1A2、CYP2C9、CYP2D6、CYP3A4等)を阻害して、これらの医薬品の代謝、排泄を遅延させる。 |
| プロカインアミド | これらの医薬品の血中濃度を高めることが報告されているので、これらの医薬品を減量するなど慎重に投与すること。 | 本剤が近位尿細管におけるプロカインアミドの輸送を阻害し、腎クリアランスを減少させる。 |
| エリスロマイシン | これらの医薬品の血中濃度を高めることが報告されているので、これらの医薬品を減量するなど慎重に投与すること。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(各0.1%未満)
ショック、アナフィラキシー(全身発赤、呼吸困難等)があらわれることがある。
11.1.2 再生不良性貧血、汎血球減少、無顆粒球症、血小板減少(各0.1%未満)
初期症状として全身倦怠、脱力、皮下・粘膜下出血、発熱等がみられたら、その時点で血液検査を実施し、異常が認められた場合には直ちに投与を中止すること。
11.1.3 間質性腎炎、急性腎障害(各0.1%未満)
初期症状として発熱、腎機能検査値異常(BUN、クレアチニン上昇等)等が認められた場合には直ちに投与を中止すること。
11.1.4 皮膚粘膜眼症候群(Stevens-Johnson症候群)、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(各0.1%未満)
11.1.5 肝障害(頻度不明)
黄疸、また、AST、ALTの上昇等があらわれることがあるので、定期的に肝機能検査を行うこと。
11.1.6 房室ブロック等の心ブロック(0.1%未満)
11.1.7 意識障害、痙攣(各頻度不明)
特に腎機能障害患者においてあらわれやすいので、注意すること。[9.2参照]
発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 腎臓 | BUN上昇、一過性のクレアチニン上昇 | |
| 過敏症 | 発疹 | 末梢神経障害※) |
| 内分泌 | 女性化乳房 | 乳汁分泌、帯下増加、勃起障害 |
| 精神神経系 | 可逆性の錯乱状態、痙攣、頭痛、めまい、四肢のしびれ・こわばり感、眠気、ヒポコンドリー様症状、無気力感、うつ状態、幻覚 | |
| 循環器 | 頻脈、徐脈、動悸 | |
| 消化器 | 便秘 | 腹部膨満感、下痢 |
| その他 | 発熱、全身熱感、排尿困難、筋肉痛、膵炎、脱毛 |
13. 過量投与
13.1 症状
外国において、シメチジン20gから40gを投与後に意識喪失等の重篤な中枢神経症状が発現した症例、及び40g以上のシメチジンを単回経口服用した成人での死亡症例の報告がある。日本では1回10g(錠剤)、外国では20g(錠剤)までの過量投与の報告があるが、特に重大な影響はみられなかった。
13.2 処置
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 静脈内注射時
急速な静脈内注射により、まれに不整脈、血圧低下を起こすことが報告されているので、静脈内注射する場合は、できるだけ時間をかけて緩徐に行うこと(本剤を5分かけて静脈内投与した後の血圧低下の程度は、2分かけて投与した後と比較し小さかった)。
14.1.2 筋肉内注射時
(1)筋肉内投与はやむを得ない場合にのみ、必要最小限に行うこと。同一部位への反復注射は行わないこと。特に新生児、低出生体重児、乳児、小児には注意すること。
(2)神経走行部位を避けること。
(3)注射針を刺入したとき、激痛の訴えや血液の逆流があった場合は直ちに針を抜き、部位をかえて注射すること。
(4)注射部位に疼痛、硬結をみることがある。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与が胃がんによる症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
15.2 非臨床試験に基づく情報
15.2.1 動物の毒性試験で弱い抗アンドロジェン作用に基づく前立腺及び精のう重量の減少が報告されている。
15.2.2 ラットに24ヵ月投与した毒性試験で良性の精巣の間細胞腫の発生が増加したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.3 分布
16.5 排泄
16.6 特定の背景を有する患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
<上部消化管出血>
17.1.1 国内一般臨床試験
<侵襲ストレスによる上部消化管出血の抑制>
17.1.2 国内一般臨床試験及び国内二重盲検試験
<麻酔前投薬>
17.1.3 国内二重盲検比較試験
麻酔時の誤嚥性肺炎の防止を目的としたプラセボとの二重盲検比較試験において、全身麻酔手術施行患者を対象に1回200mgを麻酔導入1時間前に筋肉内投与したとき、麻酔導入時及び抜管時のいずれの時点においてもシメチジン群(116例)はプラセボ群(112例)に比し、有意な胃液量の減少と胃液pHの上昇を認めた。シメチジン群(118例)に副作用は認められなかった15)。
注)本剤の承認された用法は静脈内注射又は筋肉内注射である。
18. 薬効薬理
18.1 作用機序
胃粘膜壁細胞のヒスタミンH2受容体を遮断し、持続的に胃酸分泌を抑制する16)。
18.2 胃酸分泌抑制作用
18.2.1 基礎分泌
十二指腸潰瘍患者に200mg経口投与した場合、投与後1〜3時間の2時間分泌量は91.2%抑制された17)。
18.2.2 テトラガストリン、ベタゾール及びインスリン刺激分泌
18.2.3 食餌刺激分泌
18.2.4 夜間分泌
十二指腸潰瘍患者において午後11時〜午前6時までの夜間分泌量は200mg経口投与で71.7%、300mg経口投与で94.0%抑制され、酸分泌抑制作用の持続時間は200mgで約4時間、300mgで約6時間であった22)。
18.2.5 24時間分泌
18.3 ペプシン分泌抑制作用
18.4 長期投与に伴う酸分泌機能の変動
18.5 血中ガストリンに及ぼす影響
18.6 ガストリン細胞数の変化
十二指腸潰瘍患者において、1,000mg/日を4週間、更に400mg/日を20週間経口投与で、投与前、投与開始後4週間、12週間及び24週間の幽門部ガストリン細胞数には有意な変化は認められなかった31)。
18.7 胃内容排出に対する影響
十二指腸潰瘍患者の300mg経口投与後1時間及び3時間の胃内容排出には、いずれも有意な変化は認められなかった32)。
18.8 膵外分泌機能に対する影響
胃潰瘍、十二指腸潰瘍、胃・十二指腸共存潰瘍患者に対する800mg/日19〜42日間の経口投与で投与前後の膵外分泌機能には有意な差は認められなかった33)。
18.9 胃粘膜電位差に対する作用
健康成人において、アスピリンによる胃粘膜電位差の低下を抑制することにより、胃粘膜関門の破綻を防ぎ粘膜障害を阻止した34)。
18.10 胃粘膜PGE2生合成能に対する影響
十二指腸潰瘍患者において、1,000mg/日、4週間の経口投与で、胃粘膜のPGE2生合成量は投与前に比し増加した35)。
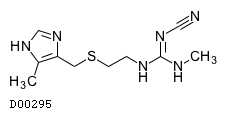
19. 有効成分に関する理化学的知見
19.1. シメチジン
22. 包装
2mL×50管[アンプル]
23. 主要文献
- Knodell R.G.,et al., Gastroenterology., 101 (6), 1680-1691, (1991) »PubMed
- 野口英世ほか, 基礎と臨床, 14 (10), 2841-2849, (1980)
- 三崎文夫ほか, 臨牀と研究, 64 (1), 325-330, (1987)
- Somogyi A.,et al., Br.J.Clin.Pharmacol., 7 (6), 627-629, (1979) »PubMed
- Larsson R.,et al., Eur.J.Clin.Pharmacol., 15 (3), 153-157, (1979) »PubMed
- Ma K.W.,et al., Gastroenterology., 74 (2), 473-477, (1978)
- Kogan F.J.,et al., J.Clin.Pharmacol., 23, 252-256, (1983) »PubMed
- 鎌田武信ほか, 綜合臨牀, 29 (6), 1901-1907, (1980)
- 大舘敬一ほか, 基礎と臨床, 16 (11), 5874-5881, (1982)
- 青木照明ほか, 薬理と治療, 19 (11), 4525-4535, (1991)
- 高倉公朋ほか, 新薬と臨床, 40 (10), 2237-2246, (1991)
- 青木照明ほか, 薬理と治療, 19 (11), 4549-4561, (1991)
- 桜本信一ほか, 薬理と治療, 19 (11), 4537-4548, (1991)
- 杉山 貢ほか, 消化器科, 15 (3), 289-299, (1991)
- 野口純一ほか, 臨床医薬, 2 (7), 963-974, (1986)
- 第十八改正日本薬局方解説書, C-2372-C-2377, (2021)
- 三好秋馬ほか, 医学のあゆみ, 107 (9), 588-592, (1978)
- 三好秋馬ほか, 内科宝函, 26 (6), 205-215, (1979)
- 男全正三ほか, 基礎と臨床, 16 (11), 5798-5802, (1982)
- 須山哲次ほか, 胃分泌研究会誌, 12, 49-52, (1980)
- 矢花 剛ほか, 臨牀と研究, 61 (11), 3715-3720, (1984)
- 三好秋馬ほか, 内科宝函, 26 (6), 217-224, (1979)
- Pounder R.E.,et al., The Lancet., 306 (7944), 1069-1072, (1975)
- Shiratori K.,et al., Gastroenterology., 84 (5, Part2), 1308, (1983)
- 岡 裕爾ほか, 診療と新薬, 17 (6), 1367-1371, (1980)
- 湯川永洋ほか, 診療と新薬, 17 (6), 1411-1419, (1980)
- 榊 信広ほか, 臨牀と研究, 57 (11), 3621-3632, (1980)
- 相良勝郎ほか, 診療と新薬, 17 (6), 1449-1456, (1980)
- Henn R.M.,et al., N.Eng.J.Med., 293 (8), 371-375, (1975) »PubMed
- Pounder R.E.,et al., Gut., 17 (3), 161-168, (1976) »PubMed
- Arnold R.,et al., Cimetidine:Excerpta Medica., 87-99, (1977)
- Richardson C.T.,et al., Gastroenterology., 71 (1), 19-23, (1976) »PubMed
- 亀井 力ほか, 診療と新薬, 17 (6), 1305-1316, (1980)
- Mackercher P.A.,et al., Gastroenterology., 70 (5, Part2), 912, (1976)
- Branski D.,et al., Scand.J.Gastroenterol., 19 (4), 457-460, (1984) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ニプロ株式会社
医薬品情報室
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:0120-226-898
FAX:050-3535-8939
製品情報問い合わせ先
ニプロ株式会社
医薬品情報室
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:0120-226-898
FAX:050-3535-8939
26. 製造販売業者等
26.1 製造販売元
ニプロ株式会社
大阪府摂津市千里丘新町3番26号