医薬品情報
| 総称名 | グラナテック |
|---|---|
| 一般名 | リパスジル塩酸塩水和物 |
| 欧文一般名 | Ripasudil Hydrochloride Hydrate |
| 製剤名 | リパスジル塩酸塩水和物点眼液 |
| 薬効分類名 | Rhoキナーゼ阻害薬 緑内障・高眼圧症治療剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01EX07 |
| KEGG DRUG |
D10463
リパスジル塩酸塩水和物
|
| KEGG DGROUP |
DG03201
眼圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| グラナテック点眼液0.4% | GLANATEC ophthalmic solution 0.4% | 興和 | 1319763Q1022 | 449.4円/mL | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 プロスタグランジン関連薬やβ遮断薬等の他の緑内障治療薬で効果不十分又は副作用等で使用できない場合に本剤の使用を検討すること。
5.2 急性閉塞隅角緑内障に対し本剤を用いる場合には、薬物療法以外に手術療法等を考慮すること。
6. 用法及び用量
1回1滴、1日2回点眼する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット:経口投与)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 眼 | 結膜充血(69.0%)注1)、結膜炎(アレルギー性結膜炎を含む)注2)、眼瞼炎(アレルギー性眼瞼炎を含む)注2)、眼刺激 | 角膜上皮障害(角膜びらん、点状角膜炎等)、眼そう痒、眼の異常感、眼脂、眼痛、結膜濾胞、眼圧上昇 | 眼瞼浮腫、霧視 |
| 過敏症 | 発疹、紅斑 | 接触性皮膚炎 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・本剤に含まれているベンザルコニウム塩化物はソフトコンタクトレンズに吸着されることがあるので、ソフトコンタクトレンズを装用している場合には、点眼前にレンズを外し、点眼後少なくとも5分以上間隔をあけてから再装用すること。
15. その他の注意
15.1 臨床使用に基づく情報
臨床試験において、角膜厚が減少する傾向が認められた。本剤投与による角膜厚の減少は可逆性であった。
15.2 非臨床試験に基づく情報
ウサギ13週間反復点眼投与試験の2.0%(2回/日)投与群及びイヌ13週間反復点眼投与試験の4.0%(4回/日)投与群において、水晶体前部の縫合線部に、混濁を伴った不可逆性の水晶体線維の変性像が認められた。水晶体におけるこれらの変化は、本剤のRhoキナーゼ阻害作用によりアクチンストレスファイバーの形成阻害が起き、水晶体線維細胞への分化、その後の伸展、遊走が阻害されたため生じた変化であると考えられた。
16. 薬物動態
16.1 血中濃度
16.1.1 反復点眼
健康成人男性8例に本剤を両眼に1回1滴、1日2回7日間反復点眼したとき、リパスジル及び主代謝物M1(イソキノリン環1位の水酸化体)の血漿中濃度推移及び薬物動態パラメータは次の図表のとおりであり、リパスジルの体循環への移行及び体内からの消失は速やかであった1)。
図 健康成人男性における反復点眼時の血漿中濃度推移
| \ | tmax(hr) | Cmax(ng/mL) | AUC0-τ(ng・hr/mL) | t1/2(hr) | |
| リパスジル | 点眼1日目 | 0.083[0.0] n=7 | 0.420±0.278 n=8 | 0.183±0.135 n=8 | − |
| 点眼7日目 | 0.083[56.6] n=8 | 0.622±0.161 n=8 | 0.231±0.091 n=8 | 0.455 n=1 | |
| M1 | 点眼1日目 | 0.500[37.6] n=8 | 1.198±0.582 n=8 | 3.838±2.085 n=8 | − |
| 点眼7日目 | 0.500[31.4] n=8 | 1.465±0.504 n=8 | 4.761±1.869 n=8 | 2.189±0.465 n=8 | |
16.2 吸収
一般に、点眼した薬物はそのほとんどが鼻涙管を通り経口投与と同様の経路での移行となるが、雄性白色ウサギにリパスジル塩酸塩水和物点眼液(リパスジルとして1.0%)50μLを単回片眼点眼したときには、最初の採血時点でリパスジルは最高血漿中濃度を示し(tmax:6.26分、Cmax:63.9ng/mL)、点眼後の循環血への薬物移行が速やかであることが示された。また、消失半減期は24.9分と短かったが、生物学的利用率は95.8%であり、高い体循環移行性を認めた2)。
16.3 分布
16.3.1 眼組織内移行
雄性有色ウサギに本剤(50μL)を単回両眼点眼したとき、角膜及び眼房水では0.25時間で最高濃度(68135.4ng/g及び4126.39ng/mL)に達し、その後速やかに消失した。水晶体では0.5時間で最高濃度(154.37ng/g)に達し、その後緩やかに消失した2)。
雄性有色ウサギに14C-リパスジル塩酸塩点眼液1.0%(50μL)を単回両眼点眼投与したとき、速やかに各眼組織に移行し、眼組織における放射能濃度は特にメラニン含有組織である虹彩・毛様体及び網膜・脈絡膜で高かった。1日2回7日間反復投与したとき、メラニン含有組織においては単回投与時と比較して放射能濃度が明らかに高くなったが、いずれの眼組織においても放射能濃度が消失する傾向が認められた2)。
16.4 代謝
ヒトでは主に肝臓においてアルデヒドオキシダーゼによりM1へ代謝され、またわずかにCYP3A4/5及びアルデヒドオキシダーゼによりM2(ホモピペラジン環5位の酸化体)へ代謝され、続けてアルデヒドオキシダーゼによりM6(イソキノリン環1位の水酸化及びホモピペラジン環5位の酸化体)へと代謝されることが示された。また、リパスジルはCYP2C8、CYP3A4/5によりM4(ホモピペラジン環ニトロン体)へ代謝され、その他M3(イソキノリン環N-オキシド体)及びM2を経由してM5(ホモピペラジン環5位の酸化及びイソキノリン環N-オキシド体)へ代謝される経路が推察された2)(in vitro、in vivo)。
16.5 排泄
健康成人男性8例に本剤1滴を両眼に単回点眼投与したとき、リパスジル及び代謝物M1の48時間までの尿中排泄率(平均値)はそれぞれ1.34%、48.68%であった。リパスジルとしての尿中への排泄はわずかであり、尿中排泄の大部分が代謝物M1であった。それらの尿中排泄量の大部分は単回投与12時間後までに排泄された。また、代謝物M2の総尿中排泄率はごくわずかであった3)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相プラセボ対照二重盲検比較試験
原発開放隅角緑内障又は高眼圧症患者107例を対象に、プラセボ又は本剤を両眼に1回1滴、1日2回、8週間点眼した。眼圧の推移及び変化量は次の図表のとおりであり、プラセボ群に対して本剤群で有意な眼圧下降作用を認めた。
図 単独投与時の眼圧推移
| \ | 朝点眼直前 | 点眼2時間後 |
| 本剤群(n=52) | −2.865±0.289[−3.439,−2.292] | −3.962±0.284[−4.525,−3.398] |
| プラセボ群(n=54) | −1.843±0.284[−2.405,−1.280] | −1.679±0.279[−2.232,−1.126] |
| 群間差 | −1.023±0.405*[−1.826,−0.219] | −2.283±0.398**[−3.072,−1.493] |
副作用発現頻度は、本剤群で79.2%(42/53例)であった。最も頻度の高かった副作用は結膜充血73.6%(39/53例)であり、結膜充血以外で2件以上発現した副作用は、眼刺激5.7%(3/53例)、角膜びらん3.8%(2/53例)、眼の異物感3.8%(2/53例)であった4)。
17.1.2 国内第III相ラタノプロスト点眼液併用試験
ラタノプロスト点眼液0.005%で効果不十分な原発開放隅角緑内障又は高眼圧症患者205例を対象に、プラセボ又は本剤を両眼に1回1滴、1日2回、ラタノプロスト点眼液0.005%に追加して8週間点眼した。眼圧の推移及び変化量は次の図表のとおりであった。
図 ラタノプロスト点眼液併用時の眼圧推移
| \ | 朝点眼直前 | 点眼2時間後 |
| 本剤群(n=101) | −2.246±0.164[−2.569,−1.922] | −3.191±0.178[−3.543,−2.840] |
| プラセボ群(n=102) | −1.808±0.163[−2.129,−1.486] | −1.835±0.177[−2.184,−1.486] |
| 群間差 | −0.438±0.231[−0.894,0.018] | −1.356±0.251**[−1.852,−0.861] |
副作用発現頻度は、本剤群で55.9%(57/102例)であった。最も頻度の高かった副作用は結膜充血54.9%(56/102例)であり、結膜充血以外で2件以上発現した副作用は、眼刺激5.9%(6/102例)、点状角膜炎2.0%(2/102例)であった5)。
17.1.3 国内第III相チモロール点眼液併用試験
チモロールマレイン酸塩点眼液0.5%で効果不十分な原発開放隅角緑内障又は高眼圧症患者208例を対象に、プラセボ又は本剤を両眼に1回1滴、1日2回、チモロールマレイン酸塩点眼液0.5%に追加して8週間点眼した。眼圧の推移及び変化量は次の図表のとおりであり、プラセボ群に対して本剤群で有意な眼圧下降作用を認めた。
図 チモロールマレイン酸塩点眼液併用時の眼圧推移
| \ | 朝点眼直前 | 点眼2時間後 |
| 本剤群(n=102) | −2.382±0.161[−2.700,−2.065] | −2.881±0.172[−3.220,−2.541] |
| プラセボ群(n=103) | −1.485±0.161[−1.802,−1.169] | −1.301±0.171[−1.639,−0.963] |
| 群間差 | −0.897±0.228**[−1.345,−0.448] | −1.580±0.243**[−2.059,−1.101] |
副作用発現頻度は、本剤群で66.3%(69/104例)であった。最も頻度の高かった副作用は結膜充血65.4%(68/104例)であり、結膜充血以外で2件以上発現した副作用は、眼刺激9.6%(10/104例)、点状角膜炎1.9%(2/104例)であった6)。
17.1.4 国内第III相長期投与試験
原発開放隅角緑内障、落屑緑内障又は高眼圧症患者354例を対象に、本剤を両眼に1回1滴、1日2回、単独及びプロスタグランジン(PG)関連薬、β遮断薬又はそれらの配合剤に追加して52週間点眼した。眼圧の推移は次の図のとおりであり、単独点眼、併用点眼にかかわらず長期投与で安定した眼圧下降を認め、投与期間の延長による眼圧下降効果の減弱を認めなかった。
図 長期投与時の眼圧推移
副作用発現頻度は、単独コホートで86.7%(150/173例)、併用コホートで83.4%(151/181例)であった。全コホートで2.0%以上発現した副作用は、結膜充血74.3%(263/354例)、眼瞼炎17.8%(63/354例)、アレルギー性結膜炎15.3%(54/354例)、眼刺激10.2%(36/354例)、結膜炎4.5%(16/354例)、眼瞼そう痒症4.0%(14/354例)であった7)。
18. 薬効薬理
18.1 作用機序
リパスジルの眼圧下降作用の機序として、Rhoキナーゼ阻害作用に基づく線維柱帯−シュレム管を介する主流出路からの房水流出促進が示唆されている8)。
18.2 Rhoキナーゼ阻害作用
リパスジルはRhoキナーゼのアイソフォームであるヒトROCK-1及びROCK-2に対して選択的な阻害作用を示した8)(in vitro)。
18.3 主流出路からの房水流出促進作用
ウサギに本剤を単回点眼したとき、房水流出率は基剤投与群に比べて有意に増加した。一方、ぶどう膜強膜流量及び房水産生量に影響を及ぼさなかった8)。
18.4 眼圧下降作用
ウサギにリパスジル塩酸塩水和物点眼液0.0625〜0.5%を、サルに0.1〜0.4%を単回点眼投与したとき、濃度依存的な眼圧下降効果が認められた8)。
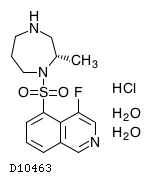
19. 有効成分に関する理化学的知見
19.1. リパスジル塩酸塩水和物
22. 包装
プラスチック点眼瓶
5mL×5本、5mL×10本、5mL×30本
23. 主要文献
- 興和(株)社内資料:第I相頻回・反復投与試験(2014年9月26日承認、CTD2.7.6.2)
- 興和(株)社内資料:非臨床試験 薬物動態試験(2014年9月26日承認、CTD2.6.4.1-11)
- 興和(株)社内資料:第I相単回投与試験(2014年9月26日承認、CTD2.7.6.1)
- 興和(株)社内資料:第III相プラセボ対照二重盲検比較試験(2014年9月26日承認、CTD2.7.6.5)
- 興和(株)社内資料:第III相ラタノプロスト点眼液併用試験(2014年9月26日承認、CTD2.7.6.6)
- 興和(株)社内資料:第III相チモロール点眼液併用試験(2014年9月26日承認、CTD2.7.6.7)
- 興和(株)社内資料:第III相長期投与試験(2014年9月26日承認、CTD2.7.6.9)
- 興和(株)社内資料:非臨床試験 薬理試験(2014年9月26日承認、CTD2.6.2.1-8)
24. 文献請求先及び問い合わせ先
文献請求先
興和株式会社
くすり相談センター 受付時間 9:00〜17:00(土・日・祝日・弊社休日を除く)
〒103-8433
東京都中央区日本橋本町三丁目4-14
電話:0120-508-514
03-3279-7587
03-3279-7587
製品情報問い合わせ先
興和株式会社
くすり相談センター 受付時間 9:00〜17:00(土・日・祝日・弊社休日を除く)
〒103-8433
東京都中央区日本橋本町三丁目4-14
電話:0120-508-514
03-3279-7587
03-3279-7587
26. 製造販売業者等
26.1 製造販売元
興和株式会社
東京都中央区日本橋本町三丁目4-14