医薬品情報
| 総称名 | オフロキサシン |
|---|---|
| 一般名 | オフロキサシン |
| 欧文一般名 | Ofloxacin |
| 製剤名 | オフロキサシン点眼液 |
| 薬効分類名 | 広範囲抗菌点眼剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01AE01 |
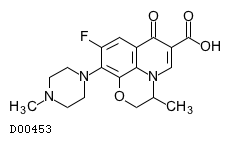
| KEGG DRUG |
D00453
オフロキサシン
|
| KEGG DGROUP |
DG01549
ニューキノロン系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オフロキサシン点眼液0.3%「サワイ」 | OFLOXACIN Ophthalmic Solution[SAWAI] | 沢井製薬 | 1319722Q1236 | 107.4円/mL | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分及びキノロン系抗菌剤に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、1回1滴、1日3回点眼する。なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 長期間使用しないこと。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
紅斑、発疹、呼吸困難、血圧低下、眼瞼浮腫等の症状が認められた場合には投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 1%未満 | 頻度不明 | |
| 眼 | 眼刺激、眼痛 | びまん性表層角膜炎等の角膜障害、眼瞼炎、結膜炎、眼のそう痒感 |
| 皮膚 | そう痒、発疹、蕁麻疹 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・遮光して保存すること。
16. 薬物動態
16.3 分布
・白内障手術患者(25例)に0.3%オフロキサシン点眼液1回1滴を術前5分毎5回点眼したとき、房水中濃度は最終点眼後1時間前後に最高値(1.20μg/mL)を示した1)。
・白色ウサギに0.3%オフロキサシン点眼液を1回1滴点眼したとき、角膜、球結膜、眼筋、強膜、虹彩・毛様体及び房水に良好な移行を認めた。その移行量は角膜、強膜、眼筋、虹彩・毛様体において点眼終了1時間後に最高値を示し、それぞれの値は3.32μg/g、1.62μg/g、2.62μg/g、0.95μg/gであった。また球結膜では15分後に2.95μg/g、前房水では30分後に0.71μg/mLとそれぞれ最高値を示した1)。
・白色ウサギに0.3%オフロキサシン点眼液を1回1滴、5分毎に5回点眼したとき、上記の1回点眼した場合と同様に眼組織へ良好な移行が認められた。その移行量は角膜、強膜、球結膜において点眼終了5分後に最高値を示し、それぞれの値は、7.78μg/g、7.66μg/g、34.98μg/gであった。また眼筋では15分後に18.54μg/g、虹彩・毛様体、硝子体では30分後にそれぞれ3.12μg/g、0.80μg/mL、前房水では1時間後に3.56μg/mLと最高値を示した1)。
・白色及び有色ウサギに0.3%オフロキサシン点眼液を1回1滴、1日3回2週間両眼に点眼し眼内動態を比較したとき、メラニン含有組織である虹彩・毛様体、網脈絡膜における濃度差がみられた。メラニン含有していない組織では房水中濃度を除いて白色と有色ウサギの間に組織内濃度の動態に大きな差は認められなかった2)。
16.8 その他
16.8.1 生物学的同等性試験
ウサギの片眼にオフロキサシン点眼液0.3%「サワイ」とタリビッド点眼液0.3%をそれぞれ50μL点眼し、前房水中及び角膜中のオフロキサシン濃度を測定した。両剤は前房水中及び角膜中に同様の組織内移行を示し、また、投与後30分、60分、120分において両剤の前房水中及び角膜中のオフロキサシン濃度の統計解析を行った結果、両剤間に有意な差は認められず、両剤は生物学的に同等であると判断された3)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<眼瞼炎、涙嚢炎、麦粒腫、結膜炎、瞼板腺炎、角膜炎(角膜潰瘍を含む)>
17.1.1 国内第II相試験
外眼部細菌感染症患者286例を対象に、0.3%、0.5%オフロキサシン点眼液(1回2滴、1日4回)注1)又は0.3%ミクロノマイシン硫酸塩点眼液(1回2滴、1日4回)を原則3日以上(症状消失後2日まで。ただし、原則として2週間を超えない)点眼した結果、累積有効率(有効以上※)は0.3%オフロキサシン点眼液群98.5%(66/67例)、0.5%オフロキサシン点眼液群97.5%(79/81例)、0.3%ミクロノマイシン硫酸塩点眼液群89.6%(69/77例)であり、0.3%オフロキサシン点眼液群は0.3%ミクロノマイシン硫酸塩点眼液群と比較し、有意に優れた臨床効果が認められた。また、0.3%オフロキサシン点眼液群の疾患別及び有効菌種別臨床効果は表1及び表2のとおりであった。
0.3%オフロキサシン点眼液群において副作用は94例中2例(2.1%)に認められ、主な副作用はしみるであった4)。
0.3%オフロキサシン点眼液群において副作用は94例中2例(2.1%)に認められ、主な副作用はしみるであった4)。
※眼感染症研究会制定基準(1982年)に従い評価。
注1)本剤が承認されている濃度は0.3%、用法・用量は通常1回1滴、1日3回点眼、症状により適宜増減である。
| 疾患名 | 有効率※(%)〔有効以上〕 |
| 眼瞼炎 | 100.0(3/3) |
| 涙嚢炎 | 100.0(3/3) |
| 麦粒腫 | 100.0(4/4) |
| 結膜炎 | 98.2(55/56) |
| 瞼板腺炎 | 100.0(2/2) |
| 角膜炎 | 100.0(3/3) |
| 菌種 | 有効率※(%)〔有効以上〕 |
| ブドウ球菌属 | 100.0(41/41) |
| レンサ球菌属 | 100.0(5/5) |
| 肺炎球菌 | 100.0(4/4) |
| ミクロコッカス属 | 100.0(1/1) |
| モラクセラ属 | 100.0(1/1) |
| コリネバクテリウム属 | 100.0(11/11) |
| クレブシエラ属 | 0.0(0/1) |
| セラチア属 | 100.0(2/2) |
| プロテウス属 | 100.0(1/1) |
| ヘモフィルス・エジプチウス(コッホ・ウィークス菌) | 100.0(4/4) |
| シュードモナス属 | 100.0(9/9) |
| 緑膿菌 | 100.0(2/2) |
| バークホルデリア・セパシア | 100.0(6/6) |
| アシネトバクター属 | 100.0(2/2) |
17.1.2 国内第III相試験
外眼部細菌感染症患者373例を対象に、0.3%オフロキサシン点眼液(1回2滴、1日4回)注2)又は0.3%ジベカシン点眼液(1回2滴、1日4回)を原則3日以上(症状消失後2日まで。ただし、原則として2週間を超えない)点眼した結果、0.3%オフロキサシン点眼液群の累積有効率(有効以上※)は99.3%(137/138例)であり、0.3%ジベカシン点眼液群の94.3%(115/122例)と比較し、臨床効果が優れている傾向が認められた。また、0.3%オフロキサシン点眼液群の疾患別及び有効菌種別臨床効果は表3及び表4のとおりであった。
0.3%オフロキサシン点眼液群において副作用は178例中2例(1.1%)に認められ、いずれもしみるであった5)。
0.3%オフロキサシン点眼液群において副作用は178例中2例(1.1%)に認められ、いずれもしみるであった5)。
※眼感染症研究会制定の評価判定基準(1985年)に準拠し評価。
注2)本剤が承認されている用法・用量は、通常1回1滴、1日3回点眼、症状により適宜増減である。
| 疾患名 | 有効率※(%)〔有効以上〕 |
| 眼瞼炎 | 100.0(9/9) |
| 涙嚢炎 | 100.0(13/13) |
| 麦粒腫 | 100.0(12/12) |
| 結膜炎 | 99.0(101/102) |
| 瞼板腺炎 | 100.0(5/5) |
| 角膜炎 | 100.0(4/4) |
| 菌種 | 有効率※(%)〔有効以上〕 |
| ブドウ球菌属 | 98.7(78/79) |
| レンサ球菌属 | 100.0(18/18) |
| 肺炎球菌 | 100.0(11/11) |
| ミクロコッカス属 | 100.0(3/3) |
| モラクセラ属 | 100.0(8/8) |
| コリネバクテリウム属 | 100.0(29/29) |
| セラチア属 | 100.0(6/6) |
| プロテウス属 | 100.0(2/2) |
| インフルエンザ菌 | 100.0(8/8) |
| ヘモフィルス・エジプチウス(コッホ・ウィークス菌) | 100.0(5/5) |
| シュードモナス属 | 100.0(16/16) |
| アシネトバクター属 | 100.0(8/8) |
| アクネ菌 | 100.0(2/2) |
17.1.3 国内第III相試験
外眼部細菌感染症患者448例を対象に、0.3%オフロキサシン点眼液(1回1滴、1日3回)又は0.3%ミクロノマイシン硫酸塩点眼液(1回2滴、1日4回)を原則3日以上(症状消失後2日まで。ただし、原則として2週間を超えない)点眼した結果、0.3%オフロキサシン点眼液群の累積有効率(有効以上※)は93.0%(173/186例)であり、0.3%ミクロノマイシン硫酸塩点眼液群の85.2%(155/182例)と比較し、有意に優れた臨床効果が認められた。また、0.3%オフロキサシン点眼液群の疾患別及び有効菌種別臨床効果は表5及び表6のとおりであった。
0.3%オフロキサシン点眼液群186例に副作用は認められなかった6)。
0.3%オフロキサシン点眼液群186例に副作用は認められなかった6)。
※眼感染症研究会制定の評価判定基準(1985年)に準拠し評価。
| 疾患名 | 有効率※(%)〔有効以上〕 |
| 眼瞼炎 | 100.0(9/9) |
| 涙嚢炎 | 82.9(29/35) |
| 麦粒腫 | 90.0(9/10) |
| 結膜炎 | 95.0(113/119) |
| 瞼板腺炎 | 100.0(7/7) |
| 角膜炎(角膜潰瘍を含む) | 93.1(27/29) |
| 菌種 | 有効率※(%)〔有効以上〕 |
| ブドウ球菌属 | 92.6(112/121) |
| レンサ球菌属 | 100.0(15/15) |
| 肺炎球菌 | 83.3(15/18) |
| ミクロコッカス属 | 90.0(9/10) |
| モラクセラ属 | 100.0(5/5) |
| コリネバクテリウム属 | 85.0(17/20) |
| クレブシエラ属 | 100.0(3/3) |
| セラチア属 | 100.0(1/1) |
| プロテウス属 | 100.0(1/1) |
| インフルエンザ菌 | 100.0(8/8) |
| ヘモフィルス・エジプチウス(コッホ・ウィークス菌) | 85.7(6/7) |
| シュードモナス属 | 84.6(11/13) |
| 緑膿菌 | 100.0(3/3) |
| バークホルデリア・セパシア | 100.0(2/2) |
| アシネトバクター属 | 100.0(6/6) |
| アクネ菌 | 100.0(3/3) |
<眼科周術期の無菌化療法>
17.1.4 国内一般臨床試験
眼手術患者367例を対象に、0.3%オフロキサシン点眼液を1日5回注3)、手術前2日間点眼した結果、全例とも術後感染はみられなかった。
副作用は認められなかった7)。
副作用は認められなかった7)。
注3)本剤が承認されている用法・用量は、1回1滴、1日3回点眼、症状により適宜増減である。
18. 薬効薬理
18.1 作用機序
18.2 抗菌作用
18.3 生物学的同等性試験
ウサギ緑膿菌角膜感染症モデルにおける角膜混濁のスコアを指標として、オフロキサシン点眼液0.3%「サワイ」とタリビッド点眼液0.3%の緑膿菌感染による角膜潰瘍に対する治療効果を比較検討した。その結果、両剤ともコントロール(生理食塩液)群および基剤(オフロキサシン点眼液0.3%「サワイ」の基剤)群に比して有意な治療効果を示し、両剤間に有意な差は認められず、両剤は生物学的に同等であると判断された11)。
19. 有効成分に関する理化学的知見
19.1. オフロキサシン
20. 取扱い上の注意
外箱開封後は、遮光して保存すること。
22. 包装
プラスチック点眼容器
5mL×10本
23. 主要文献
- 福田正道他, 日本眼科紀要, 37, 823-828, (1986)
- 三井幸彦他, あたらしい眼科, 10, 83-86, (1993)
- 社内資料:生物学的同等性試験(薬物動態学的試験)
- 三井幸彦他, 眼科臨床医報, 79, 1718-1736, (1985)
- 三井幸彦他, 眼科臨床医報, 80, 1813-1828, (1986)
- 三井幸彦他, 日本眼科紀要, 37, 1115-1140, (1986)
- 田村修他, 眼科臨床医報, 80, 1104-1116, (1986)
- Kato, J. et al., Cell, 63, 393-404, (1990) »PubMed
- 田中千賀子他編, NEW薬理学,改訂第7版, 567-569, (2017), (南江堂)
- 西野武志他, Chemotherapy, 32 (Supp.1), 62-83, (1984)
- 社内資料:生物学的同等性試験(薬理学的試験)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30