医薬品情報
| 総称名 | オキサリプラチン |
|---|---|
| 一般名 | オキサリプラチン |
| 欧文一般名 | Oxaliplatin |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01XA03 |
| KEGG DRUG |
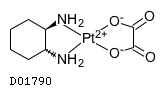
D01790
オキサリプラチン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年1月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オキサリプラチン点滴静注50mg「トーワ」 (後発品) | OXALIPLATIN INTRAVENOUS INFUSION 50mg"TOWA" | 東和薬品 | 4291410A1126 | 5034円/瓶 | 毒薬, 処方箋医薬品注) |
| オキサリプラチン点滴静注100mg「トーワ」 (後発品) | OXALIPLATIN INTRAVENOUS INFUSION 100mg"TOWA" | 東和薬品 | 4291410A2122 | 8609円/瓶 | 毒薬, 処方箋医薬品注) |
| オキサリプラチン点滴静注200mg「トーワ」 (後発品) | OXALIPLATIN INTRAVENOUS INFUSION 200mg"TOWA" | 東和薬品 | 4291410A3110 | 15633円/瓶 | 毒薬, 処方箋医薬品注) |
1. 警告
1.1 本剤を含むがん化学療法は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本療法が適切と判断される症例についてのみ実施すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
1.2 本剤投与後数分以内の発疹、そう痒、気管支痙攣、呼吸困難、血圧低下等を伴うショック、アナフィラキシーが報告されているので、患者の状態を十分に観察し、過敏症状(気管支痙攣、呼吸困難、血圧低下等)が認められた場合には、本剤の投与を直ちに中止し適切な処置を行うこと。また、回復後は本剤を再投与しないこと。[8.4、11.1.2参照]
1.3 本剤はレボホリナート及びフルオロウラシルの静脈内持続投与法等との併用の場合に有用性が認められており、用法及び用量を遵守すること。また、本併用療法において致死的な転帰に至る重篤な副作用があらわれることがあるので、患者の状態を十分観察し、異常が認められた場合には、速やかに適切な処置を行うこと。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<結腸癌における術後補助療法>
<治癒切除不能な膵癌>
6. 用法及び用量
治癒切除不能な進行・再発の結腸・直腸癌、結腸癌における術後補助療法及び胃癌にはA法又はB法を、治癒切除不能な膵癌及び小腸癌にはA法を使用する。なお、患者の状態により適宜減量する。
A法
他の抗悪性腫瘍剤との併用において、通常、成人にはオキサリプラチンとして85mg/m2(体表面積)を1日1回静脈内に2時間で点滴投与し、少なくとも13日間休薬する。これを1サイクルとして投与を繰り返す。
B法
他の抗悪性腫瘍剤との併用において、通常、成人にはオキサリプラチンとして130mg/m2(体表面積)を1日1回静脈内に2時間で点滴投与し、少なくとも20日間休薬する。これを1サイクルとして投与を繰り返す。
7. 用法及び用量に関連する注意
<効能共通>
7.4
米国の添付文書中には、本剤とホリナート及びフルオロウラシルの静脈内持続投与法との併用療法注1)を行う場合、以下のような投与スケジュール(FOLFOX4法)を2週毎に行うことが推奨されるとの記載がある4)。
| 第1日目 | 別々のバッグから5%ブドウ糖注射液250〜500mLに溶解した本剤85mg/m2及び5%ブドウ糖注射液に溶解したホリナート200mg/m2注2)を120分かけて同時に点滴静注する。その後フルオロウラシル400mg/m2を2〜4分間で急速静脈内投与し、引き続き5%ブドウ糖注射液500mL(推奨)に溶解したフルオロウラシル600mg/m2を22時間かけて持続静注する。 |
| 第2日目 | ホリナート200mg/m2注2)を120分かけて点滴静注し、その後フルオロウラシル400mg/m2を2〜4分間で急速静脈内投与、引き続き5%ブドウ糖注射液500mL(推奨)に溶解したフルオロウラシル600mg/m2を22時間かけて持続静注する。 |
また、米国の添付文書中には、次表の投与可能条件、減量基準の記載がある。
| 種類 | 程度 |
| 好中球数 | 1,500/mm3以上 |
| 血小板数 | 75,000/mm3以上 |
| 種類 | 最悪時の程度 | 次回投与量 |
| 好中球数 | 500/mm3未満 | 本剤を65mg/m2注5)又は75mg/m2注6)に減量 フルオロウラシルを20%減量(300mg/m2の急速静脈内投与及び500mg/m2の22時間持続静注) |
| 発熱性好中球減少症注3) | − | |
| 血小板数 | 50,000/mm3未満 | |
| 消化器系の有害事象 (予防的治療の施行にもかかわらず発現) | Grade 3注4)以上 |
注1)国内において、ホリナート注射剤の「結腸・直腸癌に対するフルオロウラシルの抗腫瘍効果の増強」に関する効能・効果は承認されていない。
注2)レボホリナート100mg/m2に相当する。
注3)発熱性好中球減少症が発現した場合は、次回投与量に従い減量する。
注4)「治癒切除不能な進行・再発の結腸・直腸癌」の場合はNCI-CTC version 2.0(1998年)。「結腸癌における術後補助療法」の場合はNCI-CTC version 1(1982年)。
注5)「治癒切除不能な進行・再発の結腸・直腸癌」の場合。
注6)「結腸癌における術後補助療法」の場合。
7.5 カペシタビンとの併用療法(XELOX法)を行う場合には、次の投与可能条件及び減量基準を参考にすること。
| 種類 | 程度 |
| 好中球数 | 1,500/mm3以上 |
| 血小板数 | 75,000/mm3以上 |
| 種類 | 最悪時の程度 | 次回投与量 |
| 前回の投与後に発現した有害事象 | Grade 3注7)以上 | 1回目発現時:本剤を100mg/m2に減量 2回目発現時:本剤を85mg/m2に減量 |
<結腸癌における術後補助療法>
7.6 レボホリナート及びフルオロウラシルの静脈内持続投与法との併用では投与期間が12サイクル、カペシタビンとの併用では8サイクルを超えた場合の有効性及び安全性は確立していない(投与経験がない)。
<治癒切除不能な膵癌>
7.7 イリノテカン塩酸塩水和物、レボホリナート、フルオロウラシルとの併用療法(FOLFIRINOX法)を行う場合には、次の投与可能条件、減量基準及び減量時の投与量を参考にすること。
| 種類 | 程度 |
| 好中球数 | 1,500/mm3以上 |
| 血小板数 | 75,000/mm3以上 |
| 副作用注8) | 程度 | 減量方法 |
| 好中球減少 | 以下のいずれかの条件を満たす場合: 1)2サイクル目以降の投与可能条件を満たさず投与を延期 2)500/mm3未満が7日以上持続 3)感染症又は下痢を併発し、かつ1,000/mm3未満 4)発熱性好中球減少症 | イリノテカン塩酸塩水和物を優先的に減量する。 ただし、イリノテカン塩酸塩水和物の投与レベルが本剤より低い場合は、イリノテカン塩酸塩水和物と同じレベルになるまで本剤を減量する。 |
| 下痢 | 発熱(38℃以上)を伴う | |
| Grade 3注9)以上 | フルオロウラシル持続静注を減量する。 | |
| 血小板減少 | 以下のいずれかの条件を満たす場合: 1)2サイクル目以降の投与可能条件を満たさず投与を延期 2)50,000/mm3未満 | 本剤を優先的に減量する。 ただし、本剤の投与レベルがイリノテカン塩酸塩水和物より低い場合は、本剤と同じレベルになるまでイリノテカン塩酸塩水和物を減量する。 |
| 総ビリルビン上昇 | 2.0mg/dL超3.0mg/dL以下 | イリノテカン塩酸塩水和物を120mg/m2に減量する。 |
| 3.0mg/dL超 | イリノテカン塩酸塩水和物を90mg/m2に減量する。 | |
| 粘膜炎 | Grade 3注9)以上 | フルオロウラシル持続静注を減量する。 |
| 手足症候群 |
| 投与レベル | 本剤 | イリノテカン塩酸塩水和物 | フルオロウラシル持続静注 |
| −1 | 65mg/m2 | 150mg/m2 | 1,800mg/m2 |
| −2 | 50mg/m2 | 120mg/m2 | 1,200mg/m2 |
| −3 | 中止 | 中止 | 中止 |
<胃癌における術後補助療法>
7.8 A法を使用した場合の有効性及び安全性は確立していない。
7.9 カペシタビンとの併用では8サイクルを超えた場合の有効性及び安全性は確立していない(投与経験がない)。
8. 重要な基本的注意
<効能共通>
8.1 末梢神経症状、咽頭喉頭感覚異常は、特に低温又は冷たいものへの曝露により誘発又は悪化すること、多くは本剤の投与毎にあらわれるが休薬により回復する場合が多いことを、患者に対して十分に説明するとともに、冷たい飲み物や氷の使用を避け、低温時には皮膚を露出しないよう指導すること。[2.1、9.1.2、11.1.1参照]
8.2 骨髄機能抑制等の重篤な副作用が起こることがあり、ときに致命的な経過をたどることがあるので、定期的に臨床検査(血液検査、肝機能検査、腎機能検査等)を行うなど、患者の状態を十分に観察すること。[9.1.1、9.1.4、11.1.4、11.1.5参照]
8.4 気管支痙攣、呼吸困難、血圧低下等の重篤な過敏症状があらわれることがあり、重篤な過敏症状は本剤を複数回投与した後に発現する場合や、本剤の投与から数時間後に発現する場合があるので、患者の状態を十分に観察し、異常が認められた場合には直ちに中止し適切な処置を行うこと5)6)。[1.2、11.1.2参照]
8.5 悪心、嘔吐、食欲不振等の消化器症状がほとんど全例に起こるので、患者の状態を十分に観察し、適切な処置を行うこと。
8.6 薬剤誘発性血小板減少症があらわれることがあるので、紫斑、鼻出血、口腔粘膜出血等の症状を十分に観察すること。[11.1.6参照]
8.7 溶血性貧血があらわれることがあるので、黄疸等の症状を十分に観察すること。[11.1.7参照]
<治癒切除不能な進行・再発の胃癌、小腸癌>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄機能抑制のある患者
9.1.2 感覚異常又は知覚不全のある患者
9.1.3 心疾患を有する患者
9.1.4 感染症を合併している患者
9.1.5 水痘患者
致命的な全身障害があらわれるおそれがある。
9.2 腎機能障害患者
観察を十分に行い、発現する副作用に対して適切な処置を行うこと。腎障害患者では、本剤の限外ろ過血漿中白金のクリアランスが減少するが、限外ろ過血漿中白金濃度と臨床における安全性及び有効性との薬力学的関係は明確ではない。[16.6.1参照]
9.2.1 重篤な腎機能障害のある患者
腎機能が低下しているので、副作用が強くあらわれるおそれがある。
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、本剤投与中及び投与終了後一定期間は適切な避妊をするよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性には、本剤投与中及び投与終了後一定期間は適切な避妊をするよう指導すること。細菌を用いた復帰突然変異試験、ほ乳類培養細胞を用いた染色体異常試験及びマウス骨髄細胞を用いた小核試験において、遺伝毒性が報告されている10)。
9.4.3 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中への移行が報告されている12)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。一般に生理機能(骨髄機能、肝機能、腎機能等)が低下している。
10. 相互作用
10.2 併用注意
| 他の抗悪性腫瘍剤 放射線照射 | 骨髄機能抑制等を増強することがあるので、併用療法を行う場合には、患者の状態を十分に観察し、必要に応じて減量するか又は投与間隔を延長すること。 | 併用により殺細胞作用が増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 末梢神経症状
手、足や口唇周囲部の感覚異常又は知覚不全(末梢神経症状:96.6%)が本剤の投与直後からほとんど全例にあらわれる。また、咽頭喉頭の絞扼感(咽頭喉頭感覚異常:6.3%)があらわれることがある。末梢神経症状の悪化や回復遅延が認められると、手、足等がしびれて文字を書きにくい、ボタンをかけにくい、飲み込みにくい、歩きにくい等の感覚性の機能障害(頻度不明)があらわれることがあるので、感覚性の機能障害があらわれた場合には減量、休薬、中止等の適切な処置を行うこと。感覚性の機能障害が外国では累積投与量850mg/m2で10%、1,020mg/m2で20%に認められたと報告されている。[2.1、8.1、9.1.2参照]
11.1.2 ショック、アナフィラキシー
11.1.3 間質性肺炎(0.6%)、肺線維症(頻度不明)
発熱、咳嗽、呼吸困難等の臨床症状を十分に観察し、異常が認められた場合には投与を中止し、胸部X線等の検査を実施するとともに副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.4 骨髄機能抑制
11.1.5 溶血性尿毒症症候群
血小板減少、溶血性貧血、腎不全を主徴とする溶血性尿毒症症候群(頻度不明)があらわれることがある。[8.2参照]
11.1.6 薬剤誘発性血小板減少症
免疫学的機序を介した血小板減少症(0.6%)があらわれることがある。[8.6参照]
11.1.7 溶血性貧血
免疫学的機序を介したクームス試験陽性の溶血性貧血(頻度不明)があらわれることがある。[8.7参照]
11.1.8 視野欠損、視野障害、視神経炎、視力低下
視野欠損(0.6%)、視野障害(頻度不明)、視神経炎(頻度不明)、視力低下(頻度不明)等の視覚障害があらわれることがある。
11.1.9 血栓塞栓症(3.4%)
11.1.11 肝静脈閉塞症(VOD)(頻度不明)
肝静脈閉塞症等の肝障害による門脈圧亢進、食道胃静脈瘤、脾腫、血小板減少症の発症に注意すること。
11.1.12 急性腎障害
間質性腎炎(頻度不明)、尿細管壊死(頻度不明)等により、急性腎障害(頻度不明)等の重篤な腎障害があらわれることがあるので、腎機能検査値(BUN、血清クレアチニン値等)に異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.13 白質脳症(可逆性後白質脳症症候群を含む)(頻度不明)
歩行時のふらつき、舌のもつれ、痙攣、頭痛、錯乱、視覚障害等が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.14 高アンモニア血症
意識障害を伴う高アンモニア血症(頻度不明)があらわれることがある。
11.1.15 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等が認められた場合には、投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
11.1.16 難聴
難聴(頻度不明)、耳鳴(0.6%)等があらわれることがある。
11.1.17 感染症
11.1.18 肝機能障害
AST上昇(38.9%)、ALT上昇(32.6%)、ビリルビン上昇(6.3%)等を伴う肝機能障害があらわれることがある。
副作用発現頻度は、国内臨床試験(175例)に基づき算出した。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 精神神経系 | 味覚異常、頭痛、神経痛、コリン作動性症候群 | 不眠、浮動性めまい、回転性眩暈、傾眠、うつ病、失神、不安、構語障害、不随意性筋収縮 | 深部腱反射欠損、不全失語症、失調、神経過敏、レルミット徴候、脳神経麻痺、線維束攣縮、脳神経障害、めまい、頭重感、振戦、こわばり、硬直、筋骨格硬直、記憶障害、筋骨格系胸痛 |
| 消化器 | 悪心注)(80.0%)、下痢(56.0%)、嘔吐注)(49.1%)、食欲不振(89.1%)、口内炎(35.4%)、便秘、しゃっくり、腹痛、歯肉炎 | 胃部不快感、腸閉塞、上腹部痛、腹部膨満感、下腹部痛、腹部不快感、大腸炎、歯周病、胃炎、歯肉出血、歯痛、心窩部不快感、口内乾燥、腹水、齲歯、鼓腸、胃食道逆流性疾患、胃腸音異常、痔核、下部消化管出血、食道炎、消化不良、歯の異常 | 直腸炎、しぶり腹、腸内ガス、胃重圧感、腸壁気腫症、門脈ガス血症、消化管壊死、メレナ、胃痛、粘膜の炎症、胃腸障害、肛門周囲痛、膵炎、口腔内痛 |
| 腎臓 | 蛋白尿、BUN上昇、尿糖、尿沈渣異常 | クレアチニン上昇、血尿、尿ウロビリノーゲン異常、頻尿、膀胱炎、側腹部痛、尿量減少 | 排尿困難、尿失禁、腎機能障害 |
| 肝臓 | ALP上昇、LDH上昇 | γ-GTP上昇 | |
| 血液 | 白血球分画の変動(42.3%) | 白血球増加、血小板増加 | プロトロンビン時間延長 |
| 循環器 | 高血圧 | 低血圧、ほてり、頻脈、血管障害、上室性不整脈 | アダムス・ストークス症候群、動悸 |
| 呼吸器 | 鼻出血、鼻咽頭炎 | 呼吸困難、咳嗽、上気道感染、発声障害、咽頭炎、鼻粘膜障害 | 肺障害、嗄声、低酸素症、息切れ、喀血 |
| 電解質 | 血清カリウムの異常、血清ナトリウムの異常、血清クロールの異常 | 血清カルシウムの異常、血中リン減少 | |
| 眼 | 流涙、視覚障害、結膜炎、眼球周囲痛、眼のそう痒感、眼の異常感、涙道閉塞 | 涙器障害、白内障、眼乾燥、眼瞼下垂 | |
| 皮膚 | 脱毛、手足症候群(32.0%)、色素沈着、口唇炎 | 潮紅、多汗、皮膚乾燥、爪の障害、爪囲炎、皮下出血、寝汗、ざ瘡様皮膚炎 | 色素変化、紫斑、顔面潮紅、皮膚剥脱、顔面のほてり、皮膚障害、ヘルペス性皮膚炎 |
| 過敏症 | 発疹、薬物過敏症 | そう痒症、じん麻疹、紅斑、鼻炎 | 紅斑性皮疹、血管浮腫、アレルギー性鼻炎、気管支痙攣 |
| 投与部位 | 注射部位反応 | 血管炎、注射部位血管外漏出 | 血管痛 |
| その他 | 倦怠感、疲労(60.0%)、発熱、アルブミン減少、CRP上昇、体重減少、総蛋白減少 | 浮腫、感染、末梢性浮腫、脱水、コレステロール上昇、関節痛、悪寒、胸部不快感、背部痛、四肢痛、筋痛、鼻汁、胸痛、尿路感染、腰痛、熱感、胸部圧迫感、臀部痛、疼痛、骨痛、体重増加、下肢異常感 | 代謝障害、膣出血、戦慄、多臓器不全、腫瘍穿孔、高血糖、感冒、アミラーゼ上昇、出血、CK上昇、カテーテル関連感染、筋脱力、代謝性アシドーシス、乳汁漏出症 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は15℃以下で保存した場合、結晶を析出することがある。析出した場合は振盪するなどして、溶解させた後に使用すること。[20.2参照]
14.1.2 本剤は細胞毒性を有するため、調製時には手袋を着用することが望ましい。皮膚に薬液が付着した場合には、直ちに石鹸及び多量の流水で洗い流すこと。眼、粘膜に薬液が付着した場合には、直ちに多量の流水でよく洗い流すこと。
14.1.3 本剤は、錯化合物であるので、他の抗悪性腫瘍剤とは混合調製しないこと。
14.1.4 本剤を5%ブドウ糖注射液に注入し、250〜500mLとすること。
14.1.5 本剤は塩化物含有溶液により分解するため、生理食塩液等の塩化物を含む輸液との配合を避けること。
14.1.6 本剤は塩基性溶液により分解するため、塩基性溶液との混和は行わないこと。[14.2.1参照]
14.1.7 本剤のような白金化合物は、アルミニウムとの接触により分解することが報告されているため、本剤の調製時にアルミニウムが用いられている機器(注射針等)は使用しないこと。[14.2.2参照]
14.1.8 本剤は希釈後、できるだけ速やかに投与すること。
14.2 薬剤投与時の注意
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤と他の抗悪性腫瘍剤との併用により、骨髄異形成症候群、急性骨髄性白血病、神経内分泌癌等の二次性悪性腫瘍が発生したとの報告がある。
15.1.2 欧州などで実施された原発巣治癒切除後のStageII又はIIIの結腸癌を対象とした第III相試験4)13)14)において、肝酵素上昇が本剤とホリナート及びフルオロウラシルの静脈内持続投与法との併用療法(FOLFOX4法)の投与群で57%(629/1,108例)、ホリナート及びフルオロウラシルの静脈内持続投与法(LV5FU2法)の投与群で34%(379/1,111例)、アルカリホスファターゼ上昇がFOLFOX4投与群で42%(467/1,108例)、LV5FU2投与群で20%(222/1,111例)と、いずれもFOLFOX4投与群で高頻度に発現することが報告されている。[17.1.12参照]
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回及び反復投与
結腸・直腸癌患者67例(単独投与)注1)注2)から得られた626時点の限外ろ過血漿中白金濃度測定値を用いて、薬物動態パラメータに影響を及ぼしうる患者側因子を検討した。限外ろ過血漿中白金濃度を3コンパートメントモデルにて解析した結果、そのクリアランスは、クレアチニンクリアランス(CrCL、mL/min)と相関を示した。
結腸・直腸癌患者18例(レボホリナート及びフルオロウラシルの急速静脈内投与法との併用投与)から得られた108時点の限外ろ過血漿中白金濃度測定値を用いて、レボホリナート及びフルオロウラシルとの併用の影響を検討した結果、中心コンパートメント分布容積に影響が認められた。
単独投与67例とレボホリナート及びフルオロウラシルとの併用投与18例を合わせた85例から得られた、計734点の限外ろ過血漿中白金濃度データについて、薬物動態パラメータに影響を及ぼしうる患者因子を組み込んだ3コンパートメントモデルに、レボホリナート及びフルオロウラシルとの併用の影響を組み込んだモデルにて解析した結果は次表のとおりであった。
結腸・直腸癌患者18例(レボホリナート及びフルオロウラシルの急速静脈内投与法との併用投与)から得られた108時点の限外ろ過血漿中白金濃度測定値を用いて、レボホリナート及びフルオロウラシルとの併用の影響を検討した結果、中心コンパートメント分布容積に影響が認められた。
単独投与67例とレボホリナート及びフルオロウラシルとの併用投与18例を合わせた85例から得られた、計734点の限外ろ過血漿中白金濃度データについて、薬物動態パラメータに影響を及ぼしうる患者因子を組み込んだ3コンパートメントモデルに、レボホリナート及びフルオロウラシルとの併用の影響を組み込んだモデルにて解析した結果は次表のとおりであった。
| CL(L/hr/m2) | 3.00+0.00827×CrCL | |
| 肝転移のある場合 | 1.13×CL | |
| 女性の場合 | 1.09×CL | |
| V1(L/m2) | 7.70 | |
| 65歳以上の場合 | 1.20×V1 | |
| レボホリナート及びフルオロウラシルを併用した場合 | 1.26×V1 | |
| Vss(L/m2) | 656(レボホリナート及びフルオロウラシル併用の場合658) | |
例えば、肝転移のない65歳未満の男性患者(想定CrCL=100mL/min)に85mg/m2でオキサリプラチンとレボホリナート及びフルオロウラシルを併用した場合、限外ろ過血漿中白金の薬物動態パラメータはCL=3.83(L/hr/m2)、V1=9.7(L/m2)、Vss=658(L/m2)、t1/2α=0.26(hr)、t1/2β=27.6(hr)、t1/2γ=392(hr)、Tmax=2.0(hr)、Cmax=931(ng/mL)、AUC=10.9(μg・hr/mL)と算出される。16)
16.3 分布
ラットに14C-標識体7mg/kgを単回静脈内投与し、投与後504時間まで経時的に組織内放射能濃度を測定した。投与後15分では腎の放射能濃度が最も高かった。各組織のT1/2は130時間以上であり、いずれも血漿のT1/2(約36時間)より長かった。17)
16.4 代謝
生体内におけるオキサリプラチンの活性体変換は非酵素的な物理化学的過程を経て起こる(生体内変換)。ヒトにおいてオキサリプラチンの血漿中主生体内変換体はジクロロ1,2-ジアミノシクロヘキサン(DACH)白金、モノアクオモノクロロDACH白金、ジアクオDACH白金であった。18)
16.5 排泄
16.5.1 日本人の固形癌患者6例にオキサリプラチン130mg/m2を2時間点滴投与した際の投与後24時間までの尿中排泄率は、全白金量33.9±8.8%(平均±標準偏差)であった。1)
16.5.2 消化器癌患者5例にオキサリプラチン130mg/m2を2時間点滴投与し、48時間後からフルオロウラシル300mg/m2/日を12週間点滴静注した際の投与後120時間までの尿中排泄率及び糞中排泄率は、それぞれ全白金量の53.8±9.1%及び2.1±1.9%(いずれも平均±標準偏差)であった(外国人データ)。19)
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
成人癌患者29例の腎機能を、クレアチニンクリアランスを指標として≧60mL/min、40〜59mL/min、20〜39mL/min、<20mL/minに分類した際の、オキサリプラチン単独投与時(60〜130mg/m2)注1)注2)限外ろ過血漿中白金のAUCは次表のとおりであった(外国人データ)。20)[9.2参照]
| クレアチニンクリアランス | 投与量 | 症例数 | AUC※(μg・hr/mL) |
| ≧60mL/min | 130mg/m2 | 11 | 16.4±5.02 |
| 40〜59mL/min | 105mg/m2 | 3 | 32.7±16.2 |
| 130mg/m2 | 6 | 39.7±11.5 | |
| 20〜39mL/min | 80mg/m2 | 1 | 29.5 |
| 105mg/m2 | 2 | 42.0±1.25 | |
| 130mg/m2 | 5 | 44.6±14.6 | |
| <20mL/min | 60mg/m2 | 1 | 32.2 |
注1)本剤の承認された1回用量は、85mg/m2(体表面積)又は130mg/m2(体表面積)である。
注2)本剤の用法及び用量は、他の抗悪性腫瘍剤との併用において承認されている。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<治癒切除不能な進行・再発の結腸・直腸癌>
17.1.1 国内第I/II相試験
化学療法未治療の進行・再発の結腸・直腸癌を対象とした第I/II相試験における併用療法(オキサリプラチン85mg/m2を第1、15日に、フルオロウラシル急速静脈内投与400mg/m2及びレボホリナート250mg/m2を第1、8、15日に投与し、13日間休薬する方法)の推奨投与量での有効性は次表のとおりであった。
| 奏効率(有効例/適格例) |
| 64.3%(9/14) |
17.1.2 国内第II相試験
フッ化ピリミジン系抗悪性腫瘍薬で治療抵抗性を示した進行・再発の結腸・直腸癌を対象とした第II相試験におけるオキサリプラチン単独療法(オキサリプラチン130mg/m2を点滴投与することを3週毎に繰り返す注1))の有効性は次表のとおりであった。
| 奏効率(有効例/適格例) | 生存期間中央値 |
| 8.8%(5/57) | 338日(11.1か月) |
安全性評価症例57例に認められた主な副作用は、末梢神経症状57例(100%)、食欲不振51例(89.5%)、悪心45例(78.9%)、嘔吐35例(61.4%)、血小板減少29例(50.9%)、AST上昇28例(49.1%)、疲労28例(49.1%)、白血球減少25例(43.9%)であった。2)21)[7.2参照]
注1)本剤の用法及び用量は、他の抗悪性腫瘍剤との併用において承認されている。
17.1.3 国内第I/II相試験
化学療法未治療の進行・再発の結腸・直腸癌を対象とした第I/II相試験におけるXELOX法注2)又はXELOX法+ベバシズマブ注3)の推奨投与量での有効性は次表のとおりであった。
| 投与レジメン | 奏効率(有効例/適格例) |
| XELOX法 | 66.7%(4/6) |
| XELOX法+ベバシズマブ | 71.9%(41/57) |
17.1.4 海外第III相試験
化学療法未治療の進行・再発の結腸・直腸癌を対象とした第III相試験におけるFOLFOX4法注4)の有効性は次表のとおりであった。
| 奏効率(有効例/適格例) | 無増悪生存期間中央値 | 生存期間中央値 |
| 45.2%(95/210) | 8.7か月 | 19.5か月 |
17.1.5 海外第III相試験
化学療法未治療の進行・再発の結腸・直腸癌を対象とした第III相試験におけるFOLFOX4法注4)の有効性は次表のとおりであった。
| 奏効率(有効例/適格例) | 無増悪生存期間中央値 | 生存期間中央値 |
| 50.0%(105/210) | 8.2か月 | 16.2か月 |
17.1.6 海外第III相試験
化学療法既治療の進行・再発の結腸・直腸癌を対象とした第III相試験におけるFOLFOX4法注4)の有効性は次表のとおりであった。
| 奏効率(有効例/適格例) | 無増悪生存期間中央値 | 生存期間中央値 |
| 9.9%(15/152) | 4.6か月 | − |
17.1.7 海外第III相試験
化学療法未治療の進行・再発の結腸・直腸癌を対象とした第III相試験におけるFOLFOX4法注4)とFOLFOX4法+プラセボの有効性は次表のとおりであった。
| 奏効率(有効例/適格例) | 無増悪生存期間中央値 | 生存期間中央値 |
| 49.0%(304/620) | 241.0日(7.9か月) | 565.0日(18.6か月) |
17.1.8 海外第III相試験
化学療法未治療の進行・再発の結腸・直腸癌を対象とした第III相試験におけるXELOX法注2)とXELOX法+プラセボの有効性は次表のとおりであった。
| 奏効率(有効例/適格例) | 無増悪生存期間中央値 | 生存期間中央値 |
| 47.0%(296/630) | 220.0日(7.2か月) | 572.0日(18.8か月) |
17.1.9 海外第III相試験
化学療法未治療の進行・再発の結腸・直腸癌を対象とした第III相試験におけるXELOX法+ベバシズマブ注3)の有効性は次表のとおりであった。
| 奏効率(有効例/適格例) | 無増悪生存期間中央値 | 生存期間中央値 |
| 45.7%(160/350) | 282.0日(9.3か月) | 650.0日(21.4か月) |
17.1.10 海外第III相試験
化学療法既治療の進行・再発の結腸・直腸癌を対象とした第III相試験におけるFOLFOX4法注4)の有効性は次表のとおりであった。
| 奏効率(有効例/適格例) | 無増悪生存期間中央値 | 生存期間中央値 |
| 20.2%(51/252) | 168.0日(5.5か月) | 402.0日(13.2か月) |
17.1.11 海外第III相試験
<結腸癌における術後補助療法>
17.1.12 海外第III相試験
原発巣治癒切除後のStageII又はIIIの結腸癌(直腸S状部癌を含む)を対象とした第III相試験におけるホリナート及びフルオロウラシルの静脈内持続投与法(LV5FU2法)並びにFOLFOX4法注4)(12サイクル)の有効性は次表のとおりであった。
| ITT解析対象(FOLFOX4法群/LV5FU2法群) | 3年無病生存率(主要評価項目) | 6年全生存率(副次的評価項目) | ||
| FOLFOX4法群 | LV5FU2法群 | FOLFOX4法群 | LV5FU2法群 | |
| 全例(1,123/1,123例) | 78.2% | 72.9% | 78.5% | 76.0% |
| P=0.002注5) | P=0.046注5) | |||
| StageIII(672/675例) | 72.2% | 65.3% | 72.9% | 68.7% |
| P=0.0052注5) | P=0.023注5) | |||
| StageII(451/448例) | 87.0% | 84.3% | 86.9% | 86.8% |
| P=0.2286注5) | P=0.986注5) | |||
17.1.13 海外第III相試験
原発巣治癒切除後のStageIIIの結腸癌(直腸S状部癌を含む)を対象とした第III相試験におけるホリナート及びフルオロウラシルの静脈内投与法(5-FU/LV法注6))並びにXELOX法注2)(8サイクル)の有効性は次表のとおりであった。
| ITT解析対象(XELOX法群/5-FU/LV法群) | 3年無病生存率(主要評価項目) | 5年全生存率(副次的評価項目) | ||
| XELOX法群 | 5-FU/LV法群 | XELOX法群 | 5-FU/LV法群 | |
| 全例(944/942例) | 71% | 67% | 78% | 74% |
| P=0.0045注5) | P=0.1486注5) | |||
XELOX法群において、安全性評価症例938例に認められた主な有害事象は、末梢神経症状649例(69%)、ヘモグロビン減少(貧血)645例(69%)、悪心625例(67%)、AST上昇581例(62%)、下痢577例(62%)、血中ブドウ糖上昇556例(59%)、血小板減少538例(57%)、白血球減少482例(51%)、好中球減少429例(46%)、嘔吐415例(44%)、ALT上昇411例(44%)であった。27)[5.1、5.2、7.1参照]
注6)ホリナート急速静脈内投与20mg/m2(体表面積)、フルオロウラシル急速静脈内投与425mg/m2(体表面積)をそれぞれ第1〜5日に投与することを4週毎に繰り返し、6サイクル行う。または、ホリナート静脈内点滴投与500mg/m2(体表面積)、フルオロウラシル急速静脈内投与500mg/m2(体表面積)をそれぞれ1〜6週の第1日に投与することを8週毎に繰り返す(4サイクル)。
<治癒切除不能な膵癌>
17.1.14 国内第II相試験
化学療法未治療の遠隔転移を有する膵癌を対象とした第II相試験におけるFOLFIRINOX法(1サイクルを2週間として第1日目に本剤85mg/m2、レボホリナート200mg/m2、イリノテカン塩酸塩水和物180mg/m2を点滴静注し、引き続きフルオロウラシル400mg/m2を急速静脈内投与、フルオロウラシル2,400mg/m2を46時間かけて持続静注)の有効性は次表のとおりであった。対象患者はECOG注7)Performance status 0及び1であった。2つの遺伝子多型(UGT1A1*6、UGT1A1*28)について、いずれかをホモ接合体(UGT1A1*6/*6、UGT1A1*28/*28)又はいずれもヘテロ接合体(UGT1A1*6/*28)としてもつ患者は除外された。また、1サイクル目の投与可能条件として、好中球数(2,000/mm3以上)、総ビリルビン値(施設基準値上限以下)等が設定された。
| 奏効率(有効例/適格例) |
| 38.9%(14/36) |
安全性評価症例36例中36例(100.0%)に副作用が認められた。主な副作用は、好中球減少34例(94.4%)、白血球減少33例(91.7%)、血小板減少32例(88.9%)、悪心32例(88.9%)、貧血31例(86.1%)、食欲不振31例(86.1%)、下痢30例(83.3%)、末梢神経症状27例(75.0%)、リンパ球減少24例(66.7%)、CRP上昇24例(66.7%)、脱毛24例(66.7%)、アルブミン減少23例(63.9%)、体重減少21例(58.3%)、AST上昇20例(55.6%)、ALT上昇20例(55.6%)、口内炎19例(52.8%)、便秘17例(47.2%)、味覚異常17例(47.2%)、LDH上昇16例(44.4%)、倦怠感16例(44.4%)、疲労15例(41.7%)、ナトリウム減少15例(41.7%)であった(承認時)。28)[5.3、7.1参照]
17.1.15 海外第II/III相試験
化学療法未治療の遠隔転移を有する膵癌を対象とした第II/III相試験におけるFOLFIRINOX法(1サイクルを2週間として第1日目に本剤85mg/m2、ホリナート400mg/m2、イリノテカン塩酸塩水和物180mg/m2を点滴静注し、引き続きフルオロウラシル400mg/m2を急速静脈内投与、フルオロウラシル2,400mg/m2を46時間かけて持続静注)とゲムシタビン塩酸塩(GEM)単独投与(GEM 1,000mg/m2の週1回点滴投与を7週連続し、8週目は休薬する。その後は、週1回点滴投与を3週連続し、4週目は休薬として、これを4週毎に繰り返す)の中間解析時の有効性は次表のとおりであった。対象患者はECOG注7)Performance status 0及び1であった。登録において2つの遺伝子多型(UGT1A1*6、UGT1A1*28)に関する基準は設定されなかった。また、登録時の選択基準として、好中球数(1,500/mm3以上)、総ビリルビン値(施設基準値上限の1.5倍以下)等が設定された。
| 投与群 | 例数(ITT) | 生存期間(主要評価項目) | |
| 中央値(月) | ハザード比 P値注5) | ||
| FOLFIRINOX法 | 127 | 10.5 | 0.62 P<0.001 |
| GEM単独投与 | 128 | 6.9 | |
FOLFIRINOX法群において、安全性評価症例167例のうち、有害事象が収集できなかった1例を除く166例中166例(100%)に有害事象が認められた。主な有害事象は、貧血150例(90.4%)、疲労144例(87.3%)注8)、γ-GTP増加139例(83.7%)、血中ALP増加137例(83.0%)注8)、好中球数減少131例(79.9%)注9)、悪心132例(79.5%)、血小板数減少124例(75.2%)注8)、下痢121例(73.3%)注8)、末梢性感覚ニューロパチー117例(70.5%)、ALT増加107例(64.8%)注8)、AST増加106例(64.6%)注9)、嘔吐102例(61.4%)、体重変動90例(54.2%)、食欲減退81例(48.8%)、便秘75例(45.2%)であった。29)30)[5.3、7.1参照]
注7)Eastern Cooperative Oncology Group。
注8)当該事象に関する安全性情報が収集できなかった1例を除く165例による集計。
注9)当該事象に関する安全性情報が収集できなかった2例を除く164例による集計。
<胃癌における術後補助療法>
17.1.16 海外第III相試験
原発巣治癒切除後のStageII、IIIの胃癌を対象とした第III相試験におけるXELOX法注2)(8サイクル)の有効性は次表のとおりであった。
| ITT解析対象(XELOX法群/経過観察群) | 3年無病生存率(主要評価項目) | 5年全生存率(副次的評価項目) | ||
| XELOX法群 | 経過観察群 | XELOX法群 | 経過観察群 | |
| 全例(520/515例) | 74% | 59% | 78% | 69% |
| ハザード比:0.56 P<0.0001注10) | ハザード比:0.66 P=0.0015注10) | |||
XELOX法群において、安全性評価症例496例中490例(99%)に有害事象が認められた。主な有害事象は、悪心326例(66%)、好中球減少症300例(60%)、食欲減退294例(59%)、末梢性ニューロパチー277例(56%)、下痢236例(48%)であった。31)32)[7.1参照]
注10)層別多変量Cox比例ハザードモデル。
注2)本剤130mg/m2(体表面積)を第1日に点滴投与し、カペシタビン1,000mg/m2を1日2回14日間連日経口投与することを3週毎に繰り返す。
注3)本剤130mg/m2(体表面積)、ベバシズマブ7.5mg/kg(体重)を第1日に点滴投与し、カペシタビン1,000mg/m2を1日2回14日間連日経口投与することを3週毎に繰り返す。
注4)本剤85mg/m2(体表面積)を第1日に、ホリナート200mg/m2(体表面積)、フルオロウラシル急速静脈内投与400mg/m2(体表面積)、フルオロウラシル静脈内持続投与600mg/m2(体表面積)をそれぞれ第1、2日に投与することを2週毎に繰り返す。
注5)log-rank検定。
18. 薬効薬理
18.1 作用機序
ヒトにおいてオキサリプラチンは、生体内変換体(ジクロロ1,2-ジアミノシクロヘキサン(DACH)白金、モノアクオモノクロロDACH白金、ジアクオDACH白金)を形成し、癌細胞内のDNA鎖と共有結合することでDNA鎖内及び鎖間の両者に白金−DNA架橋を形成する。これらの架橋がDNAの複製及び転写を阻害する。33)
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. オキサリプラチン
20. 取扱い上の注意
20.1 包装開封後もバイアルを箱に入れて保存すること。
20.2 15℃以下での保存は推奨されない。[14.1.1参照]
22. 包装
<オキサリプラチン点滴静注50mg「トーワ」>
10mL×1バイアル
<オキサリプラチン点滴静注100mg「トーワ」>
20mL×1バイアル
<オキサリプラチン点滴静注200mg「トーワ」>
40mL×1バイアル
23. 主要文献
- Shirao K,et al., Jpn J Clin Oncol., 36, 295-300, (2006) »PubMed
- Boku N,et al., Jpn J Clin Oncol., 37, 440-445, (2007) »PubMed
- Yamada Y,et al., Jpn J Clin Oncol., 36, 218-223, (2006) »PubMed
- 米国添付文書
- アレルギー反応(皮疹も含む)について(エルプラット注射用:2005年3月18日承認、審査報告書)
- Larzilliere I,et al., Am J Gastroenterol., 94, 3387-3388, (1999) »PubMed
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:オキサリプラチン(切除不能進行・再発胃癌)
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:オキサリプラチン(小腸癌)
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:オキサリプラチン(治癒切除不能な進行・再発の胃癌)
- 遺伝毒性試験(エルプラット注射用:2005年3月18日承認、申請資料概要2.6.6.4)
- 生殖発生毒性試験(エルプラット注射用:2005年3月18日承認、申請資料概要2.6.6.6)
- 乳汁中排泄(エルプラット注射用:2005年3月18日承認、申請資料概要2.6.4.6)
- Andre T,et al., N Engl J Med., 350, 2343-2351, (2004) »PubMed
- Andre T,et al., J Clin Oncol., 27, 3109-3116, (2009) »PubMed
- サル心毒性に関する試験(エルプラット注射用:2005年3月18日承認、申請資料概要2.4.2.2)
- 臨床薬理の概要(エルプラット注射用:2005年3月18日承認、申請資料概要2.7.2.2)
- 分布(エルプラット注射用:2005年3月18日承認、申請資料概要2.6.4.4)
- Graham MA,et al., Clin Cancer Res., 6, 1205-1218, (2000) »PubMed
- 生体内変換体の検討(エルプラット注射用:2005年3月18日承認、申請資料概要2.7.6.11)
- Takimoto CH,et al., J Clin Oncol., 21, 2664-2672, (2003) »PubMed
- 国内第II相試験(エルプラット注射用:2005年3月18日承認、申請資料概要2.7.6.2)
- Doi T,et al., Jpn J Clin Oncol., 40, 913-920, (2010) »PubMed
- Goldberg RM,et al., J Clin Oncol., 22, 23-30, (2004) »PubMed
- de Gramont A,et al., J Clin Oncol., 18, 2938-2947, (2000) »PubMed
- Rothenberg ML,et al., J Clin Oncol., 21, 2059-2069, (2003) »PubMed
- 臨床的有効性及び安全性に関する資料(エルプラット点滴静注液:2009年9月18日承認、審査報告書)
- Haller DG,et al., J Clin Oncol., 29, 1465-1471, (2011) »PubMed
- Okusaka T,et al., Cancer Sci., 105, 1321-1326, (2014) »PubMed
- Conroy T,et al., N Engl J Med., 364, 1817-1825, (2011) »PubMed
- 海外第II/III相試験(ACCORD11試験)(エルプラット点滴静注液:2013年12月20日承認、審査報告書)
- Bang YJ,et al., Lancet., 379, 315-321, (2012) »PubMed
- Noh SH,et al., Lancet Oncol., 15, 1389-1396, (2014) »PubMed
- 薬効薬理試験(エルプラット注射用:2005年3月18日承認、申請資料概要2.6.2.6)
- 効力を裏付ける試験(エルプラット注射用:2005年3月18日承認、申請資料概要2.6.2.2)
- 効力を裏付ける試験(エルプラット点滴静注液:2013年12月20日承認、審査報告書)
- 効力を裏付ける試験(エルプラット点滴静注液:2015年11月20日承認、審査報告書)
24. 文献請求先及び問い合わせ先
文献請求先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
製品情報問い合わせ先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
26. 製造販売業者等
26.1 製造販売元
東和薬品株式会社
大阪府門真市新橋町2番11号