医薬品情報
| 総称名 | デュアック |
|---|---|
| 一般名 | クリンダマイシンリン酸エステル水和物 過酸化ベンゾイル |
| 欧文一般名 | Clindamycin Phosphate Hydrate Benzoyl Peroxide |
| 製剤名 | クリンダマイシン1%−過酸化ベンゾイル3%ゲル |
| 薬効分類名 | 尋常性ざ瘡治療配合剤 |
| 薬効分類番号 | 2699 |
| ATCコード | D10AE51 D10AF51 |
| KEGG DRUG |
D10602
クリンダマイシンリン酸エステル・過酸化ベンゾイル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| デュアック配合ゲル | Duac Combination Gel | サンファーマ | 2699803Q1020 | 99.5円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分又はリンコマイシン系抗生物質に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
結節及び嚢腫には、他の適切な処置を行うこと。
6. 用法及び用量
1日1回、洗顔後、患部に適量を塗布する。
7. 用法及び用量に関連する注意
本剤の使用にあたっては、12週間で効果が認められない場合には使用を中止すること。また、炎症性皮疹が消失した場合には、他の適切な維持治療を検討すること。なお、本剤を12週間を超えて塗布した際の有効性及び安全性は検討されていないため、12週間を超えて塗布する際はその必要性を慎重に判断すること。
8. 重要な基本的注意
8.1 過度に塗布しても上乗せ効果は期待されず、皮膚刺激が増すおそれがあるので注意すること。
8.2 本剤の使用中に皮膚剥脱、紅斑、刺激感、腫脹等があらわれることがある。紅斑や腫脹が顔面全体や頚部にまで及ぶ症例、水疱、びらん等があらわれ、重症化した症例も報告されているので、観察を十分に行い、異常が認められた場合には本剤の使用を中止するなど適切な処置を行うこと。
8.3 全身性の過敏反応や重度の皮膚刺激症状が認められた場合には本剤の使用を中止すること。
8.4 本剤の使用中は日光への曝露を最小限にとどめ、日焼けランプの使用や紫外線療法は避けること。
8.5 本剤の使用にあたっては、耐性菌の発現等を防ぐため、疾病の治療上必要な最小限の期間の使用にとどめること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 抗生物質に関連した下痢又は大腸炎の既往歴のある患者
偽膜性大腸炎等の重篤な大腸炎があらわれるおそれがある。[11.1.1参照]
9.1.2 アトピー性体質の患者
重症の即時型アレルギー反応があらわれるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中への移行は不明である。
9.7 小児等
低出生体重児、新生児、乳児、幼児又は12歳未満の小児を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| エリスロマイシン含有製剤 | 本剤の効果が減弱する可能性がある。 | クリンダマイシンの作用と拮抗する可能性がある。 |
| 末梢性筋弛緩剤 スキサメトニウム塩化物水和物 ツボクラリン塩化物塩酸塩水和物 等 | 神経筋遮断作用が増強する可能性がある。 | クリンダマイシンは神経筋遮断作用を有する。 |
| 外用スルホンアミド製剤 スルファジアジン スルフィソミジン等 | 同一部位に重ねて塗布した場合、皮膚及び顔毛に一過性の変色(黄色又は橙色)を呈する可能性がある。 | 機序は不明であるが、過酸化ベンゾイルによる反応と考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 大腸炎
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 消化器 | − | − | 下痢、腹痛 |
| 皮膚 | 乾燥、皮膚炎(接触皮膚炎、湿疹を含む)、皮膚剥脱、紅斑、適用部位反応(疼痛、皮膚刺激、発赤、変色を含む)、そう痒症 | 灼熱感、蕁麻疹、ざ瘡悪化 | 光線過敏性反応、紅斑性皮疹、錯感覚、つっぱり感、グラム陰性菌毛嚢炎、脂性肌、腫脹、水疱、びらん |
| 肝臓 | − | − | AST、ALT、Al-P、総ビリルビンの上昇、ウロビリノーゲン陽性 |
| その他 | − | 過敏症 | 頭痛、白血球増加、血小板増加、総コレステロール低下、尿蛋白、尿糖 |
13. 過量投与
13.1 症状
重度の皮膚刺激感があらわれる可能性がある。過酸化ベンゾイルの外用により全身性の作用の発現に至る量は吸収される可能性が低い。一方、クリンダマイシンの過量の外用により全身性の作用の発現に至る量が吸収される可能性がある。
14. 適用上の注意
14.1 薬剤使用時の注意
14.1.1 他のざ瘡治療外用剤と併用する場合には、刺激感が増すおそれがあるので注意すること。
14.1.2 本剤は、毛髪や着色・染色された布織物を退色させるおそれがあるため、毛髪、布織物、家具及び絨毯に付着させないこと。
14.1.3 外用としてのみ使用すること。口腔、眼、口唇、その他の粘膜、刺激及び傷のある皮膚には使用しないこと。これらの部位に本剤が付着した場合は水で洗い流すこと。
14.1.4 誤飲により、クリンダマイシンを全身性に投与した場合と同様の消化器系の副作用が発現する可能性がある。そのような場合には対症療法を行い患者の状態を慎重に観察すること。[11.1.1参照]
15. その他の注意
15.1 臨床使用に基づく情報
過酸化ベンゾイルとトレチノインを混合すると、トレチノインが分解されるとの報告がある1)ため、本剤とトレチノインを同一部位に塗布した場合、トレチノインの効果が減弱する可能性がある。
15.2 非臨床試験に基づく情報
ヘアレスマウスを用いた1年間光がん原性試験で紫外線照射と2500mg/kg/日(7500mg/m2/日)までのクリンダマイシン1%−過酸化ベンゾイル5%ゲルを経皮投与した結果、紫外線照射単独群と比べ皮膚腫瘍発現時間の軽度短縮が認められた。
16. 薬物動態
16.1 血中濃度
16.1.1 クリンダマイシン(日本人における成績)
健康成人男性(6例)の背部皮膚にクリンダマイシン(CLDM)リン酸エステルゲル1% 2gを単回塗布したときの血漿中CLDM濃度は多くの被験者で定量限界(13.2pg/mL)以下であった。また、CLDMリン酸エステルゲル1% 2gを12時間毎に9回反復塗布したときの塗布後12時間の血漿中CLDM濃度は3回塗布でほぼ一定となり、最終塗布後のCmaxは平均161.3pg/mLであった2)。
16.1.2 クリンダマイシン(外国人における成績)
中等度から重度の尋常性ざ瘡患者(77例)の顔面にCLDMリン酸エステル1%−過酸化ベンゾイル(BPO)5%ゲル1gを1日1回及びCLDMリン酸エステルローション1% 0.5gを1日2回それぞれ4週間塗布したときの血漿中CLDM及びその代謝物であるS-酸化体の濃度を表-1に示す。
| CLDMリン酸エステル1%−BPO5% | CLDMリン酸エステルローション1% | |||
| CLDM(pg/mL) | S-酸化体(pg/mL) | CLDM(pg/mL) | S-酸化体(pg/mL) | |
| 塗布後1〜4週 | 439.2±574.2(39) | 93.3±93.1(39) | 386.0±398.9(37) | 77.4±88.5(37) |
| 最終塗布後96時間 | 67.8±223.3(35) | 13.4±36.9(36) | 73.0±226.2(30) | 44.5±51.3(30) |
中等度から重度の尋常性ざ瘡患者(24例)の顔面、上胸部、上背部、肩に本剤約4gを1日1回5日間塗布したときのCLDM及びS-酸化体の薬物動態パラメータを表-2に示す3)。
| パラメータ | CLDM(24例) | S-酸化体(23例) |
| Cmax(pg/mL) | 1294.2±1011.3 | 220.0±139.1 |
| tmax(hr) | 5.8±2.68 | 7.9±3.47 |
| AUC(0-t)(pg・h/mL) | 17786.3±14769.4 | 3956.5±2860.3 |
16.1.3 過酸化ベンゾイル(日本人における成績)
尋常性ざ瘡患者の顔面に本剤約0.7gを1日2回7日間塗布したときの血漿中安息香酸濃度は12例中2例で定量可能(定量下限:100ng/mL)であった。塗布前及び反復塗布後の血漿中馬尿酸濃度は、それぞれ46.7〜84.8ng/mL及び38.2〜100.3ng/mLであった。
16.2 吸収
16.2.1 クリンダマイシンリン酸エステル水和物
In vitroにおいて、ヒト皮膚に本剤15.63mg/cm2を塗布したとき、安息香酸、CLDMリン酸エステル又はCLDMとして塗布6時間後までに経時的に皮膚を透過したが、BPOとしての皮膚透過は確認されなかった4)。
16.2.2 過酸化ベンゾイル
In vitroにおいて、ヒト皮膚に14C-BPO4556μgを塗布したときの塗布後8時間には安息香酸として真皮側から1.9%が回収された。皮膚中には塗布量の2.6%(BPO及び安息香酸がおおむね同量)が、皮膚表面には95.5%(BPO)が残った5)。
16.4 代謝
16.4.1 クリンダマイシン
16.5 排泄
16.5.1 クリンダマイシン(日本人における成績)
健康成人男性(6例)の背部皮膚にCLDMリン酸エステルゲル1% 2gを単回塗布及び12時間毎に9回反復塗布したとき、CLDMの尿中排泄率は単回及び反復塗布のいずれにおいても塗布量の0.01%以下であった2)。
16.5.2 クリンダマイシン(外国人における成績)
中等度から重度の尋常性ざ瘡患者(77例)の顔面にCLDMリン酸エステル1%−BPO5%ゲル1gを1日1回及びCLDMリン酸エステルローション1% 0.5gを1日2回それぞれ4週間塗布したとき、CLDMリン酸エステル1%−BPO5%ゲルの最終投与後24時間における尿中排泄量はCLDM及びS-酸化体でそれぞれ5.8及び5.4μgとCLDMリン酸エステルローション1%塗布時と同程度であった3)。
16.5.3 過酸化ベンゾイル(日本人における成績)
尋常性ざ瘡患者の顔面に本剤約0.7gを1日2回7日間塗布したとき、尿中安息香酸濃度は12例中3例で定量可能(定量下限:100ng/mL)であり、塗布前及び反復塗布後の尿中馬尿酸濃度は、それぞれ36.0〜42.4μg/mL及び53.7〜55.6μg/mLであった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
日本人の尋常性ざ瘡患者を対象に、本剤を1日1回又は1日2回、12週間、顔面に塗布時の有効性及び安全性を検討することを目的として実施した無作為化単盲検並行群間比較試験(対照:CLDM1%ゲル)の結果は、以下のとおりであった注)。
副作用発現率は、本剤1日1回群204例中49例(24.0%)、本剤1日2回群296例中104例(35.1%)であった。主な副作用は本剤1日1回群で皮膚乾燥15例(7.4%)、接触性皮膚炎11例(5.4%)、そう痒症9例(4.4%)、顔面痛9例(4.4%)紅斑8例(3.9%)、灼熱感6例(2.9%)、皮膚剥脱4例(2.0%)、剥脱性皮膚炎4例(2.0%)等、本剤1日2回群で皮膚乾燥34例(11.5%)、皮膚剥脱25例(8.4%)、接触性皮膚炎23例(7.8%)、紅斑21例(7.1%)、そう痒症17例(5.7%)、灼熱感12例(4.1%)、顔面痛9例(3.0%)、皮膚刺激8例(2.7%)、剥脱性皮膚炎6例(2.0%)等であった。
副作用発現率は、本剤1日1回群204例中49例(24.0%)、本剤1日2回群296例中104例(35.1%)であった。主な副作用は本剤1日1回群で皮膚乾燥15例(7.4%)、接触性皮膚炎11例(5.4%)、そう痒症9例(4.4%)、顔面痛9例(4.4%)紅斑8例(3.9%)、灼熱感6例(2.9%)、皮膚剥脱4例(2.0%)、剥脱性皮膚炎4例(2.0%)等、本剤1日2回群で皮膚乾燥34例(11.5%)、皮膚剥脱25例(8.4%)、接触性皮膚炎23例(7.8%)、紅斑21例(7.1%)、そう痒症17例(5.7%)、灼熱感12例(4.1%)、顔面痛9例(3.0%)、皮膚刺激8例(2.7%)、剥脱性皮膚炎6例(2.0%)等であった。
| 本剤1日1回群 | 本剤1日2回群 | CLDM1%1日2回群 | |
| ベースライン | 76.3±30.05(204) | 80.2±36.05(296) | 79.6±37.76(299) |
| 塗布12週後 | 20.7±24.35(201) | 19.8±20.73(289) | 30.6±36.22(299) |
| 変化量 | −55.1±29.59(201) | −60.4±34.58(289) | −48.9±34.92(299) |
| CLDM1%1日2回群との群間差[95%信頼区間]a) | −8.2[−12.9,−3.6] | −11.0[−15.0,−7.0] | / |
| p値a) | − | P<0.001 |
注)本剤の承認用法・用量は1日1回投与である。
18. 薬効薬理
18.1 作用機序
18.1.1 クリンダマイシン
感受性菌のリボソーム50Sサブユニットに結合し、ペプチド転移酵素反応を阻害して蛋白合成を阻害することにより、細菌の増殖を抑制する。
18.1.2 過酸化ベンゾイル
18.2 薬理作用
18.2.1 クリンダマイシン
クリンダマイシンリン酸エステルは生体内で加水分解され、クリンダマイシンとして尋常性ざ瘡の原因菌であるアクネ菌に対して抗菌活性を示す。また、アクネ菌のリパーゼ産生を抑制し、皮脂中の遊離脂肪酸を低下させ、白血球の遊走を抑制することで抗炎症作用を示す。
18.2.2 過酸化ベンゾイル
18.3 交差耐性
18.3.1 クリンダマイシン
クリンダマイシンはエリスロマイシン等のマクロライド系抗菌薬との間で交差耐性が報告されている11)。エリスロマイシンによる耐性誘導によってクリンダマイシンに耐性を示すこともある。
19. 有効成分に関する理化学的知見
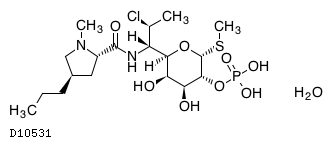
19.1. クリンダマイシンリン酸エステル水和物
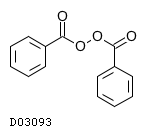
19.2. 過酸化ベンゾイル
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
チューブ
10g×10本
23. 主要文献
- Martin B,et al., Br J Dermatol, 139 (52), 8-11, (1998)
- 原田昭太郎, 臨床医薬, 15 (4), 567-582, (1999)
- 社内資料:薬物動態試験、バイオアベイラビリティ試験(2015年3月26日承認、CTD2.7.2.2.2)
- 社内資料:皮膚透過性試験(2015年3月26日承認、CTD2.6.4.4.1)
- Nacht S,et al., J Am Acad Dermatol, 4 (1), 31-37, (1981) »PubMed
- Flaherty JF,et al., Antimicrob Agents Chemother, 32 (12), 1825-1829, (1988) »PubMed
- Plaisance KI,et al., Antimicrob Agents Chemother, 33 (5), 618-620, (1989) »PubMed
- Amr S,et al., J Appl Microbiol, 90 (4), 550-554, (2001) »PubMed
- Wynalda MA,et al., Drug Metab Dispos, 31 (7), 878-887, (2003) »PubMed
- Cove JH,et al., J Appl Bacteriol, 54 (3), 379-382, (1983) »PubMed
- Eady EA,et al., Br J Dermatol, 121 (1), 51-57, (1989) »PubMed
- Decker LC,et al., Antimicrob Agents Chemother, 33 (3), 326-330, (1989) »PubMed
- Pannu J,et al., Antimicrob Agents Chemother, 55 (9), 4211-4217, (2011) »PubMed
- Eady EA,et al., Br J Dermatol, 131 (3), 331-336, (1994) »PubMed
- Hegemann L,et al., Br J Dermatol, 130 (5), 569-575, (1994) »PubMed
- Loux JJ,et al., J Soc Cosmet Chem, 25, 473-479, (1974)
- Mills OHJr,et al., Animal Models in Dermatology, 176-183, (1975)
24. 文献請求先及び問い合わせ先
文献請求先
サンファーマ株式会社
くすり相談センター
〒105-0011
東京都港区芝公園1-7-6
電話:0120-22-6880 受付時間:9時〜17時(土、日、祝日、その他当社の休業日を除く)
製品情報問い合わせ先
サンファーマ株式会社
くすり相談センター
〒105-0011
東京都港区芝公園1-7-6
電話:0120-22-6880 受付時間:9時〜17時(土、日、祝日、その他当社の休業日を除く)
26. 製造販売業者等
26.1 製造販売元(輸入)
サンファーマ株式会社
東京都港区芝公園1-7-6