医薬品情報
| 総称名 | アマルエット |
|---|---|
| 一般名 | アムロジピンベシル酸塩 アトルバスタチンカルシウム水和物 |
| 欧文一般名 | Amlodipine Besilate Atorvastatin Calcium Hydrate |
| 製剤名 | アムロジピンベシル酸塩・アトルバスタチンカルシウム水和物配合剤 |
| 薬効分類名 | 持続性Ca拮抗薬 HMG-CoA還元酵素阻害剤 |
| 薬効分類番号 | 2190 |
| ATCコード | C10BX03 |
| KEGG DRUG |
D08488
アムロジピンベシル酸塩・アトルバスタチンカルシウム
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アマルエット配合錠1番「トーワ」 (後発品) | AMALUET COMBINATION TABLETS NO.1"TOWA" | 東和薬品 | 2190101F1101 | 11.6円/錠 | 劇薬, 処方箋医薬品注) |
| アマルエット配合錠2番「トーワ」 (後発品) | AMALUET COMBINATION TABLETS NO.2"TOWA" | 東和薬品 | 2190102F1106 | 18.8円/錠 | 劇薬, 処方箋医薬品注) |
| アマルエット配合錠3番「トーワ」 (後発品) | AMALUET COMBINATION TABLETS NO.3"TOWA" | 東和薬品 | 2190103F1100 | 14円/錠 | 劇薬, 処方箋医薬品注) |
| アマルエット配合錠4番「トーワ」 (後発品) | AMALUET COMBINATION TABLETS NO.4"TOWA" | 東和薬品 | 2190104F1105 | 20.4円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
本剤(アムロジピン・アトルバスタチン配合剤)は、アムロジピン及びアトルバスタチンによる治療が適切である以下の患者に使用する。
5. 効能または効果に関連する注意
5.1 原則として、アムロジピン及びアトルバスタチンを併用、あるいはいずれか一方を使用している場合に、本剤の使用を検討すること。なお、両有効成分のいずれか一方を服用している患者に本剤を使用する場合は、患者の状態を十分に考慮した上で、各単剤の併用よりも本剤の投与が適切であるか慎重に判断すること。
5.2 アムロジピンは効果発現が緩徐であるため、本剤は緊急な治療を要する不安定狭心症には効果が期待できない。
5.3 適用の前に十分な検査を実施し、高コレステロール血症、家族性高コレステロール血症であることを確認した上で本剤の適用を考慮すること。
5.4 家族性高コレステロール血症ホモ接合体については、LDL-アフェレーシス等の非薬物療法の補助として、あるいはそれらの治療法が実施不能な場合に本剤の適用を考慮すること。
6. 用法及び用量
本剤(アムロジピン・アトルバスタチン配合剤)は、1日1回経口投与する。なお、以下のアムロジピンとアトルバスタチンの用法・用量に基づき、患者毎に用量を決めること。
・アムロジピン
<高血圧症>
通常、成人にはアムロジピンとして2.5〜5mgを1日1回経口投与する。なお、症状に応じ適宜増減するが、効果不十分な場合には1日1回10mgまで増量することができる。
<狭心症>
通常、成人にはアムロジピンとして5mgを1日1回経口投与する。なお、症状に応じ適宜増減する。
・アトルバスタチン
<高コレステロール血症>
通常、成人にはアトルバスタチンとして10mgを1日1回経口投与する。
なお、年齢、症状により適宜増減するが、重症の場合は1日20mgまで増量できる。
なお、年齢、症状により適宜増減するが、重症の場合は1日20mgまで増量できる。
<家族性高コレステロール血症>
通常、成人にはアトルバスタチンとして10mgを1日1回経口投与する。
なお、年齢、症状により適宜増減するが、重症の場合は1日40mgまで増量できる。
なお、年齢、症状により適宜増減するが、重症の場合は1日40mgまで増量できる。
7. 用法及び用量に関連する注意
本剤(アムロジピン・アトルバスタチン配合剤)は次の4製剤がある。
1番:アムロジピン2.5mg/アトルバスタチン5mg
2番:アムロジピン2.5mg/アトルバスタチン10mg
3番:アムロジピン5mg/アトルバスタチン5mg
4番:アムロジピン5mg/アトルバスタチン10mg
上記配合用量以外の用量を投与する場合は、個別のアムロジピン製剤又はアトルバスタチン製剤を用いることができるが、それぞれの成分の用法・用量の範囲内で投与すること。
8. 重要な基本的注意
8.1 本剤は、アムロジピン2.5mgあるいは5mgとアトルバスタチン5mgあるいは10mgとの配合剤であり、アムロジピンとアトルバスタチン双方の副作用が発現するおそれがあることに留意すること。[11.参照]
8.2 アムロジピンの降圧作用に基づくめまい等があらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.3 アムロジピンは血中濃度半減期が長く投与中止後も緩徐な降圧効果が認められるので、本剤投与中止後に他の降圧剤を使用するときは、用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
8.4 あらかじめ高コレステロール血症治療の基本である食事療法を行い、更に運動療法や高血圧、喫煙等の虚血性心疾患のリスクファクターの軽減等も十分考慮すること。
8.5 投与中は血中脂質値を定期的に検査し、治療に対する反応が認められない場合には投与を中止すること。
8.6 アトルバスタチン投与により劇症肝炎等の肝炎があらわれることがあるので、悪心・嘔吐、倦怠感等の症状があらわれた場合には本剤を中止し、医師等に連絡するよう患者に指導すること。投与中は投与開始又は増量時より12週までの間に1回以上、それ以降は定期的(半年に1回等)に肝機能検査を行うこと。[11.1.7参照]
8.7 アトルバスタチン投与により無顆粒球症、汎血球減少症、血小板減少症があらわれることがあるので、定期的に検査を行うなど十分な観察を行うこと。[11.1.9参照]
8.8 アトルバスタチン投与により高血糖、糖尿病があらわれることがあるので、口渇、頻尿、全身倦怠感等の症状の発現に注意するとともに、定期的に検査を行うなど十分な観察を行うこと。[11.1.11参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 過度に血圧の低い患者
アムロジピン投与により、さらに血圧が低下するおそれがある。
9.1.2 糖尿病の患者
アトルバスタチン投与により、糖尿病を悪化させることがある。
9.1.3 横紋筋融解症があらわれやすいとの報告がある以下の患者
9.1.4 重症筋無力症又はその既往歴のある患者
アトルバスタチン投与により重症筋無力症(眼筋型、全身型)が悪化又は再発することがある。[11.1.13参照]
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
アムロジピンによる降圧に伴い腎機能が低下することがある。
9.2.2 腎障害又はその既往歴のある患者
アトルバスタチン投与による横紋筋融解症の報告例の多くが腎機能障害を有する患者であり、また、横紋筋融解症に伴って急激な腎機能の悪化が認められている。[11.1.5参照]
9.2.3 腎機能検査値異常のある患者
9.3 肝機能障害患者
9.3.1 肝代謝能が低下していると考えられる以下のような患者
急性肝炎、慢性肝炎の急性増悪、肝硬変、肝癌、黄疸
9.3.2 肝機能障害患者
増量時には慎重に投与すること。アムロジピン高用量(10mg)において副作用の発現率が高まる可能性がある。本剤は主に肝で代謝されるため、血中濃度半減期の延長及び血中濃度−時間曲線下面積(AUC)が増大することがある。[16.6.2参照]
9.3.3 肝障害又はその既往歴のある患者(9.3.1に該当する患者を除く)
アトルバスタチンは主に肝臓において作用し代謝されるので、肝障害を悪化させるおそれがある。[16.6.2参照]
9.5 妊婦
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
アトルバスタチンは、主として肝の薬物代謝酵素CYP3A4により代謝される。また、P-糖蛋白質(P-gp)、乳癌耐性蛋白(BCRP)、有機アニオントランスポーター(OATP)1B1/1B3の基質である。アムロジピンの代謝には主として薬物代謝酵素CYP3A4が関与していると考えられている。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
P-糖蛋白質(P-gp)
薬物代謝酵素用語
乳癌耐性蛋白(BCRP)
薬物代謝酵素用語
有機アニオントランスポーター(OATP)1B1
薬物代謝酵素用語
有機アニオントランスポーター(OATP)1B3
10.1 併用禁忌
| グレカプレビル・ピブレンタスビル (マヴィレット) [2.4参照] | グレカプレビル・ピブレンタスビル(400mg・120mg)との併用により、アトルバスタチンのAUCが8.28倍、Cmaxが22.0倍に上昇したとの報告がある。本剤の血中濃度が上昇し、副作用が発現しやすくなるおそれがある。 | 機序:グレカプレビルのOATP1B1/1B3及びBCRP阻害、ピブレンタスビルのOATP1B1及びBCRP阻害に基づく作用によるものと考えられている。 |
10.2 併用注意
| 降圧作用を有する薬剤 | 降圧作用が増強されるおそれがある。 | 相互に作用を増強するおそれがある。 |
| CYP3A4阻害剤 エリスロマイシン ジルチアゼム リトナビル ニルマトレルビル・リトナビル イトラコナゾール等 | エリスロマイシン及びジルチアゼムとの併用により、アムロジピンの血中濃度が上昇したとの報告がある。 | アムロジピンの代謝が競合的に阻害される可能性が考えられる。 |
| CYP3A4誘導剤 リファンピシン等 | アムロジピンの血中濃度が低下するおそれがある。 | アムロジピンの代謝が促進される可能性が考えられる。 |
| グレープフルーツジュース | アムロジピンの降圧作用が増強されるおそれがある。 | グレープフルーツに含まれる成分がアムロジピンの代謝を阻害し、アムロジピンの血中濃度が上昇する可能性が考えられる。 |
| タクロリムス | 併用によりタクロリムスの血中濃度が上昇し、腎障害等のタクロリムスの副作用が発現するおそれがある。併用時にはタクロリムスの血中濃度をモニターし、必要に応じてタクロリムスの用量を調整すること。 | アムロジピンとタクロリムスは、主としてCYP3A4により代謝されるため、併用によりタクロリムスの代謝が阻害される可能性が考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。[8.1参照]
<アムロジピン>
11.1.1 劇症肝炎(頻度不明)、肝機能障害(0.1%未満)、黄疸(0.1%未満)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害があらわれることがある。
11.1.2 無顆粒球症(頻度不明)、白血球減少(0.1%未満)、血小板減少(頻度不明)
11.1.3 房室ブロック(0.1%未満)
徐脈、めまい等があらわれることがある。
11.1.4 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があらわれた場合には、投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
<アトルバスタチン>
11.1.5 横紋筋融解症(頻度不明)、ミオパチー(頻度不明)
11.1.6 免疫介在性壊死性ミオパチー(頻度不明)
近位筋脱力、CK高値、炎症を伴わない筋線維の壊死、抗HMG-CoA還元酵素(HMGCR)抗体陽性等を特徴とする免疫介在性壊死性ミオパチーがあらわれ、投与中止後も持続する例が報告されているので、患者の状態を十分に観察すること。なお、免疫抑制剤投与により改善がみられたとの報告例がある。
11.1.7 劇症肝炎(頻度不明)、肝炎(頻度不明)、肝機能障害(0.1%未満)、黄疸(頻度不明)[8.6参照]
11.1.8 過敏症(頻度不明)
血管神経性浮腫、アナフィラキシー反応、蕁麻疹を含む過敏症状があらわれたとの報告がある。
11.1.9 無顆粒球症(頻度不明)、汎血球減少症(頻度不明)、血小板減少症(頻度不明)[8.7参照]
11.1.10 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、多形紅斑(頻度不明)
水疱性発疹があらわれたとの報告がある。
11.1.11 高血糖(0.1%未満)、糖尿病(頻度不明)[8.8参照]
11.1.12 間質性肺炎(頻度不明)
長期投与であっても、発熱、咳嗽、呼吸困難、胸部X線異常等が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.13 重症筋無力症(頻度不明)
重症筋無力症(眼筋型、全身型)が発症又は悪化することがある。[9.1.4参照]
11.2 その他の副作用
| 1%〜2%未満a) | 1%未満a) | 頻度不明b) | |
| 過敏症 | そう痒 | 光線過敏、発疹、多形紅斑、蕁麻疹、血管炎、血管浮腫 | |
| 皮膚 | 脱毛、帯状疱疹、発赤、皮膚変色、皮膚乾燥、皮膚亀裂、多汗、爪の障害 | ||
| 血液 | 好酸球増加 | 血小板減少、白血球減少、白血球増加、貧血、紫斑 | |
| 肝臓 | 肝機能障害 | Al-P上昇、ALT上昇 | AST上昇、γ-GTP上昇、LDH上昇、黄疸、腹水 |
| 消化器 | 歯肉障害、膵炎、胃炎、胃食道逆流性疾患、胃不快感、腹部膨満、過敏性腸症候群、嘔気・嘔吐、便秘 | 口内炎、舌痛、舌炎、舌のしびれ、口のしびれ、口唇炎、口渇、(連用により)歯肉肥厚、消化不良、アミラーゼ上昇、食欲不振、腹痛、下痢・軟便、排便回数増加、胃腸炎 | |
| 呼吸器 | 咳、呼吸困難、咽頭不快感、肺炎、鼻炎、鼻出血 | ||
| 筋骨格系 | 筋肉痛 | CK上昇、血中ミオグロビン上昇、無力症、筋痙攣、筋緊張亢進、筋炎、関節痛、背部痛、腱炎、腱痛 | |
| 感覚器 | 視力異常、霧視、耳鳴、味覚異常 | ||
| 精神・神経系 | 頭痛、眩暈・ふらつき | 片頭痛、不眠症 | 振戦、眠気、気分動揺、末梢神経障害、健忘症、抑うつ、悪夢、錐体外路症状 |
| 内分泌 | 甲状腺腫 | テストステロン低下、コリンエステラーゼ上昇、TSH上昇、ACTH上昇、アルドステロン低下、女性化乳房 | |
| 代謝異常 | 血清コレステロール上昇、HbA1C上昇、高血糖、糖尿病、尿中ブドウ糖陽性、低血糖症、血清鉄低下 | ||
| 循環器 | 動悸 | 浮腫c)、ほてり(熱感、顔面潮紅等)、期外収縮、血圧上昇 | 洞房又は房室ブロック、洞停止、心房細動、頻脈、徐脈、血圧低下、失神 |
| 腎臓・泌尿器 | BUN上昇、クレアチニン上昇、血中カリウム増加、血中カリウム減少、頻尿・夜間頻尿、排尿困難、勃起障害、尿管結石、尿潜血陽性、尿中蛋白陽性 | ||
| その他 | 脳梗塞、全身倦怠感、脱力感、疲労、しびれ、発熱、体重増加、体重減少、疼痛、異常感覚、胸痛、着色尿 |
13. 過量投与
13.1 症状
アムロジピンの過量投与において、過度の末梢血管拡張により、ショックを含む著しい血圧低下と反射性頻脈を起こすことがある。
13.2 処置
特異的な解毒薬はない。アムロジピンは蛋白結合率が高いため、透析による除去は有効ではない。
また、アムロジピン服用直後に活性炭を投与した場合、アムロジピンのAUCは99%減少し、服用2時間後では49%減少したことから、アムロジピン過量投与時の吸収抑制処置として活性炭投与が有効であると報告されている4)。
また、アムロジピン服用直後に活性炭を投与した場合、アムロジピンのAUCは99%減少し、服用2時間後では49%減少したことから、アムロジピン過量投与時の吸収抑制処置として活性炭投与が有効であると報告されている4)。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
因果関係は明らかでないが、アムロジピンによる治療中に心筋梗塞や不整脈(心室性頻拍を含む)がみられたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 アムロジピン・アトルバスタチン配合剤の成績
(1)健康成人16例ずつにアムロジピン・アトルバスタチン配合剤(アムロジピン2.5mg/アトルバスタチン5mg又はアムロジピン5mg/アトルバスタチン10mg;以下、配合剤)をそれぞれ空腹時に単回投与したときのアムロジピン、アトルバスタチン未変化体及び主代謝物であるアミド結合位置のベンゼン環の2位の水酸化体(M-2)の血漿中薬物動態パラメータを表に示した。アムロジピン及びアトルバスタチンのCmax及びAUCは投与量に応じて増加し、両薬剤のTmax及びアムロジピンのT1/2は投与量に依存せず同様の値を示した。健康成人16例に配合剤(アムロジピン5mg/アトルバスタチン10mg)を空腹時及び食後に単回投与した結果、アムロジピンの薬物動態に食事による大きな影響は認められず、アトルバスタチンのCmaxは食事により低下するもののAUCは影響を受けなかった。なお、日本人と外国人において配合剤投与時のアムロジピン及びアトルバスタチンの薬物動態を比較した結果、両薬剤の薬物動態に民族差は認められなかった。5)
| 配合剤投与量 | 薬物名 | Cmax(ng/mL) | Tmax(h) | AUC0-Tlast(ng・h/mL) | T1/2(h) |
| 2.5mg/5mg (N=16) | アムロジピン | 1.46±0.347 | 6.3±1.2 | 55.4±19.9 | 43.5±10.6 |
| アトルバスタチン | 1.42±0.708 | 1.0±1.4 | 9.51±4.77 | NC | |
| M-2 | 0.568±0.295 | 5.5±3.1 | 9.11±4.67 | NC | |
| 5mg/10mg (N=16) | アムロジピン | 3.15±0.545 | 6.6±1.0 | 125±31.8 | 43.2±6.6 |
| アトルバスタチン | 3.61±1.54 | 1.0±0.7 | 21.4±8.73 | 11.0±3.6a) | |
| M-2 | 1.57±0.943 | 2.6±2.8 | 21.4±10.7 | NC |
(2)生物学的同等性
健康成人(4試験の合計170例)にアムロジピン・アトルバスタチン配合剤(アムロジピン/アトルバスタチンとして2.5mg/5mg、2.5mg/10mg、5mg/5mg又は5mg/10mgを含有;以下、配合剤)1錠と、アムロジピン錠(配合剤と同量のアムロジピンを含有)及びアトルバスタチン錠(配合剤と同量のアトルバスタチンを含有)各1錠を空腹時に単回投与した結果、配合剤投与とアムロジピン錠及びアトルバスタチン錠の併用投与は生物学的に同等であった。配合剤投与時のアムロジピン及びアトルバスタチンの薬物動態パラメータを表に示した(外国人データを含む)。6)7)8)9)
| 配合剤投与量 | アムロジピン | アトルバスタチン | ||
| Cmax(ng/mL) | AUCt(ng・h/mL) | Cmax(ng/mL) | AUCt(ng・h/mL) | |
| 2.5mg/5mg (N=36) | 1.26 | 50.5 | 1.40 | 11.5 |
| 2.5mg/10mg (N=40) | 1.18 | 50.4 | 3.31 | 24.9 |
| 5mg/5mg (N=39) | 3.32 | 125 | 1.34 | 8.84 |
| 5mg/10mg (N=55) | 2.84 | 124 | 3.18 | 21.3 |
16.1.2 アムロジピンとアトルバスタチン併用投与での成績
(1)単回投与
健康成人25例にアムロジピン10mg及びアトルバスタチン80mg注)の併用と、各製剤を単独で単回投与した結果、アムロジピンの薬物動態に対するアトルバスタチン併用投与の影響は認められなかった。アトルバスタチンのAUC0-∞はアムロジピン併用投与時に18%増加したが、Cmaxに対する影響は認められなかった(外国人データ)。10)
(2)反復投与
健康成人16例にアムロジピン10mg及びアトルバスタチン80mg注)の併用と、アトルバスタチン80mgを単独で1日1回8日間反復投与した結果、アトルバスタチンのCmaxに対するアムロジピン併用投与の影響は認められず、AUC0-lastは16%増加したが有意差は認められなかった(外国人データ)。11)
注)アトルバスタチンの国内承認用量は、高コレステロール血症では1日20mgまで、家族性高コレステロール血症では1日40mgまでである。
16.1.3 アムロジピン単独投与での成績
健康成人6例にアムロジピン2.5mgを1日1回14日間反復投与した場合の血清中濃度は投与開始6日目以降に定常状態に達した。最終投与日(14日目)のCmax及びAUC0-24hはそれぞれ3.5ng/mL及び61.8ng・h/mLであり、初回投与時(1.4ng/mL及び19.3ng・h/mL)の約3倍であった。投与中止後、血清中濃度は漸減し、投与中止5日目には0.24ng/mLとなった。12)
16.1.4 アトルバスタチン単独投与での成績
健康成人6例にアトルバスタチン10mg及び20mgを1日1回朝食後、7日間反復投与した結果、血漿中薬物濃度は投与開始後4日目までに定常状態に到達した。また、1日目と7日目の血漿中薬物濃度を比較すると、20mg投与群で上昇しているものの有意な差ではなく、蓄積性は認められなかった。13)
16.1.5 生物学的同等性試験
<アマルエット配合錠2番「トーワ」>
アマルエット配合錠2番「トーワ」とカデュエット配合錠2番を、クロスオーバー法によりそれぞれ1錠(アムロジピンとして2.5mg及びアトルバスタチンとして10mg)健康成人男子に絶食単回経口投与して血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った。その結果、アムロジピンにおいては、AUC及びCmaxについて対数値の平均値の差の90%信頼区間がlog(0.80)〜log(1.25)の範囲内であった。また、アトルバスタチンにおいて、AUCについては対数値の平均値の差の90%信頼区間がlog(0.80)〜log(1.25)の範囲内であり、Cmaxについては対数値の平均値の差がlog(0.90)〜log(1.11)で、かつ、溶出試験で規定するすべての条件で溶出挙動が類似していた。これより両剤の生物学的同等性が確認された。14)
(1)アムロジピン
| 判定パラメータ | 参考パラメータ | |||
| AUC0-72h(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| アマルエット配合錠2番「トーワ」 | 58.47±14.76 | 1.623±0.394 | 7.8±1.7 | 41.39±10.15 |
| カデュエット配合錠2番 | 61.60±16.12 | 1.682±0.416 | 7.8±1.2 | 41.10±8.35 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(2)アトルバスタチン
| 判定パラメータ | 参考パラメータ | |||
| AUC0-36h(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| アマルエット配合錠2番「トーワ」 | 37.70±13.53 | 5.627±2.822 | 1.00±1.12 | 9.79±1.55 |
| カデュエット配合錠2番 | 37.27±11.38 | 4.821±1.997 | 1.38±1.24 | 10.05±1.84 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<アマルエット配合錠3番「トーワ」>
アマルエット配合錠3番「トーワ」とカデュエット配合錠3番を、クロスオーバー法によりそれぞれ1錠(アムロジピンとして5mg及びアトルバスタチンとして5mg)健康成人男子に絶食単回経口投与して血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った。その結果、アムロジピン及びアトルバスタチンともに、AUC及びCmaxについて対数値の平均値の差の90%信頼区間がlog(0.80)〜log(1.25)の範囲内であった。これより両剤の生物学的同等性が確認された。14)
(1)アムロジピン
| 判定パラメータ | 参考パラメータ | |||
| AUC0-72h(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| アマルエット配合錠3番「トーワ」 | 120.2±33.0 | 3.324±0.789 | 7.4±1.4 | 43.41±10.84 |
| カデュエット配合錠3番 | 117.7±30.7 | 3.251±0.738 | 7.4±1.6 | 40.33±9.26 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(2)アトルバスタチン
| 判定パラメータ | 参考パラメータ | |||
| AUC0-36h(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| アマルエット配合錠3番「トーワ」 | 16.37±4.91 | 1.932±0.557 | 1.33±1.54 | 9.83±2.61 |
| カデュエット配合錠3番 | 16.27±5.62 | 2.040±0.957 | 0.74±0.37 | 9.72±2.81 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<アマルエット配合錠4番「トーワ」>
アマルエット配合錠4番「トーワ」とカデュエット配合錠4番を、クロスオーバー法によりそれぞれ1錠(アムロジピンとして5mg及びアトルバスタチンとして10mg)健康成人男子に絶食単回経口投与して血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った。その結果、アムロジピンにおいては、AUC及びCmaxについて対数値の平均値の差の90%信頼区間がlog(0.80)〜log(1.25)の範囲内であった。また、アトルバスタチンにおいて、AUCについては対数値の平均値の差の90%信頼区間がlog(0.80)〜log(1.25)の範囲内であり、Cmaxについては対数値の平均値の差がlog(0.90)〜log(1.11)で、かつ、溶出試験で規定するすべての条件で溶出挙動が類似していた。これより両剤の生物学的同等性が確認された。14)
(1)アムロジピン
| 判定パラメータ | 参考パラメータ | |||
| AUC0-72h(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| アマルエット配合錠4番「トーワ」 | 108.0±37.1 | 3.140±1.010 | 6.7±1.4 | 40.70±8.59 |
| カデュエット配合錠4番 | 109.9±33.2 | 3.158±0.961 | 7.0±1.0 | 40.95±10.93 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(2)アトルバスタチン
| 判定パラメータ | 参考パラメータ | |||
| AUC0-36h(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| アマルエット配合錠4番「トーワ」 | 29.34±12.09 | 4.126±1.569 | 1.08±0.61 | 8.67±1.39 |
| カデュエット配合錠4番 | 31.83±14.87 | 4.622±2.801 | 1.34±1.33 | 8.72±1.54 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 アムロジピン単独投与での成績
アムロジピンのヒト血漿蛋白との結合率は97.1%(in vitro、平衡透析法)であった。15)
16.3.2 アトルバスタチン単独投与での成績
ヒト血漿を用いたin vitroの実験で、アトルバスタチンの血漿蛋白結合率は95.6〜99.0%以上を示した。16)
16.4 代謝
16.5 排泄
16.5.1 アムロジピン単独投与での成績
アムロジピン2.5mg又は5mgを健康成人6例に単回経口投与した場合の投与後6日目までの尿中累積排泄率は、いずれの用量においても約8%であった。またアムロジピン2.5mgを1日1回14日間反復投与した場合の尿中排泄率は投与開始6日目でほぼ定常状態に達し、6日目以降の1日当たりの未変化体の尿中排泄率は6.3〜7.4%であった。12)
健康成人2例に14C-標識アムロジピン15mgを単回経口投与した場合、投与12日目までに投与放射能の59.3%は尿中、23.4%は糞中に排泄され、尿中放射能の9%は未変化体であり、その他に9種の代謝物が認められた(外国人データ)。19)
なお、これら代謝物にはアムロジピンをしのぐ薬理作用は認められていない。19)
健康成人2例に14C-標識アムロジピン15mgを単回経口投与した場合、投与12日目までに投与放射能の59.3%は尿中、23.4%は糞中に排泄され、尿中放射能の9%は未変化体であり、その他に9種の代謝物が認められた(外国人データ)。19)
なお、これら代謝物にはアムロジピンをしのぐ薬理作用は認められていない。19)
16.5.2 アトルバスタチン単独投与での成績
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能正常者8例及び腎機能障害者11例にアトルバスタチン10mgを1日1回14日間反復投与したとき、腎機能障害は、アトルバスタチンの薬効及び体内動態に影響を及ぼさなかった(外国人データ)。23)
16.6.2 肝機能障害患者
(1)アムロジピン単独投与での成績
(2)アトルバスタチン単独投与での成績
16.6.3 高齢者
16.8 その他
<アマルエット配合錠1番「トーワ」>
アマルエット配合錠1番「トーワ」は、アマルエット配合錠4番「トーワ」を標準製剤としたとき、溶出挙動が同等と判断され、生物学的に同等とみなされた。14)
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第III相試験
高血圧症と高脂血症を併発している患者1660例を対象とした二重盲検試験において、アムロジピンとアトルバスタチンの併用投与(5mg+10mg、5mg+20mg、5mg+40mg、5mg+80mg、10mg+10mg、10mg+20mg、10mg+40mg、10mg+80mg)注)とアムロジピン単独投与(5mg、10mg)又はアトルバスタチン単独投与(10mg、20mg、40mg、80mg)注)を比較した。投与8週後のSBP降圧作用及びLDL-C低下作用は以下のとおりであり、アムロジピン及びアトルバスタチンを併用投与した場合でも、アムロジピンのSBP降圧作用及びアトルバスタチンのLDL-C低下作用に臨床上問題となる影響は認められなかった。
| パラメータ/解析 | アトルバスタチン | ||||||
| 0mg | 10mg | 20mg | 40mg | 80mg | |||
| アムロジピン | 5mg | 平均変化量(mmHg) | −12.6 | −13.6 | −15.3 | −12.8 | −12.6 |
| アムロジピン単独投与との差 | − | −1.0 | −2.7 | −0.2 | 0.1 | ||
| 10mg | 平均変化量(mmHg) | −16.5 | −15.9 | −16.0 | −16.5 | −17.5 | |
| アムロジピン単独投与との差 | − | 0.6 | 0.5 | 0.0 | −1.1 | ||
| パラメータ/解析 | アトルバスタチン | |||||
| 10mg | 20mg | 40mg | 80mg | |||
| アムロジピン | 0mg | 平均変化率(%) | −33.5 | −39.5 | −43.1 | −47.0 |
| 5mg | 平均変化率(%) | −39.0 | −42.2 | −44.9 | −48.2 | |
| アトルバスタチン単独投与との差 | −5.5 | −2.8 | −1.8 | −1.2 | ||
| 10mg | 平均変化率(%) | −36.6 | −38.6 | −43.2 | −49.2 | |
| アトルバスタチン単独投与との差 | −3.2 | 0.9 | −0.2 | −2.2 | ||
注)アトルバスタチンの国内承認用量は、高コレステロール血症では1日20mgまで、家族性高コレステロール血症では1日40mgまでである。
副作用の発現率は、アトルバスタチン群(18%)及びプラセボ群(17%)と比較して、アムロジピン+アトルバスタチン群及びアムロジピン群で10%程度高かったが、アムロジピン+アトルバスタチン群(29%)とアムロジピン群(27%)の発現率は同程度であった。アムロジピン+アトルバスタチン群で認められた主な副作用は、末梢性浮腫(8.1%)、頭痛(3.6%)、浮動性めまい(2.1%)及びγ-GTP増加(1.8%)であった(外国人データ)。27)
<高血圧症>
17.1.2 国内臨床試験
17.1.3 国内第III相試験
アムロジピンとして5mgを1日1回8週間投与後に、収縮期血圧が140mmHg以上を示す患者305例を2群に分けて、アムロジピンとして10mg又は5mgを1日1回8週間投与したときの収縮期血圧のベースラインからの変化量の平均値は、10mg群で13.7mmHgの低下、5mg群で7.0mmHgの低下であり、両群間に統計的に有意な差がみられた。
<高コレステロール血症>
17.1.4 国内後期第II相試験
高脂血症患者243例を対象に、アトルバスタチンを1日1回夕食後12週間投与した際の血清脂質改善作用の用量反応関係及び安全性を4用量(2.5mg、5mg、10mg又は20mg)による二重盲検群間比較法により実施した。アトルバスタチン5〜20mgを1日1回夕食後に投与した際の血清脂質値の変化率及び総コレステロール<220mg/dLとなった症例の割合(総コレステロール<220mg/dL割合)、LDL-コレステロール<150mg/dLとなった症例の割合(LDL-コレステロール<150mg/dL割合)は下記の通りである。
| 用量(mg) | 例数 | 総コレステロール(%) | トリグリセリド(%) | HDL-コレステロール(Δmg/dL) |
| 5 | 51 | −25.0 | −19.7 | 3.2 |
| 10 | 51 | −30.2 | −16.7 | 5.2 |
| 20 | 52 | −33.8 | −12.0 | 6.1 |
| 用量(mg) | 例数 | LDL-コレステロール(%) | 総コレステロール<220mg/dL割合(%) | LDL-コレステロール<150mg/dL割合(%) |
| 5 | 51 | −32.0 | 56.9 | 74.5 |
| 10 | 51 | −39.6 | 72.5 | 86.3 |
| 20 | 52 | −49.5 | 86.5 | 90.4 |
<家族性高コレステロール血症>
17.1.5 家族性高コレステロール血症患者ヘテロ対象試験(国内)
17.1.6 家族性高コレステロール血症患者ホモ対象試験(国内)
LDL-アフェレーシスを施行している家族性高コレステロール血症ホモ接合体患者9例に、アトルバスタチン10mgを8週間投与し、その後20mg(8週間)、40mg(8〜20週)へと漸増投与した。その結果、6例で総コレステロールが−31.4〜−4.9%、LDL-コレステロールが−39.3〜−4.6%と低下した。他の3例では総コレステロールが1.2〜15.2%、LDL-コレステロールが3.1〜11.8%と増加した。低下が認められた症例のうち4例ではアトルバスタチン投与前に2剤以上を併用した薬物療法とほぼ同程度の総コレステロール及びLDL-コレステロール低下が認められた。副作用は11.1%(1/9例)、関連性が否定されなかった臨床検査値異常変動は44.4%(4/9例)に認められ、副作用は、右手しびれ(感)であった。なお、重篤な副作用及び臨床検査値異常変動の発現は認められなかった。41)
18. 薬効薬理
18.1 作用機序
18.1.1 アムロジピンは細胞膜の膜電位依存性カルシウムチャンネルに特異的に結合し、細胞内へのCa2+の流入を減少させることにより、冠血管や末梢血管の平滑筋を弛緩させる。カルシウム拮抗作用の発現は緩徐であり、持続的である。また、心抑制作用は弱く、血管選択性が認められている。42)43)44)
18.1.2 アトルバスタチンは血液中のコレステロール量を調節する主要臓器である肝臓のHMG-CoA還元酵素を選択的かつ競合的に阻害し、アトルバスタチンと同程度の活性を有する代謝物とともに、肝臓のコレステロール合成を抑制する。その結果、アトルバスタチンは肝臓のLDL受容体数を増加させ、かつリポ蛋白分泌を抑制することにより血中脂質量を低下させる。また、アトルバスタチンは血中脂質動態を改善して、高コレステロール血症に伴う動脈硬化の発症を抑制する。45)
18.2 アムロジピンの降圧作用
各種高血圧病態モデル(高血圧自然発症ラット、腎性高血圧ラット・イヌ)においてアムロジピン1日1回投与により持続的な降圧作用が認められ、20日間の連続投与によっても耐性は生じなかった。46)
18.3 アムロジピンの高血圧に伴う心血管障害への作用
18.4 アムロジピンの抗狭心症作用
18.5 アトルバスタチンのコレステロール合成抑制作用
18.6 高脂血症モデル動物におけるアトルバスタチンの脂質低下作用
18.6.1 コレステロール低下作用
18.6.2 トリグリセリド低下作用
18.7 動脈硬化進展抑制作用
18.8 代謝物の薬理作用
ラット肝ミクロソームにおいて、ヒトにおける主代謝物であるアミド結合位置のベンゼン環の4位の水酸化体(M-1)及び2位の水酸化体(M-2)は、アトルバスタチンと同程度のHMG-CoA還元酵素阻害活性を示した。58)
18.9 リポ蛋白代謝に対する作用
HepG2細胞において、アトルバスタチンは細胞内コレステロール含量を低下させるとともに、肝LDL受容体mRNA発現量及び肝LDL受容体活性を増加させ、アポB分泌量及びトリグリセリド分泌量を低下させた。正常モルモットにおいて、アトルバスタチンは肝LDL受容体活性を増加させるとともに、VLDL-アポB分泌速度を低下させた。コレステロール負荷ミニブタにおいて、アトルバスタチンはVLDL-アポB産生速度を低下させた。LDL受容体欠損マウスにおいて、アトルバスタチンはコレステロール分泌速度を低下させた。ショ糖負荷高トリグリセリド血症ラットにおいて、アトルバスタチンはトリグリセリド分泌速度を低下させた。54)55)57)59)60)61)
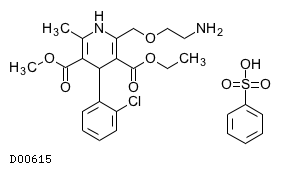
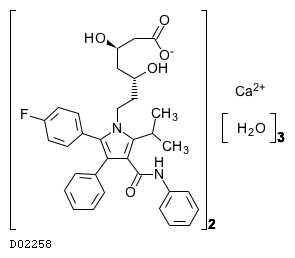
19. 有効成分に関する理化学的知見
19.1. アムロジピンベシル酸塩
19.2. アトルバスタチンカルシウム水和物
22. 包装
<アマルエット配合錠1番「トーワ」>
100錠[10錠×10:PTP、乾燥機能付き脱酸素剤入り]
<アマルエット配合錠2番「トーワ」>
100錠[10錠×10:PTP、乾燥機能付き脱酸素剤入り]
<アマルエット配合錠3番「トーワ」>
100錠[10錠×10:PTP、乾燥機能付き脱酸素剤入り]
<アマルエット配合錠4番「トーワ」>
100錠[10錠×10:PTP、乾燥機能付き脱酸素剤入り]
23. 主要文献
- 堀本政夫ほか, 応用薬理, 42 (2), 167-176, (1991)
- Naito,T.et al., J Hum Lact., 31 (2), 301-306, (2015) »PubMed
- 桑島巌ほか, Geriatric Medicine., 29 (6), 899-902, (1991)
- Laine,K.et al., Br J Clin Pharmacol., 43 (1), 29-33, (1997) »PubMed
- 健康成人における単回投与時の安全性と薬物動態ならびに食事の影響(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.1.2、2.7.2.3)
- 2.5mg/5mgの生物学的同等性(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.1.2)
- 2.5mg/10mgの生物学的同等性(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.1.2)
- 5mg/5mgの生物学的同等性(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.1.2)
- 5mg/10mgの生物学的同等性(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.1.2)
- アムロジピンとアトルバスタチンとの薬物相互作用(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.2.2)
- アムロジピンのアトルバスタチンに対する作用(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.2.2)
- 中島光好ほか, 臨床医薬, 7 (7), 1407-1435, (1991)
- 大石紫満子ほか, 薬理と治療, 26 (8), 1279-1293, (1998)
- 陶易王ほか, 医学と薬学, 72 (10), 1723-1762, (2015)
- 分布(ユニシア配合錠:2010年4月16日承認、申請資料概要2.6.4.4)
- 根本裕之ほか, 薬理と治療, 26 (8), 1229-1240, (1998)
- 大石紫満子ほか, 薬理と治療, 26 (8), 1253-1266, (1998)
- アトルバスタチンのヒトミクロソームにおけるin vitro代謝(リピトール錠:2000年3月10日承認、申請資料概要へ.3.(7).4))
- Beresford,A.P.et al., Xenobiotica., 18 (2), 245-254, (1988) »PubMed
- 14C-アトルバスタチン投与時の尿及び糞中排泄率(リピトール錠:2000年3月10日承認、申請資料概要へ.3.(8))
- 14C-アトルバスタチン投与時の糞中排泄率(リピトール錠:2000年3月10日承認、申請資料概要へ.3.(7))
- 14C-アトルバスタチン投与時の胆汁中排泄率(カデュエット配合錠:2009年7月7日承認、申請資料概要2.5.3.(2))
- Stern,R.H.et al., J Clin Pharmacol., 37 (9), 816-819, (1997) »PubMed
- 足立幸彦ほか, 薬理と治療, 19 (7), 2923-2932, (1991)
- 肝硬変患者におけるアトルバスタチンの薬物動態(リピトール錠:2000年3月10日承認、申請資料概要へ.3.(6).5))
- 大石紫満子ほか, 薬理と治療, 26 (8), 1295-1305, (1998)
- 高血圧症及び高脂血症併発患者に対するアムロジピンとアトルバスタチン併用の臨床効果(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.3.2、2.7.3.3、2.7.6.2)
- 増山善明ほか, 薬理と治療, 19 (7), 2853-2871, (1991)
- 増山善明ほか, 薬理と治療, 19 (7), 2873-2893, (1991)
- 増山善明ほか, 薬理と治療, 19 (7), 2895-2908, (1991)
- 増山善明ほか, 臨床評価, 19 (2), 213-241, (1991)
- 猿田享男ほか, 薬理と治療, 21 (2), 505-526, (1993)
- 山田和生ほか, 薬理と治療, 19 (8), 3189-3203, (1991)
- アムロジピンの高血圧症に対する有効性および安全性(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.3.4)
- Fujiwara,T.et al., J Hum Hypertens., 23 (8), 521-529, (2009) »PubMed
- アムロジピン5mgで効果不十分な患者に対するアムロジピン10mg長期投与時の安全性及び有効性(ノルバスク錠/OD錠・アムロジン錠/OD錠:2009年2月23日承認、審査報告書)
- 中村治雄ほか, Progress in Medicine., 18 (7), 1690-1723, (1998)
- アトルバスタチンの後期第II相試験(用量設定試験)(リピトール錠:2000年3月10日承認、申請資料概要ト.1.(3))
- 山村卓ほか, 臨床医薬, 14 (11), 2031-2054, (1998)
- 家族性高コレステロール血症ヘテロ接合体患者に対するアトルバスタチンの臨床効果(リピトール錠:2000年3月10日承認、申請資料概要ト.1.(7).1))
- 家族性高コレステロール血症ホモ接合体患者に対するアトルバスタチンの臨床効果(リピトール錠:2000年3月10日承認、申請資料概要ト.1.(7).2))
- 山中教造ほか, 日本薬理学雑誌, 97 (3), 167-178, (1991) »PubMed
- Yamada,S.et al., J Cardiovasc Pharmacol., 23 (3), 466-472, (1994) »PubMed
- Burges,R.A.et al., J Cardiovasc Pharmacol., 9 (1), 110-119, (1987) »PubMed
- アトルバスタチンの作用機序(リピトール錠:2000年3月10日承認、申請資料概要ホ.1.7、ホ.1.8)
- 山中教造ほか, 日本薬理学雑誌, 97 (2), 115-126, (1991) »PubMed
- Fleckenstein,A.et al., Am J Cardiol., 64 (17), 21I-34I, (1989)
- Suzuki,M.et al., Eur J Pharmacol., 228 (5-6), 269-274, (1993) »PubMed
- Nayler,W.G., Am J Cardiol., 64 (17), 65I-70I, (1989)
- 田村裕男ほか, 薬理と治療, 18 (Suppl.2), S339-S345, (1990)
- 舩津敏之ほか, 薬理と治療, 26 (9), 1435-1441, (1998)
- 田中秀行ほか, 薬理と治療, 26 (9), 1451-1454, (1998)
- Bocan,T.M.et al., Atherosclerosis., 111 (1), 127-142, (1994) »PubMed
- Burnett,J.R.et al., Arterioscler Thromb Vasc Biol., 17 (11), 2589-2600, (1997) »PubMed
- Bisgaier,C.L.et al., J Lipid Res., 38 (12), 2502-2515, (1997) »PubMed
- 荒井幸規ほか, 薬理と治療, 26 (9), 1475-1481,1483-1486, (1998)
- 鈴木雅徳ほか, 薬理と治療, 26 (9), 1469-1474, (1998)
- アトルバスタチン代謝物の薬理作用(リピトール錠:2000年3月10日承認、申請資料概要ホ.1.7)
- 舩津敏之ほか, 薬理と治療, 26 (9), 1443-1450, (1998)
- Funatsu,T.et al., Atherosclerosis., 157 (1), 107-115, (2001) »PubMed
- 角田裕俊ほか, 薬理と治療, 26 (9), 1461-1468, (1998)
24. 文献請求先及び問い合わせ先
文献請求先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
製品情報問い合わせ先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
26. 製造販売業者等
26.1 製造販売元
東和薬品株式会社
大阪府門真市新橋町2番11号